Место антигистаминных препаратов в алгоритме лечения хронической крапивницы
- Аннотация
- Статья
- Ссылки
- English


Введение
Хроническая крапивница (ХК) относится к этиологически гетерогенной группе заболеваний и состояний, объединенных основным симптомом и первичным кожным элементом – волдырем. ХК характеризуется развитием спонтанных или индуцированных зудящих уртикарных высыпаний с ангиоотеками или без них и продолжается свыше шести недель.
Распространенность ХК составляет 0,1–3% в популяции [1].
По данным опроса, проведенного в Германии, риск развития ХК на протяжении жизни составляет 1,8% [2].
Проблема ХК многогранна: заболевание существенно нарушает различные аспекты жизни пациента и ложится тяжелым бременем на систему здравоохранения и общество.
Дебют ХК возможен у пациентов любого возраста, но чаще заболевание поражает наиболее социально активную и трудоспособную часть населения в возрасте 20–40 лет [3]. Продолжительность заболевания в среднем составляет от года до пяти лет. У 14% больных наблюдаются периодические обострения свыше пяти лет.
Снижение качества жизни, обусловленное ХК, значительно больше или аналогично таковому при других дерматологических заболеваниях, включая псориаз, акне, атопический дерматит [2].
Согласно результатам ASSURE-CSU – первого международного наблюдательного исследования, посвященного оценке экономического и социального бремени ХК у пациентов с неадекватным контролем, заболевание существенно нарушает сон и повседневную активность, негативно отражается на профессиональной деятельности: временная нетрудоспособность имеет место более чем в 20% случаев, снижение производительности труда – в 27% [4]. Вместе с тем ХК – одно из самых дорогостоящих заболеваний, представляющих проблему как для системы здравоохранения в целом, так и для пациентов и их семей в частности. По данным фармакоэкономического анализа, прямые и непрямые затраты на лечение больного ХК в США в среднем достигают 2047 долл. в год [5].
Таким образом, проблема хронической крапивницы, несмотря на определенные достижения в ее изучении и терапии, остается актуальной для мирового и отечественного здравоохранения.
Последние десятилетия неоднократно пересматривались вопросы патогенеза, классификации, подходы к лечению и профилактике ХК. Эти изменения связаны прежде всего с накоплением и появлением новых научных данных, созданием современных препаратов, влияющих на иммунологическую природу заболевания. В 2015 г. были опубликованы Федеральные клинические рекомендации по лечению крапивницы, изданные Российской ассоциацией аллергологов и клинических иммунологов [6]. Изложенные в них основные подходы к ведению пациентов с хронической крапивницей соответствуют таковым международных согласительных документов. Международный консенсус по лечению крапивницы и ангиоотека впервые был принят в 2004 г. в ходе группового обсуждения на 2-м Международном совещании по определению тактики ведения пациентов с крапивницей и ангиоотеком. Это совместная инициатива секции дерматологии Европейской академии аллергологии и клинической иммунологии (European Academy of Allergy and Clinical Immunology, EAACI), Европейской глобальной сети аллергии и астмы (Global Allergy and Asthma European Network, GA²LEN), Европейского дерматологического форума (European Dermatology Forum, EDF) и Всемирной аллергологической организации (World Allergy Organization, WАО). С 2008 по 2012 г. согласительный документ регулярно пересматривался и дополнялся. Последняя конференция по обсуждению и пересмотру международного руководства по крапивнице состоялась в декабре 2016 г. в Берлине. Принятый на этом заседании документ должен быть в ближайшее время опубликован в европейском аллергологическом журнале Allergy. В руководстве по ведению пациентов с ХК и ангиоотеком приведены определение и классификация заболевания с учетом последних научных достижений, перечислены факторы, провоцирующие его, проанализированы особенности патогенеза. Кроме того, в документе обозначены диагностические методики в отношении подтипов крапивницы и предложен алгоритм лечения. К сожалению, в реальной клинической практике врачи часто используют эмпирические подходы и не учитывают рекомендации российских и международных согласительных документов по лечению крапивницы и ангиоотека. Недостаточное информирование врачей общей практики и узких специалистов о причинах и особенностях течения данного заболевания приводит не только к ошибкам в терапии, но и резкому снижению комплаентности.
Еще в 2012 г. в классификации ХК появился термин «спонтанная хроническая крапивница», который пришел на смену термину «идиопатическая крапивница». Как известно, в большинстве случаев (66–93%) хронической крапивницы имеет место хроническая спонтанная крапивница (ХСК) [2]. Это новый термин, объединяющий всех пациентов с хронической идиопатической крапивницей (55%) или хронической аутоиммунной крапивницей (45%) [7].
Основным проявлением ХСК является ежедневное или практически ежедневное появление волдырей и/или ангиоотеков вследствие неизвестных стимулов (спонтанно), которые беспокоят пациента на протяжении свыше шести недель.
Волдырь представляет собой локальный отек сосочкового слоя дермы и характеризуется:
- ограниченным отеком кожи, разнообразными формами и размерами (окруженный зоной гиперемии), возникновением на любом участке кожи;
- в большинстве случаев кожным зудом;
- быстрым возникновением и полным разрешением в течение 24 часов (от нескольких минут до нескольких часов) без формирования вторичных элементов.
По данным ретроспективного анализа, проведенного в пяти странах Европы (Франция, Германия, Италия, Испания и Великобритания), с 2011 по 2013 г. частота заболеваемости ХСК составила 0,63% в популяции [8]. В современной классификации крапивницы также представлены индуцированная и другие формы ХК, развивающиеся после воздействия определенных стимулов (тепло, холод, физическая нагрузка и др.) (табл. 1).
Диагностика
Общий диагностический алгоритм для ХК, закрепленный в международных и российских рекомендациях, предполагает тщательный сбор анамнеза заболевания и проведение объективного осмотра, по возможности – выявление и устранение всех триггерных факторов, провоцирующих клинические проявления заболевания. Роль рутинного лабораторного обследования ограниченна. Обратите внимание: не всегда следует углубляться в диагностический поиск причины заболевания, поскольку в 80–95% случаев он нерезультативен. Попытки выяснить этиологию крапивницы должны быть предприняты у лиц с длительным и/или тяжелым течением ХК. Важно информировать пациентов, что в большинстве случаев ХСК идентификация причин заболевания маловероятна. При указании в анамнезе на связь уртикарных высыпаний с различными триггерами рекомендуется выполнение провокационных тестов (воздействие холодовых стимулов при подозрении на холодовую крапивницу или применение дерматографометра для провокации симптоматического дермографизма). Это позволяет подтвердить релевантность и установить порог чувствительности у пациентов с физической/индуцированной формой ХК.
Рекомендованные диагностические тесты и шкалы могут помочь идентифицировать подтипы ХК и сузить дифференциально-диагностический поиск, а впоследствии подобрать адекватную терапию.
Оценка активности крапивницы
Цель лечения ХК – достижение значимого уменьшения выраженности симптомов (до полного исчезновения) при минимальном количестве побочных эффектов. Для объективной оценки результативности назначенной врачом терапии необходимо определить активность заболевания в начале лечения и во время следующих визитов. Для этой цели используется балльная система UAS7 (Urticaria Activity Score 7) (табл. 2) или индекс активности крапивницы для оценки тяжести заболевания и результатов лечения спонтанной крапивницы. Необходимо учитывать, что степень тяжести заболевания может со временем меняться и требует регулярного пересмотра. Понятие «контроль» – это текущая оценка достижения целей лечения. UAS7 предполагает суммарную оценку основных симптомов заболевания (количество высыпаний и интенсивность зуда) самим пациентом каждые 24 часа в течение семи последовательных дней. Оценка активности крапивницы – обязательный инструмент для использования в реальной клинической практике, она удобна и для пациентов, и для врачей. При физической крапивнице необходимо учитывать прежде всего интенсивность наносимого стимула для реализации развития симптомов. Данная шкала не используется у пациентов с индуцированной/физической крапивницей.
Лечение
Подбор терапии при ХСК – задача чрезвычайно сложная. На выбор метода лечения влияет множество факторов, в том числе лицензионный статус лекарственных средств, их безопасность, клиническая картина и тяжесть заболевания, индивидуальный «портрет» болезни пациента.
Международное и федеральное руководства по крапивнице предлагают трехступенчатый подход к лечению ХСК [2, 6]. Препаратами первой линии остаются неседативные антигистаминные препараты (АГП) второго поколения. Они лишены побочных эффектов, присущих их предшественникам – АГП первого поколения, эффективно блокируют Н1-рецепторы к гистамину и подавляют симптомы крапивницы: оказывают выраженное угнетающее действие на развитие воспалительной реакции, подавляя отек и гиперемию, при этом не связываясь с другими типами гистаминовых рецепторов.
В соответствии с Международным руководством по лечению крапивницы (EAACI/GA2LEN/EDF/WAO management guideline), АГП первого поколения (седативные) не должны использоваться в качестве первоочередного лечения больных крапивницей. Исключением могут быть только ситуации, когда применение АГП второго поколения невозможно.
Лечение пациентов с ХК по-прежнему начинается с АГП в стандартных терапевтических дозах, продолжительность приема – до двух недель. Назначение лекарственного средства должно основываться на мнении врача/пациента. Чаще пациенту на выбор предлагаются два-три АГП второго поколения. Несмотря на то что аллергологи-иммунологи чаще других специалистов назначают АГП и лучше ознакомлены с их фармакологическими особенностями, вопросы возникают и у них. Иногда трудно понять, на чем основано применение того или иного АГП, какова оптимальная длительность их использования (обычно от пяти до десяти дней). Необоснованность выбора самого препарата, длительности его применения, неоправданная смена АГП в начале лечения у одного пациента наводят на мысль, что специалисты скорее основываются на спорадически выработанных предпочтениях, чем на результатах контролируемых исследований и рекомендациях, закрепленных в соответствующих согласительных документах [9].
При назначении АГП нужно учитывать, что различия в фармакодинамике воздействия на кожные реакции при крапивнице коррелируют с кинетикой связывания с Н1-рецепторами. Так, препараты с высокой степенью аффинности к Н1-рецепторам характеризуются более продолжительным взаимодействием с рецепторами, что обеспечивает длительность подавления кожных реакций – образования волдырей и гиперемии [10].
Основные фармакодинамические эффекты АГП изучали в сравнительных исследованиях на моделях in vivo гистамин-индуцированной и аллерген-индуцированной крапивницы у здоровых добровольцев и пациентов с атопией [11]. Результаты таких исследований позволяют оценить степень подавления препаратами образования волдырей и гиперемии (степень уменьшения площади в процентах), эквипотенциальные характеристики препаратов и разных доз, время начала действия и продолжительность действия разовой дозы, а также гомогенность или вариабельность эффекта в стандартизованных условиях модели. Тесты на моделях с гистамин-индуцированной крапивницей характеризуют эффективность АГП в ранней реакции, тогда как применение аллерген/антигенов в моделях крапивницы позволяет оценить эффективность препаратов при ранней и поздней реакции. В исследованиях на моделях крапивницы показаны преимущества цетиризина и его метаболита левоцетиризина наряду с фексофенадином. Лоратадин продемонстрировал минимальный эффект подавления кожной реакции. Подтверждены преимущества левоцетиризина и цетиризина в подавлении гистамин-индуцированной кожной реакции. Сравнительный ряд выглядит так: левоцетиризин > цетиризин > фексофенадин 180 мг = фексофенадин 120 мг > лоратадин = дезлоратадин [12, 13].
Результаты недавнего исследования по прогнозированию эффективности АГП при ХСК, основанному на начальной супрессии гистамин-индуцированного волдыря, показали равную эффективность и безопасность АГП второго поколения (цетиризин, биластин, фексофенадин, дезлоратадин, эбастин) [14]. Примечательно, что после увеличения дозы АГП второго поколения уровень контроля ХСК увеличился с 58,7 до 76,7%.
Как показывает практика, пациенты часто отказываются от ежедневного приема АГП и переходят на использование в режиме «по требованию». Между тем во всех руководствах пациентам с ХК рекомендуется принимать АГП второго поколения регулярно, в течение длительного времени, а не по требованию. В связи с этим, прежде чем говорить о недостаточном ответе на терапию на первом этапе и переходить ко второму, необходимо убедиться, что пациент принимает препарат в назначенной дозе и по рекомендованной схеме. На втором этапе терапии пациентам, не ответившим на стандартные дозы АГП, прогрессивно увеличивают дозу препарата до четырехкратной. Эксперты рекомендуют увеличивать дозу одного Н1-АГП, а не комбинировать разные.
Опыт показывает, что примерно 50% пациентов с ХСК отвечают на стандартные дозы АГП, 10–25% больных – на высокие дозы. По данным специализированных клиник, свыше 96% больных ХСК нечувствительны к высокодозовой терапии АГП [2].
Установлено, что повышение дозы АГП способно улучшить контроль симптомов ХК. Этот подход рекомендован европейскими и российскими экспертами и широко распространен, несмотря на то что четырехкратная доза не одобрена для клинического применения ни для одного АГП, прежде всего из-за недостаточной доказательной базы в отношении безопасности высоких доз. Вместе с тем эффективность высоких доз АГП продемонстрирована в ряде клинических исследований и подтверждена реальной клинической практикой.
Имеются предварительные данные о биластине – новом селективном H1-АГП, принадлежащем к производным пиперидина. Стандартная рекомендуемая доза биластина – 20 мг однократно в сутки. Препарат несколько отличается от других представителей своего класса. В исследованиях in vitro показана высокая специфическая аффинность биластина к Н1-рецепторам при очень низкой аффинности к другим рецепторам. По данному показателю биластин в три раза превосходит цетиризин и в пять раз – фексофенадин.
В двойном слепом клиническом исследовании (фаза I) однократную дозу с четырьмя перекрестными периодами назначали 21 добровольцу. Пациенты были разделены на группы плацебо, цетиризина 10 или 2,5, 5 мг, биластина 10 или 50 мг. Исследователи оценивали взаимосвязь между дозой биластина и ингибированием кожного ответа на гистамин (посредством оценки волдыря и очага гиперемии). Каждая доза биластина снижала количество гистамин-индуцированных волдырей в течение 1,5–12 часов и гиперемии в течение 4–24 часов после приема препарата. То есть реакция на фоне приема биластина была аналогичной или более выраженной, чем после приема цетиризина. Очевидного дозозависимого эффекта не наблюдалось, тем не менее на фоне приема препарата 20 и 50 мг отмечался более длительный эффект [15].
Фаза II исследования охватывала 222 пациента с ХК. Эффективность биластина в дозах 10, 20 и 30 мг в снижении появления папул и кожного зуда сравнивали с плацебо в контрольной группе. Статистически значимые различия наблюдались в трех терапевтических группах, принимавших биластин, по сравнению с группой плацебо. При этом дозозависимый эффект отсутствовал [16].
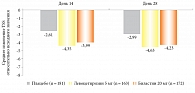
В двойном слепом контролируемом клиническом исследовании эффективность биластина сравнивали с таковой плацебо и левоцетиризина, которые пациенты принимали в течение 28 дней. Оценку проводили на основе данных дневников пациентов в отношении зуда, количества волдырей и их максимального размера. Симптомы стихали на второй день при использовании биластина 20 мг и левоцетиризина, результаты превышали таковые плацебо (рисунок) [17].
В другом пилотном исследовании сравнивали эффективность высоких доз АГП второго поколения у больных холодовой крапивницей. Биластин 80 мг продемонстрировал эффективность у пациентов с хронической холодовой крапивницей. Какие-либо нежелательные побочные эффекты, в том числе седативный, отсутствовали [18]. Это неудивительно, поскольку препарат обладает хорошей переносимостью и безопасностью.
Биластин практически не подвергается метаболизму (95% препарата выводится в неизмененном виде с мочой или фекалиями) и не взаимодействует с CYP 450, поэтому вероятность его вовлечения в лекарственные взаимодействия достаточно низкая. При нарушениях функции печени и почек коррекции дозы препарата не требуется. В исследованиях не зафиксированы кардиотоксичность даже при использовании повышенных доз препарата, влияние на психомоторную работоспособность при сочетанном приеме алкоголя, других депрессантов (например, лоразепама) [19, 20]. Биластин в дозе 40 мг/сут не влияет на вождение автомобиля [19].
Таким образом, применение биластина, в том числе в четырехкратных дозах, открывает новые перспективы в лечении пациентов с хронической крапивницей.
При назначении высоких доз АГП врач должен помнить, что данный алгоритм выходит за рамки инструкции. При необходимости такого лечения следует получить информированное согласие пациента, а также сделать запись в медицинских документах (истории болезни, амбулаторной карте больного) о показаниях к подобной терапии, основанных на заключении консилиума.
Третий этап ступенчатой терапии пациентов с хронической крапивницей включает помимо АГП второго поколения дополнительное лечение. Если изменение дозы АГП второго поколения не способствует значительному уменьшению выраженности симптомов ХСК (UAS ≤ 6) и/или вследствие побочных эффектов высоких доз препаратов, необходимых для достижения клинического улучшения, эта терапия неприемлема, следует рассмотреть вопрос о добавлении омализумаба. Омализумаб зарегистрирован для лечения пациентов с ХК, рефрактерной к АГП второго поколения.
При неэффективности омализумаба можно назначить альтернативные препараты: циклоспорин А, дапсон, колхицин, сульфасалазин либо антилейкотриеновые препараты. Среди зарегистрированных показаний к применению перечисленных препаратов ХК не значится. Поэтому подобная терапия также выходит за рамки инструкции, но в отличие от применения АГП второго поколения в четырехкратных дозах характеризуется недостаточной доказательной базой. При выборе соответствующей терапии нужно принимать во внимание преимущества и недостатки каждого препарата, особенность течения заболевания у конкретного пациента.
Международные рекомендации существенно ограничили роль системных глюкокортикостероидов (ГКС) в лечении ХСК из-за развития тяжелых побочных эффектов при длительном применении. Во многих странах преднизолон не лицензирован для терапии ХК, его используют только при острых состояниях. Применение пероральных ГКС коротким курсом рекомендовано при тяжелых обострениях ХК.
Заключение
Несмотря на обширную научно-доказательную базу в отношении хронической крапивницы, ведение пациентов с данной нозологией остается трудной задачей и требует от врача высокого профессионализма. Назначая лечение в каждом конкретном случае, врач должен уметь выходить за рамки обычных стандартов.
АГП второго поколения, зачастую требующие длительного применения, являются основными базисными препаратами в терапии хронической крапивницы. Ярким представителем этой группы является биластин, продемонстрировавший в клинических исследованиях и реальной практике безопасность и эффективность в контроле над симптомами ХК.
O.S. Bodnya
Russian Medical Academy for Continuing Professional Education
Contact person: Olga Sergeyevna Bodnya, os.bodnya@yandex.ru
This article is devoted to the role of the second generation antihistamines in the treatment of chronic urticaria. The features of the regimen for the use of the second generation antihistamines in this disease are highlighted. Particular attention is paid to the new representative of this group of drugs – bilastin. High efficacy and safety of the drug in patients with chronic urticaria is underlined.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.