Боль в спине у пациентов с остеопорозом: возможности симптоматической терапии
- Аннотация
- Статья
- Ссылки
Синдром боли в спине (БС) широко распространен в популяции, особенно среди лиц пожилого возраста. Процесс старения населения рассматривается в настоящее время как одна из основных причин прогнозируемого роста частоты дегенеративных и метаболических заболеваний скелета. Вышеуказанный глобальный демографический тренд распространяется на все страны мира, сопровождаясь ростом общей заболеваемости населения. При этом отмечается опережающий темп увеличения доли больных с заболеваниями костно-мышечной системы (XIII класс Международной классификации болезней 10-го пересмотра – МКБ-10).
Одно из заболеваний, при котором БС встречаются достаточно часто, – остеопороз (ОП). Это медленно прогрессирующее заболевание, характеризующееся увеличением хрупкости костей и повышением риска возникновения переломов. Боль при этой патологии может быть как острой, так и хронической [1]. Вновь возникший перелом тела позвонка является причиной острой боли, которая может иррадиировать в грудную клетку, брюшную полость или бедро и резко ограничивает движения. При этом характерно отсутствие симптомов выпадения (двигательные и чувствительные нарушения). Острая боль обычно становится менее интенсивной к 3–4-й неделе и проходит к 3–4-му месяцу. Хроническая БС (продолжающаяся более 12 недель) при ОП может быть связана с несколькими причинами, такими как снижение высоты тел позвонков (боль возникает из-за компенсаторного увеличения поясничного лордоза) или множественные компрессионные переломы, которые вызывают механическое сдавление связочно-мышечного аппарата. Еще одной причиной хронической боли может быть выраженный грудной кифоз, следствием которого является увеличение давления на ребра и межпозвонковые суставные поверхности. БС не является специфичным для ОП симптомом, так как может возникать и при многих других заболеваниях, таких как первичное дегенеративное, инфекционное или воспалительное поражение позвоночника, злокачественные новообразования, а также при патологии внутренних органов.
Основной целью лечения ОП является нормализация процесса костного ремоделирования, что приводит к увеличению или стабилизации минеральной плотности кости (МПК), улучшению качества кости и снижению частоты возникновения новых переломов. Клинически это проявляется уменьшением болевого синдрома, но лишь при длительно продолжающемся лечении. В реальной клинической практике требуется более быстрое купирование боли. Наиболее часто с этой целью назначаются нестероидные противовоспалительные препараты (НПВП). Основной механизм действия НПВП – подавление синтеза простагландинов. Кроме того, под действием НПВП происходит угнетение синтеза лейкотриенов, уменьшение продукции супероксидных радикалов и выброса лизосомальных ферментов. НПВП влияют на активацию клеточных мембран, агрегацию и адгезию нейтрофилов. Все это обусловливает широкий спектр нежелательных явлений (НЯ), в первую очередь со стороны желудочно-кишечного тракта (ЖКТ). Для НПВП характерны нефро- и гепатотоксичность, они могут способствовать задержке жидкости в организме, развитию или усугублению недостаточности кровообращения, артериальной гипертензии, дистрофии миокарда. Прием НПВП нередко сопровождается появлением различных аллергических реакций, в том числе и бронхообструктивного синдрома («аспириновая» астма). Кроме того, возможны гематологические нарушения вплоть до тяжелых цитопений, гипо- и апластической анемии. С целью снижения количества НЯ были разработаны селективные НПВП, ингибирующие активность циклооксигеназы-2 (ЦОГ-2) – основного стимулятора синтеза медиаторов воспаления в местах тканевого повреждения [2]. Кроме того, поскольку ЦОГ-2 участвует в процессе активации остеокластов, селективные ингибиторы ЦОГ-2 предпочтительны для терапии боли и у пациентов с ОП или при наличии факторов риска его развития. Использование НПВП нередко затруднено у лиц, получающих патогенетическую терапию по поводу ОП, из-за различных НЯ, особенно со стороны ЖКТ. Именно поэтому для этого контингента больных необходимы альтернативные препараты, позволяющие быстро уменьшить интенсивность боли при минимальном риске возникновения НЯ. В настоящее время для купирования болевого синдрома широко используются миорелаксанты, одним из которых является толперизон, препарат центрального действия.
Известно, что хронизация боли связана с тем, что повторяющаяся болевая импульсация приводит к стойкому повышению возбудимости центральных ноцицептивных нейронов, увеличению эффективности синаптической передачи и закреплению данных изменений в ЦНС [3]. В ответ на это рефлекторно активизируются мотонейроны в соответствующих сегментах спинного мозга, вызывая спазм мышц, что приводит к локальной ишемии и появлению альгогенов (простагландины, брадикинин, серотонин и др.). Продолжительный выброс медиаторов воспаления приводит к повышению чувствительности периферических ноцицептивных рецепторов к различным стимулам. Интенсивность боли коррелирует с уровнем накопления медиаторов. При повреждениях позвоночника рефлекторные мышечно-тонические и миофасциальные синдромы сочетаются с изменениями в эмоциональной сфере, что способствует дальнейшей хронизации боли. Толперизон блокирует повышенную активность задних корешков спинного мозга, вызываемую стимуляцией ноцицептивных нервных волокон, благодаря чему ослабляется болезненный мышечный спазм [4]. Кроме того, толперизон ингибирует проведение возбуждения по ретикулоспинальному пути на уровне ствола мозга, поэтому механизм анальгезирующего действия препарата не связан с блокадой опиоидных рецепторов [5]. Толперизон оказывает мембраностабилизирующий эффект на мотонейроны и клетки спинномозговых ганглиев и периферические нервы [6]. Толперизон также блокирует центральные Н-холинорецепторы, что приводит к нарушению поступления ионов кальция в синапсы [7]. Данные механизмы обусловливают уменьшение боли и мышечного гипертонуса. Кроме того, толперизон усиливает периферическое кровообращение за счет блокады β1-адренорецепторов, что способствует снижению концентрации альгогенов и является дополнительным фактором устранения мышечного спазма и боли [8]. Толперизон характеризуется малым количеством и низкой частотой развития НЯ, к которым относятся преимущественно общие реакции (тошнота, чувство дискомфорта в животе, кожные аллергические симптомы, головная боль), а также мышечная слабость и артериальная гипотензия [9].
Целью нашего наблюдения была оценка эффективности и переносимости 10-дневного курса лечения толперизоном при хронической БС у больных ОП и сравнение его с таким же по длительности курсом лечения НПВП.
Материалы и методы исследования
В исследование включены 60 женщин с болью в спине и ОП в возрасте 50–85 лет (средний возраст 68 ± 7 лет), диагноз ОП подтвержден с помощью костного денситометра Discovery A (Hologic, США). Пациентки были рандомизированы на три группы: первая (n = 20) получала толперизон по 150 мг 3 раза в день (Мидокалм®, «Гедеон Рихтер»); вторая (n = 20) – НПВП (мелоксикам в дозе 15 мг 1 раз в день); третья группа (n = 20) – группа контроля (без симптоматического лечения).
Оценку эффективности проводили по следующим параметрам: динамика болевого синдрома по визуально-аналоговой шкале (ВАШ) в позвоночнике, необходимость принятия горизонтального положения (количество раз) и его продолжительность, оценка физической активности и ограничения подвижности по специальной анкете в баллах, опросникам состояния здоровья EQ-5D и Освестри (опросник для оценки функциональных нарушений при БС). Анализ указанных параметров проводили до начала наблюдения и через 10 дней терапии, кроме того, дважды – через 20 и 30 дней – проводился телефонный опрос. НЯ, количество принятого препарата, эффективность и переносимость лечения оценивались через 10 дней терапии, а выраженность болевого синдрома оценивали также в ходе телефонных опросов после прекращения использования исследуемых препаратов.
Статистическая обработка проводилась с использованием пакета прикладных программ Statistica 6,0 StatSoft. Анализ включал методы дескриптивной статистики и непараметрические методы сравнения. Количественные показатели в группах лечения и контроля сравнивались с применением критерия Манна – Уитни. Показатели качества жизни в динамике – при помощи парного критерия Вилкоксона (для двух временных точек) и критерия Фридмана (для трех и более временных точек).
Пациентки до начала терапии подписали информированное согласие на участие в клиническом наблюдении в НИИР РАМН.
Результаты и обсуждение
По основным характеристикам различий между пациентками, включенными в 3 группы, выявлено не было (табл. 1). У женщин, участвовавших в наблюдении, превалировали боли в поясничном отделе позвоночника по сравнению с таковыми в грудном отделе (85% и 56% соответственно), при этом боли в двух отделах беспокоили 53% обследованных.
Следует заметить, что патогенетическую терапию принимали 45%, в то время как кальций и витамин D3 принимали 63% пациенток, без какой-либо терапии по поводу ОП оставались 16% женщин.
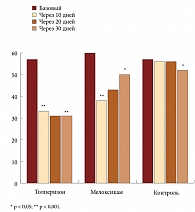
На фоне проводимой 10-дневной терапии отмечалось достоверное снижение интенсивности боли в спине по сравнению с исходным уровнем, как у больных, получавших толперизон (Мидокалм®), так и в группе пациенток, принимавших мелоксикам (p < 0,001). В контрольной группе через 10 дней болевой синдром уменьшился незначительно (p > 0,05).
Оценка боли через 20 и 30 дней после включения в исследование, когда пациентки в последующие 10 и 20 дней не получали симптоматического лечения, показала, что после прекращения приема толперизона интенсивность болевого синдрома не увеличивалась. У пациенток, получавших мелоксикам, после прекращения терапии НПВП интенсивность БС несколько увеличилась, но оставалась достоверно менее выраженной, чем в начале лечения (р < 0,05). Обращает на себя внимание, что и в группе контроля болевой синдром через 30 дней достоверно уменьшился (p < 0,05) по сравнению с исходным уровнем, но скорость уменьшения боли значимо отличалась от таковой в группах альтернативного лечения.
Пациентки в группах лечения реже были вынуждены принимать горизонтальное положение днем для уменьшения болевого синдрома. У женщин, получавших толперизон или мелоксикам, длительность принятия горизонтального положения (если возникала такая необходимость) достоверно снизилась уже через 10 дней терапии, и этот эффект сохранялся на протяжении последующих 20 дней наблюдения без лечения. При этом женщины контрольной группы для уменьшения боли в спине принимали горизонтальное положение с той же частотой и продолжительностью, что и до лечения, в течение всего периода наблюдения.
В ходе клинического наблюдения проводилась оценка ограничения подвижности и физической активности, которая показала, что у пациенток, лечившихся толперизоном, эти показатели значимо улучшились (положительная динамика отмечалась у 60% и 40% пациенток соответственно). Аналогичные изменения этих показателей получены и в группе лиц, получавших мелоксикам, в то время как в контрольной группе они изменились только у 15% и 5% анкетированных.
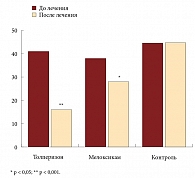
Изучение качества жизни пациентов с помощью опросника Освестри (рис. 2) показало, что максимальное снижение как интенсивности боли в спине, так и ограничений в выполнении повседневной деятельности через 10 дней приема препарата отмечалось у лиц, получавших толперизон (p < 0,001) и мелоксикам (p < 0,05).
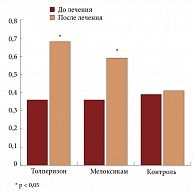
В то же время в контрольной группе положительной динамики не было выявлено по всем 10 доменам опроса. Улучшение индекса здоровья (по опроснику EQ-5D) в группах сравнения было сходным (p < 0,05). В группе контроля изменений индекса здоровья по данному опроснику не наблюдалось (рис. 3).
Переносимость препарата Мидокалм® была хорошей – НЯ зафиксированы не были. Отмены препарата не было ни у одного из участников наблюдения. Необходимо отметить хорошую приверженность лечению – пропусков в приеме препарата не было. У пациенток, принимавших мелоксикам, были зарегистрированы следующие НЯ: подъем АД – у 1 (5%), головная боль – у 1 (5%), зуд век – у 1 (5%), тошнота – у 1 (5%) пациентки. В этой группе у двух человек (10%) потребовалась отмена препарата.
В конце 10-дневного курса терапии толперизоном 10 (50%) пациентов оценили эффективность препарата как отличную или хорошую, 7 (35%) – как удовлетворительную, и только 3 (15%) человека отметили отсутствие эффекта лечения. Оценка эффективности препарата врачом показала аналогичные результаты, кроме одного случая, когда пациентка при самооценке лечения отметила пункт «отсутствие эффекта», при этом по всем использованным опросникам было выявлено улучшение ее состояния. Оценка эффективности лечения мелоксикамом пациентами и врачом совпадала. Врач отметил хорошую или отличную эффективность препарата у 15 (75%), удовлетворительную – у 3 (15%), а отсутствие эффекта – у 2 (10%) пациентов, у которых препарат был отменен на 3–4-й день терапии, что не позволило достичь его максимальной концентрации, а следовательно, получить и сохранить желательный эффект.
Заключение
В реальной клинической практике врач часто сталкивается с проблемой боли в спине и нарушения функциональной активности у больных ОП, что приводит как к снижению качества их жизни, так и к ограничению способности вести независимый образ жизни. В этой связи купирование или хотя бы уменьшение выраженности болевого синдрома является одной из основных задач лечения пациентов с БС. С этой целью может с успехом применяться толперизон, который обладает несколькими механизмами воздействия на болевой синдром и практически лишен побочных эффектов, что продемонстрировали результаты нашего клинического наблюдения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.