количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Микронизированный прогестерон: опыт применения препарата врачами-гинекологами из Индии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и Гинекология" №5
- Аннотация
- Статья
- Ссылки
В исследовании приняли участие женщины с недостаточностью лютеиновой фазы, проходящие лечение с помощью вспомогательных репродуктивных технологий (n = 220), и пациентки с угрожающим абортом (n = 55). Были опрошены лечащие врачи пациенток, которые оценивали эффективность и переносимость препарата в различных его формах (пероральной, парентеральной, вагинальной).
Установлено, что эффективность назначения микронизированного прогестерона у женщин с угрожающим абортом достигает 75–87%. Препарат хорошо переносился, побочные явления были незначительными и не требовали его отмены.
Исследовательским агентством «Клиникал Медисин Информатикс» (Clinical Medicine Infomatics, Индия) было проведено исследование эффективности микронизированного прогестерона (препарат Сустен) производства «Сан Фармасьютикал Индастриз Лтд» (Sun Pharmaceutical Industries Ltd), зарегистрированного в России под торговым названием Праджисан.
В исследовании приняли участие женщины с недостаточностью лютеиновой фазы, проходящие лечение с помощью вспомогательных репродуктивных технологий (n = 220), и пациентки с угрожающим абортом (n = 55). Были опрошены лечащие врачи пациенток, которые оценивали эффективность и переносимость препарата в различных его формах (пероральной, парентеральной, вагинальной).
Установлено, что эффективность назначения микронизированного прогестерона у женщин с угрожающим абортом достигает 75–87%. Препарат хорошо переносился, побочные явления были незначительными и не требовали его отмены.
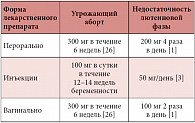
Таблица 1. Схемы применения микронизированного прогестерона
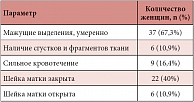
Таблица 2. Результаты гинекологического осмотра
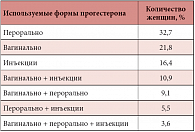
Таблица 3. Формы прогестерона, которые были использованы во время исследования
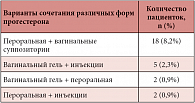
Таблица 4. Применение микронизированного прогестерона в различных сочетаниях у пациенток с бесплодием, обусловленным недостаточностью лютеиновой фазы
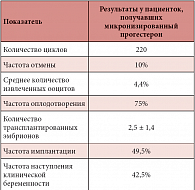
Таблица 5. Эффективность ЭКО у женщин с бесплодием, обусловленным недостаточностью лютеиновой фазы
Введение
Натуральный микронизированный прогестерон считается безопасной и эффективной альтернативой синтетическим и натуральным аналогам прогестерона. Микронизированный прогестерон – это простой, хорошо переносимый и удобный в использовании препарат, который может быть рекомендован в качестве предпочтительного метода для поддержания лютеиновой фазы, особенно пациенткам с повышенным риском развития синдрома гиперстимуляции яичников [1].
Следует отметить, что пероральное и вагинальное применение натурального микронизированного прогестерона сравнимо по эффективности [2]. В клинических исследованиях было доказано, что микронизированный прогестерон при вагинальном применении хорошо переносится и, по сравнению с внутримышечным введением, более эффективно улучшает имплантацию яйцеклетки и снижает частоту самопроизвольных абортов во время стимулированных циклов экстракорпорального оплодотворения (ЭКО), в том числе с применением агонистов гонадотропин-рилизинг-гормона (ГнРГ) [3] (табл. 1).
Терапевтическое использование микронизированного прогестерона
Недостаточность лютеиновой фазы
В ряде исследований было показано, что применение препаратов прогестерона в случае недостаточности лютеиновой фазы, в том числе в первом триместре беременности, благоприятно влияет на фертильность, помогает предотвратить выкидыш и предупредить преждевременные роды. Кроме того, терапия прогестероном повышает эффективность ЭКО, при котором используются агонисты ГнРГ [4]. Наиболее эффективным и безопасным считается вагинальное введение препарата [5].
Сопутствующая терапия при использовании вспомогательных репродуктивных технологий
В исследовании C.P. Montville и соавт. клиническая беременность была зарегистрирована у 15,3% женщин с синдромом поликистозных яичников (СПКЯ), получавших кломифен в сочетании с прогестероном, по сравнению с 12,1% пациенток, принимавших кломифен в виде монотерапии. У женщин, получавших ингибитор ароматазы летрозол, клиническая беременность при дополнительном назначении прогестерона наступила в 21,1% случаев; у пациенток, не применявших прогестерон, случаев наступления беременности зарегистрировано не было [6]. В работе P. Mui Lam было показано, что вагинальное введение препаратов прогестерона на ранней лютеиновой фазе может улучшить результаты ЭКО у женщин с миомой матки или при проблемах, связанных с извлечением яйцеклеток [7].
Последовательное применение препаратов эстрадиола и прогестерона часто используется для подготовки эндометрия в циклах переноса криоконсервированных эмбрионов (FET). V.T. Lan и соавт. провели исследование на женщинах азиатского происхождения (в возрасте не старше 45 лет), которые получали прогестерон в виде геля 90 мг 1 р/сут (n = 100) или таблеток по 200 мг 3 р/сут (n = 100) для вагинального применения. Все пациентки принимали препарат эстрадиола начиная со 2-го дня менструального цикла в течение не менее 10 дней (или пока толщина эндометрия не достигала 8 мм и более), после чего использовали препарат прогестерона в течение 2 дней перед FET и затем, в случае наступления беременности, в течение последующих 14 недель. Частота наступления клинической беременности (31% для геля и 28% для таблеток) и частота имплантации (9,8% и 8,8% соответственно) не имели существенных различий между группами. Пациентки предпочитали гель вагинальным таблеткам в связи с простотой и удобством использования. Таким образом, можно сказать, что прогестерон в виде геля не уступает по эффективности вагинальным таблеткам и превосходит по удобству применения [8].
Женщины с СПКЯ часто имеют пониженную чувствительность к инсулину и высокие уровни андрогенов. Это надо учитывать при проведении вспомогательных репродуктивных технологий. После перорального приема натурального микронизированного прогестерона увеличивается концентрация прогестерона и 17-альфа-гидропрогестерона в крови и снижается уровень HOMA-IR (мера резистентности к инсулину), в то время как уровни андрогенов по сравнению с исходными остаются неизменными [9].
Угрожающий аборт
Было показано, что у пациенток с СПКЯ и угрозой самопроизвольного выкидыша, получающих летрозол для стимуляции овуляции, дополнительное назначение препаратов прогестерона повышает частоту наступления беременности [6]. Терапия микронизированным прогестероном была эффективной для предотвращения спонтанных абортов у пациенток с субхорионическим кровоизлиянием [10]. Было показано, что прием прогестерона в дозе 400 мг в день в течение 14–21 дня эффективен у женщин с высоким риском выкидыша. Микронизированный прогестерон снижает риск повторных спонтанных абортов за счет изменения состояния клеточного и гуморального иммунитета [11].
Преждевременные роды и родоразрешение
Профилактическое вагинальное применение препаратов прогестерона снижает частоту преждевременных родов и родоразрешения у пациенток с осложненной беременностью [12].
Заместительная гормональная терапия в перименопаузе
Прогестагены, в частности синтетические прогестины, широко используются для предупреждения клинических проявлений гиперэстрогении в пременопаузе. Микронизированный прогестерон является эффективным и безопасным методом лечения при дисфункциональных маточных кровотечениях в пременопаузе. Микронизированный прогестерон не повышает риск развития заболеваний молочной железы [13], тромбоэмболии [14] и не нарушает моторику толстой кишки у женщин в постменопаузе [15]. Сочетанное применение трансдермальной формы эстрадиола и микронизированного прогестерона характеризуется эффективностью и относительной безопасностью и, вероятно, является в настоящее время лучшим выбором заместительной гормональной терапии для большинства женщин в постменопаузе [16].
Эффективность различных форм микронизированного прогестерона
Микронизированный прогестерон можно вводить перорально, парентерально и вагинально. Пероральный микронизированный прогестерон удобен в применении, имеет лучшую биодоступность и меньше побочных эффектов, чем натуральный прогестерон [17]. Микронизированный прогестерон для инъекций быстро всасывается и в пределах 2–8 часов достигает диагностически значимого уровня в сыворотке крови. Уровень действующего вещества ниже в сыворотке и выше в ткани эндометрия при использовании прогестерона в виде вагинального геля, по сравнению с внутримышечным введением препарата. Было показано, что микронизированный прогестерон 200 мг/сут вагинально более эффективен для поддержания лютеиновой фазы при лечении по протоколам вспомогательных репродуктивных технологий [18]. В исследовании S.T. Ceyhan и соавт. пациентки с нормальным ответом яичников на стимуляцию в цикле ЭКО, получавшие рекомбинантный фолликулостимулирующий гормон и многократные инъекции антагониста ГнРГ в фиксированной дозе, были рандомизированы на две группы:
- микронизированный прогестерон вагинально (600 мг/сут) для поддержания лютеиновой фазы + трансдермальный эстроген (100 мкг/сут);
- микронизированный прогестерон вагинально (600 мг/сут).
- Частота наступления и развития беременности была сходной в группах, получавших и не получавших эстроген (50,0% по сравнению с 55,2%; 36,6% по сравнению с 34,4% соответственно) [19].
Сравнение вагинального микронизированного прогестерона и перорального дидрогестерона
У пациенток с преждевременным угасанием функции яичников вагинальное применение микронизированного прогестерона более эффективно, чем пероральное применение дидрогестерона. Это связано с тем, что микронизированный прогестерон эффективнее обеспечивает соответствие состояния эндометрия стадии фазы секреции и индуцирует значительно более высокие концентрации прогестерона и более низкие концентрации лютеинизирующего гормона и фолликулостимулирующего гормона в сыворотке на 21-й день менструального цикла [20]. Развитие желез эндометрия соответствовало ранней фазе секреции в пяти из шести случаев, когда пациентка дополнительно получала дидрогестерон (несовпадение по фазе). И наоборот, у пяти из шести пациенток, получавших микронизированный прогестерон, эндометрий соответствовал средней лютеиновой фазе (совпадение по фазе) (p = 0,021 в сравнении с дидрогестероном). На 21-й день менструального цикла между группами прогестерона и дидрогестерона наблюдались достоверные различия в средних уровнях прогестерона (8,6 и 0,3 мкг/л, p = 0,013), лютеинизирующего гормона (12,9 и 22,5 МЕ/л, p = 0,049) и фолликулостимулирующего гормона (13,0 и 23,9 МЕ/л, p = 0,047) [21].
В исследовании R. Choavaratana и соавт. уровень прогестерона в сыворотке, достигаемый при пероральном введении (5,06 ± 2,95 нг/мл), значительно отличался (р < 0,001) от уровней, достигаемых при вагинальном введении (8,26 ± 4,09 нг/мл). В случаях, когда содержание эстрогена в сыворотке было меньше 30 пг/мл, сывороточные уровни прогестерона у пациенток, принимающих его перорально (4,23 ± 2,68 нг/мл), существенно не отличались (р = 0,925) от таковых у пациенток, получавших его вагинально (4,15 ± 3,40 нг/мл). Если уровень эстрогена в сыворотке крови составлял не менее 30 пг/мл, наблюдалась достоверная разница (p < 0,005) в уровне прогестерона между этими двумя группами (6,32 ± 2,99 нг/мл при пероральном и 9,76 ± 3,23 нг/мл при вагинальном применении) [22].
Сравнение прогестерона в форме свечей и геля
Согласно наблюдениям E.J. Blake и соавт., микронизированный прогестерон в виде вагинальных таблеток, по сравнению с прогестероном в виде вагинального геля, способствует более быстрому увеличению сывороточной концентрации прогестерона, достижению более высоких пиковых концентраций (Cmax) и выводится быстрее [23]. Так, в течение одного дня применения средняя Cmax составила 17,0 ± 2,7 нг/мл при использовании вагинальных таблеток 2 р/сут, 19,8 ± 2,9 нг/мл – при использовании их 3 р/сут и 6,82 ± 1,69 нг/мл при применении геля. Применение вагинальных таблеток позволяет достичь устойчивой концентрации прогестерона в сыворотке в течение 2 дней (24–36 часов) применения, в то время как гель – не ранее, чем через 5 дней. Через 5 дней применения вагинальных таблеток устойчивая концентрация сывороточного прогестерона, превышающая 10 мг/мл, сохраняется в течение 24 часов. При использовании вагинальных таблеток обеспечивается более активное системное воздействие (площадь под кривой 0–24), устойчивая концентрация прогестерона в сыворотке достигается более быстрыми темпами, а кроме того, после прекращения терапии препарат выводится из организма быстрее.
Материалы и методы
Постмаркетинговые обсервационные исследования проводились с целью изучения эффективности микронизированного прогестерона производства «Сан Фармасьютикал Индастриз Лтд». В исследовании приняли участие женщины с недостаточностью лютеиновой фазы, проходящие лечение с помощью вспомогательных репродуктивных технологий (n = 220), и пациентки с угрожающим абортом (n = 55). Были опрошены лечащие врачи пациенток – гинекологи, практикующие в 3 крупнейших городах Индии (Мумбаи, Силвасса и Вапи), – которые оценивали эффективность и переносимость препарата в различных его формах (пероральной, парентеральной, вагинальной). Эффективность лечения оценивалась на основании историй болезни и беседы с доктором.
Исследование эффективности микронизированного прогестерона у женщин с угрожающим абортом
Вагинальное кровотечение при сроке беременности до 20 недель – это самое распространенное осложнение беременности (20%). На фоне вагинального кровотечения в 2,6 раза чаще происходит самопроизвольный аборт, в 17% случаев осложнения могут проявиться на поздних сроках беременности. К группе риска самопроизвольных абортов относятся женщины старше 34 лет. Так, результаты проспективного исследования показали, что отношение шансов для риска самопроизвольного аборта у женщин, входящих в эту возрастную группу, составляет 2,3. Кроме того, наличие выкидыша в анамнезе также повышает риск самопроизвольных абортов при последующей беременности, особенно у женщин старше 34 лет. Лечение пациенток с угрозой выкидыша в основном является эмпирическим. Обычно рекомендуется постельный режим, и примерно одной трети женщин с угрожающим самопроизвольным абортом назначают препараты, такие как микронизированный прогестерон [24].
В исследование были включены 55 женщин в возрасте от 21 года до 34 лет с диагнозом «угрожающий аборт». Срок гестации варьировал от < 8 недель (n = 16, 29%) до > 16 недель (n = 39, 71%). Женщины предъявляли жалобы на боли в животе (49,1%), у 87,3% женщин наблюдалось маточное кровотечение или кровянистые выделения. Субхорионическое кровоизлияние было выявлено у 18,1% пациенток. 25,4% женщин ранее перенесли аборты. Две женщины страдали артериальной гипертонией. Одна женщина была заражена TORCH-инфекцией. У одной из женщин выявлено несоответствие размеров таза матери размерам головки плода. У всех пациенток определяли уровень гемоглобина и гематокрита в крови. Кроме того, у 10 пациенток (18,1%) оценивался уровень бета-хорионического гонадотропина человека (ХГЧ). Результаты гинекологического осмотра пациенток приведены в таблице 2. Всем пациенткам был предписан постельный режим, а также назначен микронизированный прогестерон (табл. 3). Продолжительность лечения формами микронизированного прогестерона зависела от ответной клинической реакции пациентки.
Перорально препарат принимался в дозе 200 мкг два раза в день, вагинально – до 100 мкг в день. Внутримышечные инъекции вводились по 50 мг два раза в день в течение 3–5 дней. Опрашиваемые врачи-гинекологи сообщили, что пациентки более охотно применяли препарат во влагалищных суппозиториях, однако эффективность лечения была выше при использовании геля, так как он лучше всасывается со слизистой оболочки влагалища. Кроме того, пациенткам рекомендовался прием фолиевой кислоты (20%), препаратов кальция и железа (9,1%), инъекции человеческого хорионического гонадотропина (5,5%) или прием гомеопатических аналогов хорионического гонадотропина (9,1%). Проведенная терапия была эффективной у 87,3% женщин, которые сохранили беременность. В 12,7% случаев произошел самопроизвольный выкидыш. Наиболее частыми побочными эффектами лечения являлись боли в мышцах (25,5%), утомляемость (23,6%), тошнота (16,4%) и спастические боли в животе (14,6%).
Исследование эффективности микронизированного прогестерона у женщин с бесплодием, обусловленным недостаточностью лютеиновой фазы
Лютеиновые фазы всех стимулированных циклов экстракорпорального оплодотворения являются атипичными. Основная причина недостаточности лютеиновой фазы, наблюдаемой в стимулированных циклах ЭКО, связана с развитием множественной овуляции во время стимуляции яичников. Это может быть обусловлено супрафизиологической концентрацией стероидов, выделяемых большим количеством желтых тел в начале лютеиновой фазы. Они подавляют эндогенную секрецию лютеинизирующего гормона посредством отрицательной обратной связи на гипоталамо-гипофизарно-надпочечниковую ось [20]. Показаниями к лечению микронизированным прогестероном, помимо ЭКО (в том числе с применением методики интрацитоплазматической инъекции сперматозоида), являются искусственная (внутриматочная) инсеминация, а также необходимость поддержания беременности после естественного зачатия. При контролируемой гиперстимуляции яичников в цикле ЭКО с переносом эмбрионов большинство врачей назначают препараты прогестерона во время лютеиновой фазы. Некоторые делают это из-за убеждения, что использование агонистов или антагонистов ГнРГ с целью предотвращения преждевременного пика лютеинизирующего гормона может оказать неблагоприятное воздействие на функцию желтого тела. Другие считают, что негативное влияние на функцию желтого тела связано с высокими уровнями в сыворотке крови эстрадиола и прогестерона, которые секретируются сразу несколькими созревающими фолликулами.
В исследовании эффективности микронизированного прогестерона у женщин с бесплодием, обусловленным недостаточностью лютеиновой фазы, приняли участие 220 пациенток. 25,9% женщин в прошлом перенесли аборты. Нарушения менструального цикла были выявлены у 20,5% женщин. У 23,6% женщин диагностировано первичное бесплодие, у 10,5% – вторичное. Для стимуляции овуляции были использованы различные препараты и методы. 30,9% женщинам с бесплодием назначался кломифен, агонисты ГнРГ (длинный или короткий протокол) использовались в 29,1% случаев. У 17,7% пациенток с бесплодием неясного происхождения для стимуляции яичников во время циклов вспомогательных репродуктивных технологий использовали ингибитор ароматазы летрозол (принятый в качестве альтернативы кломифену). Цетрореликс, антагонист ГнРГ, использовался реже – в 4,1% случаев.
В исследовании оценивалось использование трех различных форм микронизированного прогестерона, а именно пероральной (21,4%), парентеральной (38,6%) и гелевой (для вагинального применения) (23,6%). Комбинированная терапия двумя лекарственными формами применялась у 16,4% пациенток (табл. 4). Прием пероральной формы микронизированного прогестерона в большинстве случаев продолжался 14 дней до получения положительного теста мочи на беременность и далее в течение 3–4 месяцев. Первичный курс внутримышечных инъекций составлял 17 дней (вплоть до получения положительного теста мочи на беременность); затем инъекции продолжали в течение 3 месяцев. Вагинальный гель применяли в течение 15 дней (n = 6), у одной пациентки курс был продлен до 30 дней.
Помимо микронизированного прогестерона пациенткам также назначались аспирин (65,5%), фолиевая кислота (43,2%), эстрадиол (42,7%), тироксин (у женщин с гипотиреозом) (11,4%), бромокриптин при высоком уровне пролактина (2,3%). Что касается использования у пациенток вспомогательных репродуктивных технологий, то чаще всего применялось ЭКО (93,2%), на долю внутриматочной инсеминации пришлось 3,6%, на запланированную связь – 3,2%. Имплантация яйцеклетки подтверждалась посредством теста на бета-ХГЧ, клиническая беременность – наличием сердцебиения плода, выявляемого во время УЗИ на 8-й неделе. Результаты ЭКО представлены в таблице 5. У 7 из 9 женщин, которым провели внутриматочную инсеминацию, было выявлено сердцебиение плода на сроке 6 недель. У 2 из 3 женщин, имевших запланированную связь после лечения, во время УЗИ обнаружено сердцебиение плода на сроке 6 недель. Столь высокая эффективность обоих методов может быть обусловлена нормальным гинекологическим профилем женщин, бесплодие которых могло быть вызвано стрессом.
Из наиболее частых побочных эффектов терапии женщины отмечали тошноту (36,8%) и сонливость (31,8%). Причиной сонливости, связанной с использованием прогестерона, по-видимому, является его стимулирующее влияние на рецепторы гамма-аминомасляной кислоты в головном мозге. Данное побочное действие не было связано с нарушениями когнитивных функций в дневное время [25]. Другие побочные эффекты были незначительными и не требовали прекращения терапии (головная боль – 26,8%, боль в животе –18,6%, раздражительность – 17,3%). Кроме того, важно учитывать тот факт, что пациентки помимо микронизированного прогестерона принимали ряд других препаратов. Таким образом, не всегда возможно установить, какое из лекарственных средств послужило причиной развития нежелательных явлений.
Заключение
В исследовании эффективности применения микронизированного прогестерона у женщин с угрожающим абортом было продемонстрировано, что данный препарат (в большинстве случаев его пероральная форма) является наиболее часто назначаемым лекарственным средством. Эффективность лечения достигает 75–87%. Среди побочных эффектов пациентками были отмечены боль в мышцах и повышенная утомляемость.
Исследование эффективности микронизированного прогестерона у женщин с бесплодием, обусловленным недостаточностью лютеиновой фазы, показало, что микронизированный прогестерон является наиболее часто назначаемым лекарственным средством у женщин, проходящим лечение с использованием вспомогательных репродуктивных технологий. Формой выбора в таких случаях являются инъекции микронизированного прогестерона. Препарат хорошо переносится, среди побочных эффектов выделяют тошноту и сонливость.
1. Friedler S., Raziel A., Schachter M. et al. Luteal support with micronized progesterone following in-vitro fertilization using a down-regulation protocol with gonadotrophin-releasing hormone agonist: a comparative study between vaginal and oral administration // Hum. Reprod. 1999. Vol. 14. № 8. P. 1944–1948.
2. Marinov B., Petkova S., Dukovski A. et al. Utrogestan and high risk pregnancy // Akush. Ginekol. (Sofiia). 2004. Vol. 43. № 5. P. 22–24.
3. Smitz J., Devroey P., Faguer B. et al. A prospective randomized comparison of intramuscular or intravaginal natural progesterone as a luteal phase and early pregnancy supplement // Hum. Reprod. 1992. Vol. 7. № 2. P. 168–175.
4. Geber S., Moreira A.C., de Paula S.O., Sampaio M. Comparison between two forms of vaginally administered progesterone for luteal phase support in assisted reproduction cycles // Reprod. Biomed. Online. 2007. Vol. 14. № 2. P. 155–158.
5. Check J.H. Luteal Phase Support in assisted reproductive technology treatment: focus on Endometrin(R) (progesterone) vaginal insert // Ther. Clin. Risk Manag. 2009. Vol. 5. № 4. P. 403–407.
6. Montville C.P., Khabbaz M., Aubuchon M. et al. Luteal support with intravaginal progesterone increases clinical pregnancy rates in women with polycystic ovary syndrome using letrozole for ovulation induction // Fertil. Steril. 2010. Vol. 94. № 2. P. 678–683.
7. Mui Lam P., Chun Cheung M., Ping Cheung L. et al. Effects of early luteal-phase vaginal progesterone supplementation on the outcome of in vitro fertilization and embryo transfer // Gynecol. Endocrinol. 2008. Vol. 24. № 12. P. 674–680.
8. Lan V.T., Tuan P.H., Canh L.T. et al. Progesterone supplementation during cryopreserved embryo transfer cycles: efficacy and convenience of two vaginal formulations // Reprod. Biomed. Online. 2008. Vol. 17. № 3. P. 318–323.
9. Livadas S., Boutzios G., Economou F. et al. The effect of oral micronized progesterone on hormonal and metabolic parameters in anovulatory patients with polycystic ovary syndrome // Fertil. Steril. 2009. Vol. 2010. Vol. 94. № 1. P. 242–246.
10. Pelinescu-Onciul D. Subchorionic hemorrhage treatment with dydrogesterone // Gynecol. Endocrinol. 2007. Vol. 23. Suppl. 1. P. 77–81.
11. Karag'ozova Zh., Chernev T., Atanasova D. et al. Hormonal treatment of recurrent spontaneous abortions // Akush. Ginekol. (Sofiia). 2007. Vol. 46. № 3. P. 3–7.
12. Cetingoz E., Cam C., Sakallı M. et al. Progesterone effects on preterm birth in high-risk pregnancies: a randomized placebo-controlled trial // Arch. Gynecol. Obstet. 2011. Vol. 283. № 3. P. 423–429.
13. Campagnoli C., Ambroggio S., Lotano M.R., Peris C. et al. Progestogen use in women approaching the menopause and breast cancer risk // Maturitas. 2009. Vol. 62. № 4. P. 338–342.
14. Canonico M., Oger E., Plu-Bureau G. et al. Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study // Circulation. 2007. Vol. 115. № 7. P. 840–845.
15. Gonenne J., Esfandyari T., Camilleri M. et al. Effect of female sex hormone supplementation and withdrawal on gastrointestinal and colonic transit in postmenopausal women // Neurogastroenterol. Motil. 2006. Vol. 18. № 10. P. 911–318.
16. Caufriez A. Hormonal replacement therapy (HRT) in postmenopause: a reappraisal // Ann. Endocrinol. (Paris). 2007. Vol. 68. № 4. P. 241–250.
17. Goletiani N.V., Keith D.R., Gorsky S.J. Progesterone: review of safety for clinical studies // Exp. Clin. Psychopharmacol. 2007. Vol. 15. № 5. P. 427–444.
18. Wang C.W., Horng S.G., Chen C.K. et al. Ovulation induction with tamoxifen and alternate-day gonadotrophin in patients with thin endometrium // Reprod. Biomed. Online. 2008. Vol. 17. № 1. P. 20–26.
19. Ceyhan S.T., Basaran M., Kemal Duru N. et al. Use of luteal estrogen supplementation in normal responder patients treated with fixed multidose GnRH antagonist: a prospective randomized controlled study // Fertil. Steril. 2008. Vol. 89. № 6. P. 1827–1830.
20. Fatemi H.M. The luteal phase after 3 decades of IVF: what do we know? // Reprod. Biomed. Online. 2009. Vol. 19. Suppl. 4. P. 4331.
21. Fatemi H.M., Bourgain C., Donoso P. et al. Effect of oral administration of dydrogestrone versus vaginal administration of natural micronized progesterone on the secretory transformation of endometrium and luteal endocrine profile in patients with premature ovarian failure: a proof of concept // Hum. Reprod. 2007. Vol. 22. № 5. P. 1260–1263.
22. Choavaratana R., Manoch D. Efficacy of oral micronized progesterone when applied via vaginal route // J. Med. Assoc. Thai. 2004. Vol. 87. № 5. P. 455–458.
23. Blake E.J., Norris P.M., Dorfman S.F. et al. Single and multidose pharmacokinetic study of a vaginal micronized progesterone insert (Endometrin) compared with vaginal gel in healthy reproductive-aged female subjects // Fertil Steril. 2010. Vol. 94. № 4. P. 1296–1301.
24. Sotiriadis A., Papatheodorou S., Makrydimas G. Threatened miscarriage: evaluation and management // BMJ. 2004. Vol. 329. № 7458. P. 152–155.
25. Schüssler P., Kluge M., Yassouridis A. et al. Progesterone reduces wakefulness in sleep EEG and has no effect on cognition in healthy postmenopausal women // Psychoneuroendocrinology. 2008. Vol. 33. № 8. P. 1124–1131.
26. Czajkowski K., Sienko J., Mogilinski M. et al. Uteroplacental circulation in early pregnancy complicated by threatened abortion supplemented with vaginal micronized progesterone or oral dydrogesterone // Fertil. Steril. 2007. Vol. 87. № 3. P. 613–618.
Новости на тему
07.10.2022
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.