Мобилизация и сбор периферических гематопоэтических стволовых клеток у детей: роль гранулоцитарного колониестимулирующего фактора
- Аннотация
- Статья
- Ссылки
Общая выживаемость среди педиатрических онкологических больных, едва достигавшая уровня 15–20% в начале 1970-х, к середине 1990-х гг. превысила 70-процентный рубеж, а в настоящее время колеблется в пределах 75–80% [1]. Но если использование ХТ в стандартных дозах привело к значительному улучшению результатов лечения в детской онкологии в целом, то у больных с метастатическими опухолями и неходжкинскими лимфомами прогноз заболевания оставался весьма пессимистическим до начала 1980-х гг. Тогда использование интенсивных комбинированных режимов химиотерапии в дозах, превышавших стандартные на порядок, произвело революцию в лечении лимфомы Беркитта и беркиттоподобных лимфом. Показатели безрецидивной выживаемости выросли с 15 до 92% [2]. Что касается больных с IV стадией нейробластомы, саркомы Юинга, рабдомиосаркомы и больных с рецидивными или резистентными опухолями, высокодозная химиотерапия (ВХТ) не способствовала улучшению отдаленного прогноза. Теоретической базой для дальнейшей интенсификации ХТ в этой группе больных послужили работы E. Frei и соавт. (1979), которые установили существование феномена «доза – эффект» в опытах in vitro на культурах опухолевых клеток человека [3]. Клиническое значение феномена «доза – эффект», как для монорежимов ВХТ, так и для комбинации препаратов, было показано в исследованиях II фазы. Результаты исследований явно свидетельствовали в пользу применения высоких доз препаратов, в первую очередь алкилирующих агентов, для достижения ремиссии у больных с опухолями из групп высокого риска. Однако, несмотря на высокий процент положительных ответов, длительная выживаемость оставалась крайне низкой при высокой токсичности терапии. Именно токсичность, а конкретно способность режимов ВХТ вызывать длительную, порой необратимую аплазию костного мозга, являлась преградой на пути дальнейшей эскалации доз и интенсификации лечения. Инструментом, позволившим преодолеть это препятствие и интенсифицировать ХТ в несколько раз, стала аутотрансплантация гематопоэтических стволовых клеток (ГСК). Первые исследования II фазы применения мелфалана с последующей трансплантацией ГСК у больных с нейробластомой и саркомой Юинга (1970–80-е гг.) дали обнадеживающие результаты. В дальнейшем исследовании II фазы были получены 55 и 81% положительных ответов у больных с нейробластомой IV стадии и рефрактерной к обычной ХТ саркомой Юинга соответственно [4].
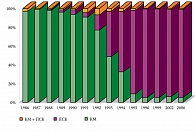
В 1970-е единственным, а в 1980-е гг. основным источником аутологичных ГСК являлся костный мозг (КМ) больного. Однако постепенно ситуация стала меняться, и к началу 1990-х гг. специалисты все большего числа центров трансплантации стали отдавать предпочтение клеткам, получаемым из стволовых клеток периферической крови (ПСК) (рис. 1) [5]. Периферическая кровь как источник стволовых клеток имеет ряд преимуществ перед костным мозгом. Во-первых, забор ПСК осуществляется без проведения общей анестезии, вне оперблока. Во-вторых, методика забора ПСК применима для больных, у которых в силу тех или иных причин эксфузия костного мозга невыполнима (опухоли таза, облучение таза). В-третьих, забор ПСК можно повторять многократно, после каждого курса стандартной ХТ, и получать практически неограниченное количество ГСК, позволяющее осуществить несколько последовательных курсов ВХТ с последующей аутотрансплантацией. В-четвертых, применение ПСК для аутотрансплантации позволяет достоверно ускорить восстановление гемопоэза по сравнению с использованием костного мозга, уменьшить риск инфекционных осложнений и сократить срок пребывания больного в стационаре. В-пятых, в большинстве случаев контаминация материала опухолевыми клетками ниже при использовании ПСК [6].
Предположение, что клетки, сохраняющие способность к самообновлению, дифференцировке и делению, циркулируют в периферической крови в составе фракции лимфоцитов, было впервые высказано русским ученым А.А. Максимовым в 1909 г. на лекции в Берлине [7]. В 1962 г. J. Goodman и G. Hodson впервые ввели термин «стволовые клетки периферической крови». В это же время в опытах in vitro и экспериментально на животных было показано, что в крови циркулируют как истинные стволовые, так и полипотентные клетки, способные восстанавливать гемопоэз у летально облученных животных [8].
Содержание СК в крови у здоровых индивидов в норме чрезвычайно низкое и составляет приблизительно 0,1 клетки на 1 мкл, тогда как в костном мозге содержание стволовых клеток в 100 раз выше [9]. В подобных обстоятельствах периферическая кровь не может служить адекватным источником стволовых клеток. При некоторых физиологических и патологических состояниях количество циркулирующих СК резко увеличивается. Впервые в 1976 г. С. Richman и соавт. отметили: фаза выхода из цитопении, индуцированной циклофосфаном, сопровождается 10–50-кратным увеличением количества циркулирующих СК [10]. Однако далеко не всегда фаза выхода после ХТ протекает «безоблачно». Часто она сопровождается инфекционным синдромом, что в свою очередь замедляет восстановление гемопоэза и ухудшает качество сбора ПСК. При этом даже повышение уровня циркулирующих в крови ГСК в 10–30 раз (в самых благоприятных случаях) может быть недостаточным для получения адекватного материала.
С появлением колониестимулирующих факторов (КСФ) методика мобилизации видоизменяется. Публикуются работы, в которых мобилизация при помощи КСФ самостоятельно или последовательно с ХТ позволяет добиться увеличения количества циркулирующих СК до 370 раз (!) от исходного уровня и достоверно улучшить качество собираемого материала [9, 11]. К середине 1990-х гг. назначение КСФ становится обязательной процедурой перед проведением лейкафереза (ЛФ).
Среди довольно широкой гаммы цитокинов, представленной на фармацевтическом рынке, в мобилизационных режимах применяются в основном гранулоцитарные колониестимулирующие факторы. В настоящее время в России зарегистрированы два оригинальных препарата Г-КСФ: Граноцит® компании «Шугаи Санофи-Авентис» (производство «Санофи Винтроп Индустрия», Франция); Нейпоген® компании «Ф. Хоффманн – Ля Рош». Отметим: Нейпоген® является рекомбинантным негликозилированным человеческим (рч) Г-КСФ (филграстим), а Граноцит® представляет собой рекомбинантный гликозилированный человеческий Г-КСФ (ленограстим).
Очистка и молекулярное клонирование Г-КСФ были проведены в середине 1980-х гг., а первый рекомбинантный негликозилированный человеческий Г-КСФ – филграстим – был разрешен в США в 1991 г. для клинического применения у онкологических больных, получивших химиотерапию. Филграстим вырабатывается E. coli, состоит из 173 аминокислот, в отличие от природной молекулы Г-КСФ, которая подвергается О-гликозилированию в положении ТR-133, не содержит углеводного остатка. В остальном – по аминокислотной последовательности и конформационной структуре – он практически идентичен природному Г-КСФ. ленограстим (Граноцит®) – высокоочищенный рекомбинантный протеин, состоящий из 174 аминокислот и гликозилированный в участке TR-133, – был зарегистрирован в Европе и Японии в 1993 г. Он продуцируется клетками яичника китайского хомячка, что позволило внедрить в структуру молекулы углеводные цепи, идентичные таковым у молекулы природного Г-КСФ. Таким образом, ленограстим (Граноцит®) в большей степени, чем филграстим, идентичен природному Г-КСФ, однако клиническое значение этой модификации еще не установлено. Несмотря на доказательства того, что гликозилирование несущественно для биологической активности рчГ-КСФ [12], углеводный остаток действительно придает молекуле Г-КСФ большую стабильность, защищая цистеин-17-сульфгидрильную группу [13, 14].
Исследования in vitro многократно продемонстрировали более высокую активность ленограстима (более чем на 25% выше, чем у филграстима) [13, 15]. Согласно международным стандартам специфическая активность филграстима оценивается как 100 000 МЕ/мкг против 127 760 МЕ/мкг у ленограстима. Считается, что такая разница является результатом более низкой химической стабильности филграстима, которая приводила к снижению периода его полужизни в культуральной среде, и более высокой рН-устойчивостью гликозилированной молекулы ленограстима [15].
Все сравнительные исследования, проведенные у человека, были посвящены мобилизации стволовых клеток, однако их результаты не позволяли прийти к единому заключению. M. Hoglund и соавт. установили, что в группе здоровых добровольцев при назначении ленограстима количество CД34+ клеток и гранулоцитарно-макрофагальных колониеобразующих единиц в периферической крови было на 25–30% больше, чем в группе с филграстимом [16]. При назначении ленограстима и филграстима в дозе 10 мкг/кг в крови здоровых добровольцев, получавших ленограстим, пик содержания СД34+ клеток на 6-й день стимуляции составил 104 +/- 38 СД34+/мкл против 82 +/- 35 СД34+/мкл в группе с филграстимом (р < 0,0001). Ретроспективный анализ результатов исследования 101 здорового донора, получавших ленограстим (n = 51) и филграстим (n = 50), проведенный группой итальянских исследователей, не показал достоверного различия в эффективности мобилизации СД34+ между двумя группами. Не была отмечена разница в частоте возникновения таких побочных эффектов, как костные, головные боли, тошнота, лихорадка и умеренная спленомегалия (более 2 см) [17]. Кроме того, M. Watts и соавт. сравнили плазменные концентрации Г-КСФ в 1-й день назначения и обнаружили, что уровни филграстима были достоверно выше, чем ленограстима [18]. Эти данные снова указывают на то, что снижение стабильности, которое сопровождается уменьшением эффекта филграстима in vitro, не отмечается in vivo. Однако сопоставление плазменных концентраций не всегда является хорошим показателем эффективности, поскольку концентрации препарата в плазме не всегда коррелируют с уровнем связывания его с рецепторами. Вот почему авторы исследования предполагают: более высокая активность Г-КСФ может достигаться другими механизмами, включая лиганд-рецепторное взаимодействие. В ряде исследований изучали мобилизацию стволовых клеток у больных, получавших химиотерапию, однако найти разницу между двумя препаратами не удавалось [19, 20]. Таким образом, несмотря на то что ситуация in vitro вполне ясна, есть основания сомневаться в существовании разницы в активности ленограстима и филграстима in vivo. При этом необходимо учитывать: чтобы добиться идентичных результатов при одинаковой продолжительности терапии обоими препаратами, филграстима потребовалось почти в три раза больше, чем ленограстима [41, 16].
Стандартно рекомендованы дозы Г-КСФ от 5 до 10 мкг/кг (250–500 мкг/м2). Однако в клинической практике дозы могут широко варьировать – от 50 мкг/м2 до 30 мкг/кг (более 1000 мкг/м2) и даже более 70 мкг/кг/д [21, 22]. Сверхмалые дозы (50 мкг/м2) эффективны только для предварительно не леченных больных [23]. У остальных пациентов, прежде всего у детей, эффективны стандартные дозы. В рандомизированных исследованиях при сравнении доз 5 и 7, 5 и 10 мкг/кг Г-КСФ не обнаружено достоверной разницы ни в уровне ПСК в сепарате, ни в скорости восстановления гемопоэза после трансплантации полученного материала [24]. Следует отметить, что в аналогичных исследованиях у взрослых больных найдена прямая зависимость содержания СК в периферической крови от дозы гемопоэтических факторов роста (ГФР) [25, 26]. Количество публикаций, сравнивающих мобилизационную эффективность этих двух форм Г-КСФ, ограничено, однако в существующих на сегодняшний день рандомизированных исследованиях, проведенных как на больных, так и на здоровых донорах, достоверных различий выявлено не было [18, 19, 27, 28].
Проблема оценки качества собранного материала, с точки зрения обеспечения быстрого и длительного восстановления гемопоэза, является одной из основных в онкогематологии. Культуральные исследования ГМ-КОЕ утратили свою актуальность, поскольку их невозможно стандартизировать, а результаты, полученные в разных лабораториях, широко варьируют. Кроме того, учитывая 10–14-дневную длительность культивирования Г-КСФ, в этих исследованиях определяются только поли- и мультипотентные клетки. Измерение содержания в материале клеток, несущих на своей поверхности СД34+ рецептор, на поточном флоуцитометре – самый быстрый и достоверный на сегодняшний день метод определения количества собираемых гематопоэтических стволовых клеток и предсказания посттрансплантационной кинетики восстановления. Большинство исследователей считают, что минимальная для успешного проведения аутотрансплантации доза ГСК находится в пределах 2,0–2,5 х 106 СД34+/кг в трансплантируемом материале, а оптимальная, обеспечивающая быстрое восстановление не только лейкоцитов, но и тромбоцитов, превышает 5,0 х 106 СД34+/кг [26, 29].
Одним из основных был и остается вопрос, в какой момент следует начинать лейкаферез. Эта проблема актуальна, поскольку интервалы между началом циркуляции ПСК, их максимумом и возвращением к базовому уровню после мобилизационного режима чрезвычайно коротки и вариабельны. В течение нескольких дней циркулирующая в крови популяция меняется. Вначале преобладают стволовые и полипотентные клетки, которые в дальнейшем замещаются унипотентными и зрелыми клетками, непригодными для долговременной репопуляции. После того, как была показана корреляция между количеством СД34+ клеток, циркулирующих в периферической крови, и количеством СД34+ клеток в продукте ЛФ, мониторинг этих клеток становится наиболее информативным тестом для определения момента начала сеансов ЛФ [29, 30]. Пороговым считается уровень СД34+ клеток в периферической крови > 1% от всех моноядерных клеток или абсолютный уровень ≥ 10 х 106/л СД34+ клеток [31, 32]. В случаях когда уровень СД34+ в крови не может быть определен в силу различных причин, можно использовать такие традиционные параметры, как количество лейкоцитов, тромбоцитов и моноцитов крови. Относительный моноцитоз после ХТ-индуцированной цитопении на фоне лейкоцитоза > 1,0 х 109/л и быстрого повышения количества тромбоцитов указывает на период интенсивной циркуляции ПСК [33, 34]. J. Fernandez и соавт. (1993) отмечают, что максимальное количество СД34+ клеток в группе из 18 детей с различными злокачественными опухолями было собрано при уровне лейкоцитов периферической крови > 2 х 109/л, тромбоцитов > 100 х 109/л и быстром нарастании абсолютного и относительного моноцитоза крови у больных [35]. В исследовании, в котором участвовали 225 взрослых больных миеломой (у 40% из них ХТ продолжалась более 12 мес.), хорошие сборы СД34+ клеток получены при восстановлении лейкоцитов > 0,5 х 109/л и тромбоцитов > 50 х 109/л [29]. На основании успешного сбора ПСК у 38 детей Y. Takaue предлагает начинать ЛФ при быстром нарастании лейкоцитов > 1,5 х 109/л, тромбоцитов > 150 х 109/л и моноцитов > 10% [33]. В другом педиатрическом исследовании на 16 больных ЛФ предлагается начинать при подъеме лейкоцитов > 1,0 х 109/л на фоне обязательного стабильного восстановления тромбоцитов > 70 х 109/л [36]. Многие, но не все исследователи отмечают четкую корреляцию между количеством тромбоцитов и СД34+ клеток в периферической крови [29, 33, 34].
Использование КСФ в период восстановления гемопоэза у больных после химиотерапии несколько модифицировало критерии для начала сбора ПСК. Длительность лейкопении на фоне применения КСФ короче, а число ядерных клеток в периферической крови больше. Однако в формуле крови преобладают клетки гранулоцитарного ростка различной степени зрелости, что отражает лишь частичное восстановление функций костного мозга. Таким образом, если для мобилизации ПСК используется ХТ с последующим применением одного из КСФ, то критериями для начала ЛФ должны служить восстановление по меньшей мере двух гемопоэтических ростков, а не одного миелоидного. Хотя не было проведено рандомизированных сравнительных исследований, большинство авторов признают комбинацию «ХТ + Г-КСФ» более эффективной, чем раздельное назначением ХТ и/или Г-КСФ [37]. По данным специалистов Европейской школы онкологов, назначение гранулоцитарного колониестимулирующего фактора в сочетании с химиотерапией вызывает в 10 раз больший прирост циркулирующих СК, чем назначение одного Г-КСФ [38]. По данным Европейской группы по трансплантации крови и костного мозга (EBMT), 83% сеансов сепарации ПСК проводятся после комбинированной мобилизации ХТ + Г-КСФ. Химиотерапия, как указано выше, может быть различной по длительности, сочетанию препаратов и способов их введения и во всех случаях должна быть эффективна в отношении опухоли. Традиционно Г-КСФ назначается на следующий день после окончания ХТ. Однако назначение цитокинов на Д + 3 и даже на Д + 6 при определенных условиях не отражается негативно на результатах сбора, зато снижает стоимость лечения [39].
В педиатрической практике выделение ПСК проводят на непрерывнопоточных сепараторах типа Baxter CS3000plus, COBE Spectra или Frezenius; реже – на сепараторах с прерывистым потоком Haemonetics. Во всех приборах использован принцип разделения клеток по градиенту плотности при центрифугировании (гемопоэтические клетки-предшественники находятся в слое плотностью 1050–1066). Хотя серьезные рандомизированные исследования отсутствуют, а анализ литературных публикаций затруднен в связи с неоднородностью групп и различиями в критериях оценки, складывается впечатление, что технические отличия сепараторов не сказываются на количестве и качестве собранных ПСК. Однако есть один важный параметр, которым отличаются сепараторы, – экстракорпоральный объем. Он варьирует от 165 мл у COBE Spectra до 328 мл у Baxter CS3000plus. Дело в том, что при работе сепаратора определенная часть крови донора находится в контуре аппарата, уменьшая таким образом ОЦК, что у детей с малой массой тела (менее 20 кг) существенно затрудняет проведение сеанса и может приводить к гиповолемии, гипотензии и увеличивать риск цитратной интоксикации.
С 1997 по 2009 г. в НИИ детской онкологии и гематологии РОНЦ им. Н.Н. Блохина РАМН проведено 580 сеансов сепарации ПСК у детей с солидными опухолями и гемобластозами после программной химиотерапии (у 86% пациентов) на фоне стимуляции кроветворения Г-КСФ. В 452 случаях использовался филграстим и в 128 случаях ленограстим1. Стимуляция кроветворения Г-КСФ была начата отсрочено, в среднем на 14-й (10–26-й) день от начала ХТ в фазе выхода пациентов из аплазии кроветворения, как это было описано ранее [21]. Средняя доза Г-КСФ составила 5,3 (3,8–13) мкг/кг. Средний вес больных – 28 кг (10–62), средний возраст – 9,1 (1,1–28) лет. Проведено 52 сеанса сепарации у детей с весом менее 15 кг. Большинство больных было интенсивно предлечено и на момент первого сеанса сепарации получило 5 (1–19) курсов химиотерапии. Сеансы ЛФ проводились на сепараторах Baxter CS3000plus и Cobe Spectra через двухпросветный подключичный катетер в 96% случаев. Только у 4% больных (старшего возраста) нами использовался периферический доступ. Средний объем обработанной крови 148 (38–300) мл/кг. Среднее содержание ядерных клеток в сепарате, полученном за 1 сеанс, – 1,7 (0,6–24,8) х 108/кг и СД34+ – 3,2 (0,005–32,1) x 106/кг. При сравнении групп пациентов, получавших филграстим и ленограстим, не выявлено достоверной разницы в содержании СД34+ клеток в сепарате, в количестве сборов, необходимых для получения дозы СД34+ клеток 2,0–2,5 х 106/кг, а также в частоте и выраженности побочных эффектов. Количество СД34+ клеток, собранных за 1 сеанс, составило 3,0 (0,005–28,7) х 106/кг и 3,3 (0,02–32,1) х 106/кг в группе филграстима и ленограстима соответственно (р = 0,89). Средняя суточная доза препарата составила 5,2 (3,8–10,4) и 6 (5,1–13) мкг/кг для филграстима и ленограстима соответственно (р = 0,11). Таким образом, по результатам анализа большой группы педиатрических больных можно сделать вывод о сравнимой эффективности филграстима и ленограстима, применяемых для мобилизации гемопоэтических стволовых клеток.
В нескольких международных исследованиях оценивалась способность ленограстима и филграстима увеличивать число гемопоэтических стволовых клеток в циркулирующей крови. С использованием подхода идентификации дозы (которая обеспечивала бы одинаковое число циркулирующих CD34+ клеток) было проведено исследование у 127 пациентов с лимфомой или миеломной болезнью. Чтобы в ходе цитафереза получить полноценный трансплантат, необходимо иметь 2,0 x 106 CD34+ клеток / кг. Это количество клеток обеспечивает доза Граноцита 263 мкг в сутки – один флакон или в среднем 3,5 мкг/кг/сутки. Для достижения того же результата при одинаковой терапии потребовалась доза филграстима 10 мкг/кг/сутки, то есть почти в полтора раза больше, чем Граноцита [40, 41].
При использовании метода введения одинаковой дозы двух препаратов двум группам больных и измерения числа циркулирующих CD34+ клеток вводились равные дозы двух препаратов (10 мкг/кг, поскольку изучалась мобилизация клеток без химиотерапии), при этом при помощи Граноцита получали на 25% больше CD34+ клеток, чем при введении филграстима [16, 42]. Это особенно важно, если планируется цитаферез у больных, которым будет впоследствии проведена трансплантация стволовых клеток. Действительно, в процессе приготовления клеток для трансплантации большое значение имеет число сеансов цитафереза, учитывая стоимость каждого сеанса, не говоря уже о неудобстве, доставляемом пациенту.
Проанализировав данные литературы и результаты собственных исследований, в заключение следует отметить: применение Г-КСФ существенно улучшило результаты мобилизации и сборов гемопоэтических стволовых клеток для последующей аутологичной и аллогенной трансплантации во всех группах онкологических больных и у здоровых доноров. Несмотря на то что изучение различий эффективности гликозилированных и негликозилированных Г-КСФ продолжается, каждый из них имеет свои преимущества в клинической педиатрической практике. К преимуществам филграстима следует отнести его жидкую форму и возможность варьировать суточную дозу препарата у детей с малым весом при условии разделения флакона в асептических условиях аптечной больничной сети по назначению врача.
Отрицательной стороной является нестабильность филграстима в растворе в концентрации менее 5 мкг/мл и необходимость добавлять альбумин для повышения его стабильности. Преимуществом ленограстима (Граноцит®) является его стабильность в растворе в любой концентрации, что позволяет вводить его внутривенно капельно без дополнительных сестринских манипуляций с готовым раствором. Это особенно важно у больных в посттрансплантационном периоде, когда подкожные инъекции препарата неоправданны в связи с тромбоцитопенией и риском инфицирования. Кроме того, исключается возможность сестринской ошибки при избыточном разведении препарата Г-КСФ, что может снизить его эффективность и негативно отразиться на результатах терапии.
1 В России Граноцит (ленограстим) зарегистрирован для применения у взрослых:
- для сокращения периода нейтропении и связанных с ней осложнений у больных с немиелопролиферативными новообразованиями, которым проводилась миелосупрессивная химиотерапия с последующей трансплантацией костного мозга и находящихся в группе повышенного риска развития продолжительной выраженной нейтропении;
- для уменьшения продолжительности выраженной нейтропении и связанных с ней осложнений после стандартной миелосупрессивной химиотерапии;
- для мобилизации периферических клеток – предшественников гемопоэза в периферической крови.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.