Морфологические факторы прогноза нейроэндокринных опухолей желудочно-кишечного тракта и поджелудочной железы
- Аннотация
- Статья
- Ссылки
(НЭО ЖКТ) и опухоли поджелудочной железы (НЭО ПЖ)
(НЭО ЖКТ) и опухоли поджелудочной железы (НЭО ПЖ)




НЭО соответственно своему эмбриональному происхождению делятся на опухоли верхней (карциноиды легких, тимуса, желудка и двенадцатиперстной кишки), средней (аппендикса, подвздошной, тощей и проксимальной кишки) и нижней (дистальной части толстой и прямой кишки) кишки. Эффект применения химиотерапии (ХТ) в случае нерезектабельных и метастазирующих НЭО зависит как от их функциональной активности (клинического синдрома), так и от степени злокачественности опухоли или ее биологического потенциала. Важнейшими критериями злокачественного потенциала НЭО, определяющими степень их злокачественности (Grade1), считают степень дифференцировки опухоли (высокодифференцированные, низкодифференцированные), наличие инвазии сосудов и нервов, некрозов, высокую митотическую и пролиферативную активность клеток опухоли.
Степень дифференцировки и степень злокачественности (Grade) опухоли
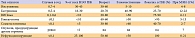
В 2000 году Всемирной организацией здравоохранения (ВОЗ) [2] была принята классификация НЭО ЖКТ и ПЖ, где эти опухоли разделены на 3 основные группы: 1) высокодифференцированные опухоли, доброкачественные и неопределенной степени злокачественности (функционирующие и нефункционирующие); 2) высокодифференцированные эндокринные карциномы низкой степени злокачественности (функционирующие и нефункционирующие); 3) низкодифференцированные эндокринные карциномы высокой степени злокачественности (мелко- и крупноклеточные эндокринные карциномы); 4) смешанные экзо-эндокринные карциномы. В настоящее время Европейской ассоциацией по нейроэндокринным опухолям (ENETS) предложено делить НЭО ЖКТ и ПЖ по степени их злокачественности (Grade) на 3 основные группы – G1, G2, G3 (табл. 1). В соответствии с этим в группы G1-G2 входят высокодифференцированные НЭО ЖКТ и ПЖ, а в группу G3 – низкодифференцированные нейроэндокринные карциномы (НЭК) [3]. Это деление базируется на параметрах, которые непосредственно отражают степень злокачественности НЭО – индексах митотической и пролиферативной активности опухолевых клеток. Индекс митотической активности может быть подсчитан при рутинном исследовании в препаратах, окрашенных гематоксилином и эозином, он определяется как количество митозов в 10 репрезентативных полях зрения (РПЗ) с равномерным распределением в них опухолевых клеток, без артефициальных изменений и при большом увеличении микроскопа (х400). Индекс пролиферации определяется при иммуногистохимическом (ИГХ) исследовании с использованием антител Ki67 (клон MIB-1) как доля клеток, ядра которых экспрессируют. Этот маркер из расчета на 100 опухолевых клеток (%) при большом увеличении микроскопа (х400). Индекс Ki67 вычисляется как среднее значение при просчете не менее 1000 клеток (оптимально- 2000 клеток). Считается, что митотический индекс более точно отражает пропорцию делящихся клеток и, следовательно, является более надежным критерием степени злокачественности НЭО, чем индекс Ki67 (4). Поэтому в морфологическом заключении при исследовании НЭО обязательно следует указывать значения и митотического индекса и индекса пролиферации. Чтобы выделить опухоли, для лечения которых рекомендовано применение более агрессивных методов терапии, следует проводить учет пролиферирующих клеток не в одном произвольно выбранном участке опухоли, а обязательно исследовать наиболее активно пролиферирующие участки опухоли – так называемые «горячие точки».
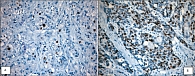
Высокодифференцированные НЭО ЖКТ и ПЖ – это опухоли низкой или промежуточной степени злокачественности, а низкодифференцированные – высокой. Низкодифференцированные НЭО имеют тенденцию к стремительной диссеминации, они устойчивы к терапии, быстро приводят к летальному исходу. Поэтому самым важным аспектом морфологического заключения является принципиальное разграничение высокодифференцированных и низкодифференцированных НЭО (рис. 1, А и Б). Высокодифференцированные НЭО – доброкачественные и неопределенной степени злокачественности (пограничные) – характеризуются слабо выраженной клеточной атипией; в высокодифференцированных эндокринных карциномах низкой степени злокачественности клеточная атипия слабо или умеренно выражена, ядра гиперхромные с отчетливыми ядрышками, характерно увеличение ядерно-цитоплазматического соотношения, митотической активности и индекса пролиферации Ki67. Большинство высокодифференцированных НЭО ЖКТ и ПЖ прогрессируют медленно, иногда в течение многих лет и даже десятилетий, но, тем не менее, являются потенциально злокачественными новообразованиями. В последние годы накоплены данные о том, что метастазы, в том числе и в печень, могут выявляться через много лет (10-30 и более) после удаления так называемых «доброкачественных» НЭО [5-9]. Поэтому сейчас рекомендовано вообще отказаться от термина «доброкачественные НЭО» и использовать термин «НЭО неопределенной степени злокачественности» [4].
Функционирующие и нефункционирующие НЭО
Для определения функционального статуса НЭО при гистологическом исследовании используют эндокринные маркеры – пептиды и/или амины, обладающие гормональной активностью (инсулин, глюкагон, соматостатин, вазоактивный интестинальный полипептид, панкреатический полипептид, гастрин, серотонин, АКТГ, кальцитонин, и другие) [10]. НЭО часто продуцируют сразу несколько гормонов, поэтому диагноз базируется как на наличии характерного гиперфункционального синдрома, так и на выявлении доминирующей популяции эндокринных клеток, составляющей более 50% клеток опухоли. В соответствии с этим НЭО верифицируют как инсулиномы, глюкагономы, гастриномы, соматостатиномы, ПИПомы, ВИПомы, кальцитониномы, карциноиды (серотонин-продуцирующие) и др. Важная информация о функциональном статусе опухоли может быть получена при исследовании ультраструктуры опухолевых клеток. Тип эндокринных гранул в их цитоплазме и их количество позволяют уточнить диагноз НЭО, особенно при нефункционирующих опухолях.
Для НЭО различной локализации имеются и свои специфические факторы прогноза, которые следует учитывать при постановке диагноза и выборе терапии.
Нейроэндокринные опухоли ПЖ (НЭО ПЖ)
Большинство высокодифференцированных функционирующих НЭО пищеварительного тракта составляют опухоли ПЖ (табл. 2). Опухоли, которые преимущественно локализуются в теле и хвосте ПЖ (глюкагономы, инсулиномы, ВИПомы), имеют склонность к гематогенной диссеминации; гастриномы ПЖ чаще метастазируют в регионарные лимфатические узлы. НЭО ПЖ, продуцирующие островковые гормоны (инсулин, глюкагон, соматостатин и панкреатический полипептид), как правило, имеют менее злокачественный потенциал, чем те, которые продуцируют эктопические гормоны, в норме не характерные для этого органа (гастрин, нейротензин, АКТГ, кальцитонин, гормон роста и другие).
Гастриномы ПЖ обладают более злокачественным потенциалом, чем соответствующие опухоли 12-перстной кишки. Хотя обычно они прогрессируют медленно, но в большинстве случаев дают метастазы в лимфатические узлы или печень. Иммунофенотип клеток гастрином ПЖ характеризуется ко-экспрессией маркеров нейроэндокринной и экзокринной дифференцировки (хромогранина А, синаптофизина, цитокератинов 19 и 20 и/или ЭМА), следовательно, они обладают смешанным экзо-эндокринным иммунофенотипом, который и определяет их злокачественный потенциал [11, 12]. В последние десятилетия применение эффективных противоязвенных препаратов в лечении пациентов с гастриномами позволяет смягчить симптомы эндокринной гиперфункции, однако это не устраняет саму причину опухоли [13]. Это привело к тому, что во всех индустриально развитых странах в последние годы возросла летальность от гастрином, обусловленная их латентным ростом и прогрессированием. Риск смерти у пациентов с гастриномами ПЖ увеличивается при высоком уровне гастрина в сыворотке, наличии метастазов в лимфатические узлы, печень, кости, при крупных размерах опухоли, а также при ее поздней диагностике.
Глюкагономы ПЖ долго могут расти как нефункционирующие опухоли, а симптомы синдрома Маллисона (некротическая мигрирующая эритема, глоссит, хейлит, анемия, снижение веса, депрессия и венозный тромбоз) возникают, как правило, в тех случаях, когда опухоль достигает достаточно больших размеров. В этой стадии уже имеются метастазы и плохой прогноз заболевания. Соматостатиномы ПЖ также могут долго не давать симптомов. Характерный для этой опухоли синдром (сахарный диабет, снижение веса, холелитиаз, стеаторея и гипохлоргидрия) возникает не во всех случаях. Иногда соматостатиномы могут проявляться симптомами карциноидного синдрома, синдрома Кушинга или другими. В таких случаях диагноз ставится исключительно после ИГХ и электронно-микроскопического исследования – на основании экспрессии соматостатина в большинстве опухолевых клеток и наличия в них характерных эндокринных гранул. На момент постановки диагноза соматостиномы ПЖ обычно достигают больших размеров, дают метастазы в печень и имеют крайне плохой прогноз.
Нефункционирующие НЭО ПЖ (вернее опухоли без выраженного клинического синдрома) – самые сложные для постановки диагноза опухоли. Определить степень нейроэндокринной дифференцировки этих опухолей позволяет только экспрессия в них общих маркеров нейроэндокринной дифференцировки – синаптофизина, хромогранина А [1, 11, 14, 15]. НЭО ПЖ чаще всего метастазируют в печень и лимфатические узлы (парапанкреатические, ворот печени, парааортальные, мезентериальные), в редких случаях – в лимфатические узлы средостения и подмышечные, еще реже в кости, брюшину, легкие, почки, щитовидную железу. Примерно 90% пациентов с НЭО ПЖ, у которых не выявлены метастазы, и около 50% пациентов с выявленными метастазами живут 5 и более лет.
Факторами более благоприятного прогноза и длительного выживания пациентов с высокодифференцированными злокачественными НЭО ПЖ, по мнению Chu Q.D. et al. [16], являются: радикальное удаление опухоли; отсутствие метастазов в печень или появление их на поздних стадиях прогрессирования опухоли; применение «агрессивной» ХТ (в случае наличия метастазов в печени).
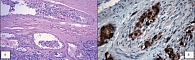
Факторы неблагоприятного прогноза всех высокодифференцированных НЭО ПЖ: нерадикальность выполненной операции; наличие метастазов в печень; низкая степень дифференцировки клеток опухоли; инвазия кровеносных (рис. 2 А), лимфатических сосудов и нервов (рис. 2 Б) (что наблюдается в 90% опухолей с метастазами или массивной инвазией окружающих органов и тканей и лишь в 30% опухолей без метастазов). Самыми важными факторами плохого прогноза высокодифференцированных НЭО ПЖ являются метастазы в печень, высокий митотический индекс и индекс Ki67. Определение индекса мечения Ki67 НЭО ЖКТ и ПЖ в соответствии с рекомендациями ENETS является золотым стандартом при определении риска прогрессирования НЭО ПЖ, выборе лечения и оценке эффективности ХТ (17). По нашим данным, более злокачественный потенциал и высокий риск появления метастазов в печень определяет и иммунофенотип клеток НЭО ПЖ. Так, факторами плохого прогноза является ко-экспрессия маркеров нейроэндокринной (хромогранина А, синаптофизина) и экзокринной дифференцировки (маркера клеток протокового эпителия – цитокератина 19, эпителиально-мембранного антигена, муцинов) (рис. 3 А и Б), а также ко-экспрессия нескольких гормонов в одной и той же клетке опухоли (например, инсулина и гастрина, инсулина и соматостатина, соматостатина и кальцитонина, АКТГ, гастрина и т. д.) [7]. Показано также, что экспрессия ассоциированного с метастазами гена 1 (MTA1) является еще одним потенциальным маркером злокачественного потенциала НЭО ПЖ [18].
НЭО пищевода. Высокодифференцированные НЭО пищевода встречаются очень редко (примерно 0,05% всех НЭО ЖКТ). Обычно они имеют крупные размеры (более 4 см), локализуются в дистальном отделе пищевода и не дают специфических гормональных синдромов.
НЭО желудка. Опухоли 1 типа – самые многочисленные из высокодифференцированных НЭО желудка (табл. 3). Они локализованы в пределах слизистого и подслизистого слоев тела желудка, образованы чаще всего ECL-клетками, продуцирующими гистамин, и обычно ассоциируются с развитием эндокринных синдромов. НЭО желудка 2 типа встречаюся реже, чем 1 типа, но могут развиваться при синдроме МЭН-1 и сопровождаться симптомами синдрома Золлинера-Эллисона (ЗЭС). Опухоли небольших размеров могут быть удалены эндоскопически и имеют хороший прогноз. НЭО желудка 3 типа – это обычно опухоли из ECL-, серотонин- или гастрин-продуцирующих клеток, без преимущественной локализации в желудке. Опухоли 2 и 3 типа размером более 2 см, с инвазией сосудов, глубокой инвазией мышечной пластинки обычно дают метастазы в лимфатические узлы [19, 20].
НЭО двенадцатиперстной и тощей кишки. Высокодифференцированные НЭО и локализованные в двенадцатиперстной и тощей кишке обычно растут бессимптомно [15]. Выделяют 4 типа НЭО: гастриномы, соматостатиномы, нефункционирующие серотонин-, гастрин- или кальцитонин-продуцирующие нейроэндокринные карциномы и ганглиоцитарные параганглиомы. До 2/3 опухолей этой локализации составляют гастриномы, которые обычно локализуются в верхних отделах двенадцатиперстной кишки, ассоциированы с СЗЭ, имеют небольшие размеры (не более 1 см), могут быть спорадическими, а при синдроме МЭН-1 – множественными. Дуоденальные гастриномы даже небольших размеров (менее 0,5-1 см) могут давать метастазы в регионарные лимфатические узлы, которые иногда значительно больше первичной опухоли, поэтому в некоторых случаях их ошибочно трактуют как первичные гастриномы ПЖ или «первичные гастриномы лимфатических узлов». Дуоденальные соматостатиномы обычно локализуются в области Фатерова соска и не вызывают специфического синдрома. При инвазии мышечного слоя вероятность появления метастазов в регионарных лимфатических узлах очень велика. Дуоденальные ганглиоцитарные параганглиомы обычно локализуются вблизи Фатерова соска и даже при размерах более 2 см и инвазии мышечной пластинки имеют благоприятный прогноз.
Злокачественные серотонин-продуцирующие карциноиды. Термин «карциноид» описывает НЭО различной локализации – ЖКТ, легких, тимуса и яичников. Карциноиды верхней кишки редко продуцируют серотонин, приводя к развитию карциноидного синдрома, но часто продуцируют гистамин и манифестируют атипичным карциноидным синдромом. Карциноиды средней кишки происходят из энтерохромаффинных клеток (ЕС) тощей, подвздошной, слепой и восходящей кишки; карциноидный синдром обычно манифестирует на поздних стадиях их роста – при наличии метастазов, чаще всего в печень. В классификации ВОЗ и в некоторых более поздних классификациях эти опухоли относят к высокодифференцированным нейроэндокринным карциномам (злокачественным карциноидам) низкой степени злокачественности. Очень важно уже на ранней стадии заболевания выделить карциноиды с риском быстрого прогрессирования и короткого срока выживания пациентов, требующие применения более агрессивных схем ХТ. Во многих классификациях НЭО ЖКТ с индексом Ki67<2% относят к доброкачественным. Однако подавляющее большинство злокачественных истинных карциноидов (серотонин-субстанцию Р-продуцирующих и вызывающих карциноидный синдром) с массивной инвазией мышечного слоя и окружающих структур, метастазами в печень и регионарные лимфатические узлы (рис. 4 А) имеют очень низкую митотическую и пролиферативную активность (Ki67 = 0-1,75%) [21] (рис. 4Б). По данным Chaudhry [22], у пациентов со злокачественными карциноидами с низким индексом пролиферации (Ki67 < 1%) часто наблюдают быстрое прогрессирование, отдаленное метастазирование и короткий срок выживания. В целом у пациентов с опухолями с индексом пролиферации Ki67 = 0,5-2% прогноз был существенно хуже, чем с индексом Ki67 < 0,5%, а выживаемость при индексе Ki67 ≥ 1% была вдвое меньше, чем при Ki67 < 1%. Эти данные совпадают с результатами наших исследований. Таким образом, в случае злокачественных карциноидов ЖКТ (функционирующих и нефункционирующих) индекс пролиферации Ki67 менее 2% не является фактором благоприятного прогноза. Показано также, что фактором более высокого риска прогрессирования и метастазирования этих опухолей является солидный тип строения, с которым коррелирует повышение индекса пролиферации Ki67. НЭО ПЖ также относятся к опухолям верхней кишки, но истинные карциноиды этого органа встречаются крайне редко, в литературе описано всего около 100 случаев. Это очень злокачественные и резистентные к терапии опухоли, которые в 69-88,4% случаев дают множественные отдаленные метастазы [10]. Медиана выживаемости пациентов с карциноидами ЖКТ с момента постановки диагноза в среднем составляет около 6 лет (при разбросе от нескольких месяцев до десятков лет) и зависит от распространенности болезни, то есть стадии TNM [1].
НЭО дистального отдела тощей и подвздошной кишки. Высокодифференцированные НЭО этой локализации вместе с соответствующими опухолями желудка и аппендикса являются самой многочисленной группой НЭО ЖКТ [15]. Обычно эти опухоли к моменту постановки диагноза имеют размеры более 2 см, глубоко инвазируют мышечную пластинку и дают метастазы в регионарные лимфатические узлы. Примерно в 40% случаев опухоли бывают множественными, состоят из клеток, продуцирующих серотонин, субстанцию Р, калликреин, катехоламин, а также других типов клеток. Примерно у 20% пациентов с НЭО подвздошной кишки развивается карциноидный синдром.
НЭО толстой и прямой кишки. НЭО толстой кишки встречаются редко и чаще всего являются низкодифференцированными карциномами, которые имеют плохой прогноз и к моменту постановки диагноза уже дают метастазы. НЭО прямой кишки встречаются значительно чаще. Большинство из них выявляют эндоскопически в виде маленьких образований (менее 1 см), расположенных в подслизистом слое; эти опухоли имеют более благоприятный прогноз. Клетки таких НЭО могут экспрессировать глюкагон, глицетин, панкреатический полипептид. Метастазируют только опухоли размером более 2 см и/или опухоли с глубокой инвазией мышечной пластинки.
НЭО аппендикса составляют 25-30% всех НЭО ЖКТ и встречаются у пациентов более молодой возрастной группы (30-50 лет), чаще у женщин, иногда развиваются у детей. Прогноз и риск злокачественного роста зависит от размера опухоли, индекса пролиферации, степени инфильтрации стенки кишки и окружающей жировой клетчатки. Для большинства пациентов с карциноидами аппендикса прогноз более благоприятный, чем для соответствующих опухолей подвздошной кишки, они редко дают метастазы в лимфатические узлы, обычно имеют низкий митотический индекс и индекс Ki67. Как правило, их обнаруживают при аппендэктомии, в основном они локализуются в верхних отделах аппендикса, редко имеют размеры более 2,5 см. НЭО аппендикса часто экспрессируют серотонин и субстанцию Р, значительно реже – энтероглюкагон. Серотонин-продуцирующие НЭО аппендикса очень редко вызывают карциноидный синдром. Эти опухоли следует дифференцировать с редкими бокаловидно-клеточными карциноидами (аденокарциноидами), которые являются смешанными экзо-эндокринными опухолями со значительно менее благоприятным прогнозом [23]. Важным критерием прогноза НЭО аппендикса является их размер: опухоли 1-2 см в 10% случаев дают метастазы в лимфатические узлы, а при размерах 2 см и более – значительно чаще.
Низкодифференцированные нейроэндокринные (эндокринные) карциномы (НЭК). Низкодифференцированные НЭК растут в виде солидных пластов причудливой формы с участками диффузного роста, они образованы из клеток мелких или средних размеров, с крупными полиморфными ядрами с отчетливыми ядрышками; для них характерны центральные некрозы, инвазия сосудов, нервов и окружающих органов и тканей, а также множественные метастазы, в том числе отдаленные. Митотическая активность и индекс пролиферации в этих опухолях очень высокие (табл. 1). Клетки НЭК интенсивно экспрессируют синаптофизин и слабо или в виде очагов – хромогранин А. По экспрессии гормонов и клинической симптоматике НЭК очень изменчивы. Фактором очень плохого прогноза и агрессивного клинического течения является наличие у пациентов одновременно нескольких гиперфункциональных синдромов, например, синдромов Золлингера-Эллисона и Кушинга, гиперинсулинизма (гипогликемии) и Золлингера-Эллисона и т. д. [2]. Низкодифференцированные НЭО желудка чаще встречаются у мужчин, очень редко при синдроме МЭН-1. К моменту постановки диагноза опухоли обычно достигают больших размеров (более 4 см) и дают обширные метастазы. Прогноз очень неблагоприятный – примерно 2/3 пациентов умирают от прогрессирования опухоли и обширного метастазирования в течение года с момента постановки диагноза. Низкодифференцированные дуоденальные карциномы – это обычно гормонально неактивные мелкоклеточные карциномы, чаще всего локализованные в области Фатерова соска, которые в момент постановки диагноза обычно уже дают метастазы в регионарные лимфатические узлы и печень. Низкодифференцированные НЭК в подвздошной кишке не описаны, а в ПЖ и прямой кишке встречаются крайне редко и имеют исключительно плохой прогноз.
Смешанные экзо-эндокринные карциномы ПЖ – это редкий тип опухолей, в которых тесно связаны, как в первичной опухоли, так и в метастазах два гистогенетически различных компонента – протоковый и/или ацинарноклеточный эндокринный должен составлять не менее трети ткани опухоли. Еще реже встречаются смешанные экзо-эндокринные карциномы пищевода [15] и смешанные бокаловидно-клеточные карциноиды аппендикса. Прогноз для смешанных карцином значительно хуже, чем для большинства НЭО, и определяется экзокринным компонентом опухоли с более агрессивным биологическим потенциалом, что требует особых терапевтических подходов.
Другие факторы прогноза НЭО ЖКТ и ПЖ. Определение экспрессии рецепторов к соматостатину 1-5 типа. Иммуногистохимическое исследование статуса рецепторов к соматостатину, интенсивности экспрессии, плотности их распределения на клетках неоперабельных НЭО или метастазов НЭО без выявленного первичного очага проводится с целью определения чувствительности опухоли к биотерапии и является обоснованием для применения аналогов соматостатина [24]. Выявление низкого уровня экспрессии этих рецепторов либо их отсутствие может объяснить слабую чувствительность или нечувствительность некоторых опухолей к соответствующей терапии [25].
Синдром множественной эндокринной неоплазии 1 типа (МЭН-1). Этот синдром обусловлен мутацией в перицентрической области хромосомы 11 (11q13), наследуется по аутосомно-доминантному типу, реже является результатом новой мутации [26]. Эта мутация приводит к нерегулируемой пролиферации эндокринных клеток с поражением обязательной триады органов: 1) паращитовидных желез (синхронная или асинхронная гиперплазия и/или опухоль); 2) НЭО и/или микроаденоматоз поджелудочной железы; 3) НЕО передней доли гипофиза. Реже синдром МЭН-1 сочетается с НЭО двенадцатиперстной кишки, желудка, тимуса, легких, папиллярным или фолликулярным раком или аденомой щитовидной железы (но не с медуллярным раком), патологией надпочечников. Клиническая манифестация заболевания приходится на 3-4 декаду жизни. Среди НЭО ПЖ при этом синдроме преобладают клинически нефункционирующие опухоли, несколько реже встречаются инсулиномы, гастриномы. Инсулиномы при МЭН-1 часто множественные и более злокачественные, чем спорадические, а гастриномы, напротив, менее злокачественные. Группой риска являются пациенты с первичным гиперпаратиреозом, НЕО ПЖ и гипофиза, синдромами гиперинсулинемии, СЗЭ и другими, а также с патологией сразу нескольких эндокринных органов, которая проявляется в возрасте до 50 лет. При обследовании таких пациентов обязательным является изучение семейного анамнеза, что в большинстве случаев позволяет поставить правильный диагноз даже без проведения у них кариотипирования.
Множественные опухоли. Вероятность возникновения множественных опухолей очень велика у пациентов с синдромом МЭН-1. Показано, что у 13% пациентов с НЭО ЖКТ встречаются также синхронные и метахронные аденокарциномы. В частности, описаны синхронные аденокарциномы и НЭК толстой кишки и аппендикса, мы наблюдали такие опухоли и в желудке. Очевидно, что в подобных случаях прогноз и тактика лечения определяется наличием новообразования с более злокачественным потенциалом.
Заключение
Возраст большинства пациентов с НЭО – до 50 лет, среди них много молодых людей. При своевременно поставленном диагнозе и радикальной операции они живут долго или полностью излечиваются. Очевидно, что высокодифференцированные НЭО ПЖ и НЭО ЖКТ различаются не только по локализации, но и по злокачественному потенциалу и прогнозу. Для определения адекватного объема операции и тактики ведения пациентов необходимо опираться на четкие морфологические критерии злокачественности НЭО, которые позволяют выделить опухоли с наиболее агрессивным клиническим поведением и определить прогноз.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.