количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
Московский международный форум кардиологов: Новые оральные антикоагулянты для профилактики инсульта при фибрилляции предсердий
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" № 2
- Аннотация
- Статья
- Ссылки
Возраст наступления инсульта – это показатель уровня развития здравоохранения в той или иной стране, отметила профессор И.И. Чукаева, заведующая кафедрой поликлинической терапии № 2 лечебного факультета РНИМУ им. Н.И. Пирогова, д.м.н., открывая сателлитный симпозиум компании «Байер», который прошел 15 июня 2012 г. в рамках Московского международного форума кардиологов. Среди вопросов, затронутых докладчиками, особое внимание было уделено роли фибрилляции предсердий как фактора риска инсульта и необходимости профилактической антикоагулянтной терапии у таких пациентов.
На протяжении многих лет в распоряжении врачей был варфарин, показавший себя эффективным антикоагулянтом. Однако, как было отмечено, варфарин обладает рядом недостатков: узкое терапевтическое окно, непредсказуемый антикоагулянтный эффект, множество взаимодействий с лекарствами и пищевыми продуктами. Все это требует регулярного лабораторного контроля показателей крови для подтверждения эффективности и безопасности проводимого лечения и ограничивает применение варфарина, получившего широкое распространение во врачебной практике.
Неудовлетворенность врачей существующими лекарственными средствами привела к созданию и разработке новых перспективных препаратов, в частности Ксарелто® (ривароксабан). Сравнение ривароксабана с варфарином в ходе клинического испытания показало, что новый препарат не уступает стандарту лечения, а у пациентов, строго соблюдающих предписанный режим лечения, даже способен более эффективно снижать риск инсульта, чем варфарин. Кроме того, при одинаковых суммарных показателях безопасности ривароксабан продемонстрировал меньшее число фатальных и тяжелых кровотечений, включая внутричерепные кровоизлияния и геморрагический инсульт.
Было отмечено, что Ксарелто® (ривароксабан) показал такую же эффективность и безопасность у пациентов, имеющих сниженную функцию почек, нуждающихся в одновременном приеме низких доз антиагрегантов или уже перенесших инсульт или транзиторную ишемическую атаку, как и во всей популяции исследования.
Возраст наступления инсульта – это показатель уровня развития здравоохранения в той или иной стране, отметила профессор И.И. Чукаева, заведующая кафедрой поликлинической терапии № 2 лечебного факультета РНИМУ им. Н.И. Пирогова, д.м.н., открывая сателлитный симпозиум компании «Байер», который прошел 15 июня 2012 г. в рамках Московского международного форума кардиологов. Среди вопросов, затронутых докладчиками, особое внимание было уделено роли фибрилляции предсердий как фактора риска инсульта и необходимости профилактической антикоагулянтной терапии у таких пациентов.
На протяжении многих лет в распоряжении врачей был варфарин, показавший себя эффективным антикоагулянтом. Однако, как было отмечено, варфарин обладает рядом недостатков: узкое терапевтическое окно, непредсказуемый антикоагулянтный эффект, множество взаимодействий с лекарствами и пищевыми продуктами. Все это требует регулярного лабораторного контроля показателей крови для подтверждения эффективности и безопасности проводимого лечения и ограничивает применение варфарина, получившего широкое распространение во врачебной практике.
Неудовлетворенность врачей существующими лекарственными средствами привела к созданию и разработке новых перспективных препаратов, в частности Ксарелто® (ривароксабан). Сравнение ривароксабана с варфарином в ходе клинического испытания показало, что новый препарат не уступает стандарту лечения, а у пациентов, строго соблюдающих предписанный режим лечения, даже способен более эффективно снижать риск инсульта, чем варфарин. Кроме того, при одинаковых суммарных показателях безопасности ривароксабан продемонстрировал меньшее число фатальных и тяжелых кровотечений, включая внутричерепные кровоизлияния и геморрагический инсульт.
Было отмечено, что Ксарелто® (ривароксабан) показал такую же эффективность и безопасность у пациентов, имеющих сниженную функцию почек, нуждающихся в одновременном приеме низких доз антиагрегантов или уже перенесших инсульт или транзиторную ишемическую атаку, как и во всей популяции исследования.

Профессор И.И. Чукаева
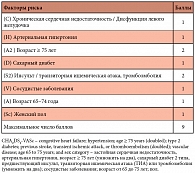
Таблица. 1. Шкала оценки риска развития инсульта CHA2DS2-VASc

Профессор Н.П. Санина

Профессор Г.Е. Гендлин

Таблица 2. Классификация заболеваний почек K/DOQI
Лечение антикоагулянтами в практике кардиолога в стационаре и в поликлинике
Профессор И.И. ЧУКАЕВА, заведующая кафедрой поликлинической терапии № 2 лечебного факультета РНИМУ им. Н.И. Пирогова, д.м.н., обратила внимание на универсальность проблемы тромбоэмболических осложнений в практике современного врача, на их важность как для здоровья, так и для жизни пациентов. Например, ежегодно в мире регистрируется около 25 млн случаев тромбозов глубоких вен. По данным российский ангиологов и ангиохирургов, тромбоз глубоких вен возникает с частотой 160 случаев на 100 тыс. населения в год. Последствиями данного заболевания являются тромбоэмболия легочной артерии (ТЭЛА) и посттромботический (посттромбофлебитический) синдром (хронические боли, трофические язвы). Тромбозы коронарных артерий обусловливают до 95% всех крупноочаговых инфарктов миокарда, 80% инсультов, инфаркты других органов. Внутрисердечный тромбоз (в частности, тромбоз ушка левого предсердия), который выявляется примерно у 30% пациентов с фибрилляцией предсердий (ФП), нередко приводит к ишемическому инсульту. При этом ФП можно считать одним из наиболее частых случаев кардиологической патологии, приводящей к тромбозам.
ФП сопутствует на определенном этапе развития многим сердечно-сосудистым заболеваниям. Риск развития ФП в течение жизни достаточно высок и по достижении 40-летнего возраста составляет 25% как у мужчин, так и у женщин, что превышает, к примеру, риск развития сердечной недостаточности у женщин и мужчин. Являясь результатом развития артериальной гипертонии (АГ) и ишемической болезни сердца (ИБС), ФП выступает независимым фактором риска инсульта, сердечно-сосудистой смерти, сердечной недостаточности (в свою очередь, сердечная недостаточность повышает риск ФП, что ухудшает общий прогноз). При этом пациенты редко жалуются на сердцебиение, а чаще – на одышку при физической нагрузке, утомляемость, боли в грудной клетке, головокружение, внезапное появление чувства тревоги, раздражительность.
ФП может протекать без клинической симптоматики, и нередко первым проявлением заболевания являются осложнения (ТЭЛА, сердечная недостаточность). Для оценки выраженности симптомов, связанных с ФП, разработана классификация EHRA (European Heart Rhythm Association – Европейская ассоциация сердечного ритма): 1-й класс характеризуется отсутствием симптомов; 2-й класс – легкими симптомами (не нарушают нормальной повседневной активности); 3-й класс – выраженными симптомами (изменяют нормальную повседневную активность); 4-й класс – инвалидизирующими симптомами (нормальная повседневная активность невозможна).
Основную опасность для жизни пациента с ФП представляет инсульт, частота которого у пациентов с ФП почти в 5 раз выше, чем у пациентов без нее. С целью предупреждения тромбоэмболических осложнений больным с ФП показана антитромботическая терапия, за исключением больных низкого риска (изолированная ФП у лиц моложе 65 лет) или лиц, имеющих противопоказания. Показания к проведению антитромботической терапии определяются не формой ФП (бессимптомная, пароксизмальная, персистирующая, длительно персистирующая, постоянная), а зависят от наличия, характера и числа факторов риска тромбоэмболических осложнений. Факторы риска оцениваются по шкалам CHADS2 (congestive heart failure, hypertension, age ≥ 75 years, type 2 diabetes, and previous stroke or transient ischemic attack (doubled) – застойная сердечная недостаточность, АГ, возраст ≥ 75 лет, сахарный диабет (СД) 2 типа, предшествующий инсульт или транзиторная ишемическая атака (ТИА) (умножить на два)) или CHA2DS2-VASc (congestive heart failure; hypertension; age ≥ 75 years (doubled); type 2 diabetes; previous stroke, transient ischemic attack, or thromboembolism (doubled); vascular disease; age 65 to 75 years; and sex category – застойная сердечная недостаточность, АГ, возраст ≥ 75 лет (умножить на два), СД 2 типа, предшествующий инсульт, ТИА или тромбоэмболия (умножить на два); сосудистые заболевания; возраст от 65 до 75 лет; пол). При этом рекомендуется учитывать соотношение риска и пользы для каждого пациента. Шкала CHA2DS2-VASc была создана для выявления пациентов, имеющих высокий риск инсульта, несмотря на низкое число баллов в соответствии со шкалой CHADS2. Алгоритм оценки следующий: пациент оценивается по шкале CHADS2, если набрано 2 балла, то пациент получает назначение, если менее 2 баллов – проходит повторную оценку по шкале CHA2DS2-VASc и в этом случае получает назначение также в соответствии с числом набранных баллов (табл. 1).
В случае если число баллов превышает или равно 2, рекомендуется прием пероральных антикоагулянтов; если обнаружен один клинически значимый фактор риска (1 балл), то возможными вариантами терапии являются прием пероральных антикоагулянтов, что предпочтительно, или низкие дозы аспирина. Возможен также отказ от антитромботической терапии, если факторов риска нет (0 баллов), но допустим прием низких доз аспирина, отсутствие терапии предпочтительнее. Прием антикоагулянтов рекомендован при всех формах ФП (пароксизмальной, персистирующей, длительно персистирующей, постоянной), кроме бессимптомной.
История применения антикоагулянтов непрямого действия насчитывает более полувека, медицинское использование варфарина было начато в 1954 г. Их эффективность для профилактики кардиоэмболического инсульта подтверждена клиническими исследованиями. По данным исследования ACTIVE W (Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events – Исследование клопидогрела с ирбесартаном при фибрилляции предсердий; открытое подысследование с целью сравнения комбинации аспирина и клопидогрела и пероральных антикоагулянтов), проводившиеся в течение 1,5 лет наблюдения показали, что при ФП пероральные антикоагулянты эффективнее предотвращают инсульт, чем комбинация антиагрегантов «клопидогрел + аспирин» [1].
Однако терапия варфарином имеет ряд ограничений: непредсказуемый антикоагулянтный ответ; узкое терапевтическое окно; медленное развитие/окончание эффекта; взаимодействие со многими лекарственными средствами и пищевыми продуктами; возможность резистентности к варфарину – и, как следствие перечисленных свойств, связана с необходимостью проведения постоянного контроля антикоагулянтного эффекта и частой коррекции дозы для поддержания эффективности и безопасности лечения. К недостаточному применению антикоагулянтов приводят переоценка существующего у пациентов риска развития кровотечения (например у пациентов пожилого возраста, имеющих серьезные кровотечения в анамнезе), то есть боязнь геморрагических осложнений, а также ожидаемая плохая приверженность лечению, то есть когда по субъективному мнению врача ожидаемые риски превосходят ожидаемую пользу.
Причиной такой избыточной боязни осложнений является частота, с которой они наблюдаются на фоне применения варфарина; с этим препаратом, по данным Управления по контролю качества пищевых продуктов и лекарственных препаратов США (Food and Drug Administration – FDA), связывают 13% от всех сообщаемых побочных эффектов лекарств. Большинство из этих сообщаемых случаев – кровотечения различной локализации, в том числе внутричерепные (геморрагические инсульты и другие внутричерепные кровоизлияния), а также смертельные кровотечения. Следует отметить, что большая часть факторов риска инсульта и кровотечения при лечении антикоагулянтами совпадает: пожилой возраст, АГ, в анамнезе инфаркт миокарда или ИБС, наличие цереброваскулярных заболеваний. Факторами риска кровотечений при антикоагулянтной терапии служат анемия, кровотечения в анамнезе, почечная недостаточность, сопутствующее лечение антиагрегантами.
Опрос, проведенный среди российских врачей, показал, что 60% сотрудников стационаров, 50% – специализированных поликлиник и 30% – районных поликлиник полагают, что более 10 человек из числа их пациентов нуждаются в приеме варфарина. Наиболее распространенными причинами отмены варфарина врачами являются сложности, вызванные потребностью в частом контроле международного нормализованного соотношения (МНО), побочные эффекты и нежелательные явления, когнитивные нарушения, а также назначение лекарств, несовместимых с варфарином.
Эффект варфарина ослабляют многие широко распространенные лекарственные средства. В этот список входят популярные антибиотики, препараты для снижения холестерина, оральные контрацептивы, противоязвенные препараты, витамины K и C, коэнзим Q10, парацетамол, барбитураты, вальпроевая кислота, препараты, содержащие компоненты растительного происхождения – женьшень и зверобой. Пища, богатая витамином K, также снижает эффективность варфарина. Частота назначений антикоагулянтов нередко не соответствует потребностям пациента, его индивидуальной степени риска инсульта. Назначение антикоагулянтов пациенту, который в них не нуждается, ведет к повышению риска осложнений (кровотечений). Неназначение антикоагулянтов нуждающемуся в них пациенту означает, что пациент оставлен наедине с риском потенциально смертельного осложнения – инсульта.
В настоящее время в распоряжении врача есть новые антикоагулянты, как пероральные (ривароксабан, апиксабан, эдоксабан, бетриксабан, дабигатран), так и парентеральные (низкомолекулярный гепарин, нефракционированный гепарин). Новые пероральные антикоагулянты имеют предсказуемую фармакодинамику, сравнительно небольшое количество взаимодействий с другими лекарственными средствами и пищевыми продуктами, более широкий по сравнению с варфарином терапевтический диапазон, при этом необходимости в проведении рутинного контроля коагуляции не возникает. Препараты не требуют индивидуального подбора, то есть используются в фиксированных дозах. Важным преимуществом новых антикоагулянтов является лучшее соотношение риска и ожидаемой пользы.
Первым представителем пероральных антикоагулянтов – прямых ингибиторов фактора X – является препарат Ксарелто® (ривароксабан). Он обладает высоким сродством к ключевому звену коагуляционного каскада – активированному фактору X. Ксарелто блокирует синтез нового тромбина, регулирует его образование за счет прямого воздействия на фактор X, не влияя при этом на пул, уже имеющийся в кровотоке и тканях тромбина. Таким образом, ривароксабан эффективно предотвращает образование тромбов, не затрагивая антикоагулянтные, репаративные и противовоспалительные функции тромбина. В отличие от непрямых ингибиторов фактора Xа, Ксарелто® блокирует как свободный, так и связанный в тромбе фактор Xа.
Как отметила в заключение профессор И.И. Чукаева, профилактика инсульта и системных тромбоэмболий является краеугольным камнем в лечении больных с ФП, и стратегия антикоагулянтной терапии должна избираться одновременно с антиаритмической. Новые пероральные антикоагулянты, в частности Ксарелто® (ривароксабан), открывают новые возможности в профилактике инсульта и системных тромбоэмболий у больных ФП неклапанного генеза.
Доказательная медицина для профилактики инсульта. Исследование ROCKET AF
Инсульт является важной проблемой здравоохранения, подчеркнула д.м.н., профессор кафедры терапии факультета усовершенствования врачей МОНИКИ им. М.Ф. Владимирского Н.П. САНИНА, ведь это заболевание приводит к высокой инвалидизации, высокой смертности и, как следствие, к потерям для пациента и его семьи, а также является тяжелой нагрузкой для системы здравоохранения. Последствия инсульта всем хорошо известны, и их перечисление звучит угрожающе: параличи, речевые и когнитивные расстройства, снижение памяти, нарушения в когнитивной и эмоциональной сферах. В таких странах, как Япония и США, риск инсульта и смертность от него удалось заметно снизить благодаря широкому применению антикоагулянтной терапии, но в России, подчеркнула профессор Н.П. Санина, адекватное лечение назначается только 26% пациентов из тех, кому показана такая терапия. Цифры по регионам могут различаться, например, в Московской области только 16% пациентов с ФП, перенесших инсульт, получают антикоагулянты.
ФП является сильным независимым фактором риска инсульта. Как показало Фрамингемское исследование, ФП повышает риск инсульта в 4,8 раза [2]. Кроме того, как показало итальянское популяционное исследование [3] и испанское ретроспективное исследование [4], ФП увеличивает риск повторного инсульта. Риск инсульта, согласно рекомендациям, оценивают по шкале CHADS2, где (C) – хроническая сердечная недостаточность (1 балл); (H) – АГ (1 балл); (A) – возраст ≥ 75 лет (1 балл); (D) – СД (1 балл); (S) – инсульт или ТИА (2 балла). Сумма баллов может быть от 0 до 6. В клинических исследованиях доказано наличие корреляции между частотой инсульта у пациентов без антитромботической терапии с числом баллов при расчете на 100 пациенто-лет. Так, при 6 баллах эта частота составляет 18,2, а при 0 баллов – 1,9 (примерно в 10 раз меньше).
Как уже было сказано, стратегия лечения больных с ФП наравне с выбором одного из двух вариантов борьбы с аритмией (контроль частоты сердечных сокращений (ЧСС) или контроль ритма) предполагает и антикоагулянтную терапию, направленную на профилактику инсульта. По словам профессора Н.П. Саниной, врачи не любят использовать варфарин, наиболее часто назначаемый в России оральный антикоагулянт, из-за сложностей его применения [5]. Требуется регулярный контроль МНО и коррекция дозы, что затруднительно у пожилых пациентов или пациентов с массивной сопутствующей терапией. Любое отклонение от терапевтического интервала МНО чревато осложнениями или недостаточностью профилактического эффекта. Поэтому понятна потребность врача в принципиально новых препаратах, максимально приближающихся к «идеальному» антикоагулянту.
В настоящее время разработаны новые антикоагулянты, которые представлены прямыми антикоагулянтами, блокирующими один фактор (IIа или Xа). Это ривароксабан, апиксабан, эдоксабан, бетриксабан, ксимелогатран, дабигатран, AZD 0837. Кроме того, существуют непрямые блокаторы фактора Xа, например фондапаринукс. «Идеальный» антикоагулянт должен обладать эффективностью, доказанной в ходе рандомизированных клинических исследований; предсказуемым дозозависимым эффектом; широким терапевтическим окном; быстрым началом и четко ограниченным окончанием действия; не иметь взаимодействий с другими лекарственными средствами и пищевыми продуктами; иметь пероральный прием, фиксированную дозу, антидот, одну точку приложения в коагуляционном каскаде, оказывая при этом влияние как на свободный, так и на связанный в тромбе фактор свертывания крови [6].
Свойства ривароксабана таковы, что его можно рассматривать как препарат, максимально близкий к идеальному антикоагулянту. Абсолютная биодоступность при приеме дозы 10 мг – 80–100%; при приеме дозы 20 мг – 60% и повышается до 80% при приеме с пищей, максимальная концентрация в плазме достигается через 2–4 часа; связывание с белками плазмы – 92–95%; 1/3 препарата выводится из организма в неизмененном виде через почки; 2/3 препарата метаболизируется в печени в неактивные вещества; средний период полувыведения составляет 5–7 часов у здоровых добровольцев и 11–13 часов у пациентов, ривароксабан не имеет взаимодействий с пищевыми продуктами и ограниченный потенциал взаимодействия с другими лекарственными средствами, сочетается с антибиотиками, статинами, антиаритмиками, гипотензивными, ферментативными, нестероидными противовоспалительными препаратами, противоязвенными, антидепрессантами и другими лекарственными средствами. Ривароксабан эффективно ингибирует как свободный, так и связанный в тромбе фактор Xа. Ксарелто® обладает широким терапевтическим коридором, не требуя контроля параметров коагуляции, не влияет на тромбоцитарное звено гемостаза, не вызывая аутоиммунной стимуляции тромбоцитов и требуя контроля за их числом. Препарат предназначен для приема в фиксированной дозе внутрь один раз в день.
В последние годы был проведен целый ряд крупных клинических исследований новых антикоагулянтов. В их числе – рандомизированное двойное слепое с двойным плацебоконтролем исследование ROCKET AF (Rivaroxaban Once daily oral direct Factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation – Прямое ингибирование фактора Xa при пероральном приеме ривароксабана один раз в сутки по сравнению с антагонистами витамина K для профилактики инсульта и эмболии при фибрилляции предсердий), в котором испытывали ривароксабан в дозе 20 мг в сутки (15 мг в сутки для пациентов со сниженной функцией почек) и сравнивали с варфарином. В исследование были включены больные с неклапанной ФП и инсультом/ТИА или системной эмболией вне центральной нервной системы (ЦНС) в анамнезе либо как минимум с двумя из следующих факторов риска: сердечная недостаточность, АГ, возраст ≥ 75 лет, СД.
На протяжении исследования, управляемого по событиям (то есть для оценки основных параметров эффективности и безопасности требовалось определенное, заранее рассчитанное число событий), сравнивали частоту событий – инсульта и внецеребральной эмболии – у пациентов, слепо рандомизированных в группы ривароксабана или варфарина, что контролировалось двойным ослеплением. В группе варфарина частота событий составила 2,16 на 100 пациенто-лет, в группе ривароксабана – 1,71. Число случаев достижения первичной конечной точки, за которую была принята комбинация инсульта/ТИА и системной тромбоэмболии вне пределов ЦНС, в группе ривароксабана составляло 184 (7061 пациент в группе рандомизации), в группе варфарина – 221 (7082 пациента в лечебной группе). При оценке популяции всех рандомизированных пациентов ривароксабан оказался столь же эффективен, что и варфарин (p < 0,001 для гипотезы не меньшей эффективности). В группе пациентов, строго соблюдавших предписанный режим лечения, ривароксабан способен дополнительно снижать относительный риск инсульта на 21% по сравнению с варфарином [7].
Общие показатели безопасности ривароксабана и варфарина оказались сходными (частота событий первичной конечной точки безопасности составила 14,91 в группе ривароксабана и 14,52 в группе варфарина, р = 0,442). Однако ривароксабан статистически достоверно реже вызывал смертельные кровотечения (почти в два раза реже), а также кровотечения из жизненно важных органов и внутричерепные кровоизлияния. Примечательно, что в исследовании не выявлено увеличения числа инфарктов миокарда (ИМ), хотя около 17% участвовавших – пациенты с перенесенным ИМ. Согласно выводам, сделанным профессором Н.П. Саниной, ривароксабан может считаться серьезной альтернативой варфарину как средство профилактики инсульта у пациентов с ФП.
Антикоагулянтная терапия у сложных категорий пациентов
Термин «кардиоренальный синдром» первоначально был введен для обозначения снижения функции почек при тяжелой хронической сердечной недостаточности (ХСН). В настоящее время общепризнанным считается существование связи между сердечно-сосудистыми заболеваниями (ССЗ), сниженной функцией почек и смертностью, подчеркнул профессор кафедры госпитальной терапии № 2 РНИМУ им. Н.И. Пирогова, д.м.н. Г.Е. ГЕНДЛИН. Эта связь выявляется независимо от того, что первично: болезнь сердца или почек. Современная медицина выделяет 5 типов кардиоренального синдрома (КРС):
Из числа больных с ХСН 29,8% имеют показатели СКФ 30–59 мл/мин [9]. Мягкая почечная недостаточность – сильный прогностический фактор повышения сердечно-сосудистой и общей смертности. Выживаемость больных с ХСН в значительной степени зависит от уровня МА. Согласно существующим клиническим рекомендациям, у каждого взрослого пациента с ССЗ необходимо определять величину СКФ по формуле MDRD. Величина СКФ ниже 60 мл/мин/1,73м2 должна рассматриваться как патологическая. Отношение «альбумин/креатинин мочи» может использоваться для выявления поражения почек у больных ССЗ. Уровень более 30 мг альбумина на 1 г креатинина должен рассматриваться как выходящий за пределы нормальных значений. Всех взрослых больных с ССЗ также необходимо обследовать на отношение «альбумин/креатинин мочи».
«Чем ниже скорость клубочковой фильтрации в популяции больных, тем чаще встречается фибрилляция предсердий. И наоборот, чем чаще фибрилляция предсердий, тем ниже скорость клубочковой фильтрации», – отметил профессор Г.Е. Гендлин. Имеются данные, что чем ниже СКФ, тем больше количество бессимптомных инсультов [10]. Общими факторами риска развития ФП и дисфункции почек являются ожирение, АГ, СД 2 типа, ССЗ, метаболический синдром; общими патогенетическими механизмами – воспаление, оксидативный стресс и активация ренин-ангиотензин-альдостероновой системы (РААС) [11]. Далее профессор Г.Е. Гендлин перешел к изложению результатов исследования, выполненного им в соавторстве с коллегами по кафедре госпитальной терапии № 2 РНИМУ им. Н.И. Пирогова.
Целью указанного исследования было изучение взаимосвязи ФП с функциональным состоянием почек, МА и почечной гемодинамикой у больных с ХСН. В исследование были включены 70 пациентов, из которых у 45 (64%) при 3-кратной регистрации электрокардиограммы (ЭКГ) отмечен синусовый ритм. При этом у 9 из них (13%) имелась пароксизмальная ФП в анамнезе, но последний раз она наблюдалась за 6 и более месяцев до начала исследования. У 25 пациентов (36%) диагностирована постоянная форма ФП. Больные с синусовым ритмом и ФП были сопоставимы по полу, возрасту и величине фракции выброса левого желудочка (ФВ ЛЖ).
СКФ у больных с синусовым ритмом несколько выше, чем у больных с постоянной ФП. Общий объем почечного кровотока у больных с синусовым ритмом также несколько больше, чем у больных с постоянной ФП. В ходе исследования сделан следующий вывод: фибрилляция предсердий при ХСН сопровождается более выраженным снижением СКФ, а также большей вероятностью развития микроальбуминурии, чем синусовый ритм9. Профессор Г.Е. Гендлин напомнил, что согласно клиническим рекомендациям по лечению ФП, выбор терапии зависит от количества баллов, набранных пациентом по шкале CHA2DS2-VASc. При количестве баллов ≥ 2 необходим прием пероральных антикоагулянтов, а при наличии 1 балла допустим прием антиагрегантов или антикоагулянтов (прием антикоагулянтов предпочтителен); при сумме баллов, равной 0, допустимо применение антиагрегантов или отсутствие терапии (последнее предпочтительно).
Среди доступных врачу в настоящее время пероральных антикоагулянтов (ОАК) – ингибиторы тромбина (дабигатран) или ингибиторы фактора Xa (ривароксабан). Другие ингибиторы фактора Xa, в частности апиксабан, эдоксабан, бетриксабан, пока не получили разрешения для использования в клинической практике. Антагонисты фактора Xa метаболизируются с использованием системы цитохрома. В рамках исследования ROCKET AF была оценена эффективность и безопасность редуцированной дозы ривароксабана (15 мг 1 раз в сутки) в сравнении с варфарином как средства предотвращения инсульта в когорте больных с ФП и умеренной почечной недостаточностью (клиренс креатинина (КлКр) 30–49 мл/мин). В исследовании ROCKET AF у 21% больных СКФ составляла 30–49 мл/мин/1,73м2, у 46% – 50–79 мл/мин/1,73м2, и только у 33% – > 80 мл/мин/1,73м2 [12]. Средний возраст больных со сниженной КлКр (3–49 мл/мин) достигал 79 лет; с КлКр 50–79 мл/мин – 71 год. ФП у больных из обеих этих групп, как правило, персистирующая. Больные из группы с КлКр 30–49 мл/мин получали в ходе исследования ROCKET AF низкую дозу ривароксабана – 15 мг.
У больных со сниженной функцией почек, участвовавших в исследовании ROCKET AF, отмечалась высокая частота сопутствующих заболеваний: 89,9–92,1% больных страдали АГ; 61,5–66,0% – ХСН; 31,8–42,6% – СД; 49,1–56,2% имели острое нарушение мозгового кровообращения (ОНМК) / ТИА /системную эмболию в анамнезе. У больных с более высоким КлКр частота сопутствующих заболеваний была ниже. В группе больных с КлКр 30–49 мл/мин оказалось значительно большее количество смертей и инсультов, чем в группе больных с КлКр 50–79 мл/мин. Серьезные кровотечения также чаще наблюдались в группе с более низкой СКФ.
Оценка по основной конечной точке безопасности, за которую была принята частота массивных и немассивных клинически значимых кровотечений, применение ривароксабана в дозе 15 мг 1 раз в сутки у больных с почечной недостаточностью было столь же безопасно, что и во всей популяции исследования. Следует отметить, что у пациентов, получавших ривароксабан, реже наблюдались кровотечения, влияющие на прогноз, – смертельные и кровотечения из жизненно важных органов [13].
Согласно выводам, сделанным профессором Г.Е. Гендлиным, пациенты с ФП, с почечной недостаточностью получают недостаточное антикоагулянтное лечение. Исследование ROCKET AF стало первым, в котором была подобрана доза нового перорального антикоагулянта именно для группы пациентов, страдающих почечной дисфункцией. «И тем не менее показано, что применение Ксарелто® вполне возможно у этих больных, он не хуже варфарина предотвращал развитие инсульта, с меньшим количеством кровотечений, внутричерепных, особенно смертельных, и из жизненно важных органов», – завершил свой доклад профессор Г.Е. Гендлин.
Заключение
Симпозиум показал, что возможности пероральной антикоагулянтной терапии для профилактики инсульта существенно расширяются. Если раньше врачи располагали практически всего одним препаратом (варфарином), то теперь имеется возможность выбора из нескольких препаратов с различным механизмом действия. По крайней мере, один из новых антикоагулянтов – Ксарелто® (ривароксабан) – не уступает варфарину, а в некоторых отношениях и превосходит его. Этот факт установлен в ходе исследований, в которых строго соблюдались принципы доказательной медицины.
Профессор И.И. ЧУКАЕВА, заведующая кафедрой поликлинической терапии № 2 лечебного факультета РНИМУ им. Н.И. Пирогова, д.м.н., обратила внимание на универсальность проблемы тромбоэмболических осложнений в практике современного врача, на их важность как для здоровья, так и для жизни пациентов. Например, ежегодно в мире регистрируется около 25 млн случаев тромбозов глубоких вен. По данным российский ангиологов и ангиохирургов, тромбоз глубоких вен возникает с частотой 160 случаев на 100 тыс. населения в год. Последствиями данного заболевания являются тромбоэмболия легочной артерии (ТЭЛА) и посттромботический (посттромбофлебитический) синдром (хронические боли, трофические язвы). Тромбозы коронарных артерий обусловливают до 95% всех крупноочаговых инфарктов миокарда, 80% инсультов, инфаркты других органов. Внутрисердечный тромбоз (в частности, тромбоз ушка левого предсердия), который выявляется примерно у 30% пациентов с фибрилляцией предсердий (ФП), нередко приводит к ишемическому инсульту. При этом ФП можно считать одним из наиболее частых случаев кардиологической патологии, приводящей к тромбозам.
ФП сопутствует на определенном этапе развития многим сердечно-сосудистым заболеваниям. Риск развития ФП в течение жизни достаточно высок и по достижении 40-летнего возраста составляет 25% как у мужчин, так и у женщин, что превышает, к примеру, риск развития сердечной недостаточности у женщин и мужчин. Являясь результатом развития артериальной гипертонии (АГ) и ишемической болезни сердца (ИБС), ФП выступает независимым фактором риска инсульта, сердечно-сосудистой смерти, сердечной недостаточности (в свою очередь, сердечная недостаточность повышает риск ФП, что ухудшает общий прогноз). При этом пациенты редко жалуются на сердцебиение, а чаще – на одышку при физической нагрузке, утомляемость, боли в грудной клетке, головокружение, внезапное появление чувства тревоги, раздражительность.
ФП может протекать без клинической симптоматики, и нередко первым проявлением заболевания являются осложнения (ТЭЛА, сердечная недостаточность). Для оценки выраженности симптомов, связанных с ФП, разработана классификация EHRA (European Heart Rhythm Association – Европейская ассоциация сердечного ритма): 1-й класс характеризуется отсутствием симптомов; 2-й класс – легкими симптомами (не нарушают нормальной повседневной активности); 3-й класс – выраженными симптомами (изменяют нормальную повседневную активность); 4-й класс – инвалидизирующими симптомами (нормальная повседневная активность невозможна).
Основную опасность для жизни пациента с ФП представляет инсульт, частота которого у пациентов с ФП почти в 5 раз выше, чем у пациентов без нее. С целью предупреждения тромбоэмболических осложнений больным с ФП показана антитромботическая терапия, за исключением больных низкого риска (изолированная ФП у лиц моложе 65 лет) или лиц, имеющих противопоказания. Показания к проведению антитромботической терапии определяются не формой ФП (бессимптомная, пароксизмальная, персистирующая, длительно персистирующая, постоянная), а зависят от наличия, характера и числа факторов риска тромбоэмболических осложнений. Факторы риска оцениваются по шкалам CHADS2 (congestive heart failure, hypertension, age ≥ 75 years, type 2 diabetes, and previous stroke or transient ischemic attack (doubled) – застойная сердечная недостаточность, АГ, возраст ≥ 75 лет, сахарный диабет (СД) 2 типа, предшествующий инсульт или транзиторная ишемическая атака (ТИА) (умножить на два)) или CHA2DS2-VASc (congestive heart failure; hypertension; age ≥ 75 years (doubled); type 2 diabetes; previous stroke, transient ischemic attack, or thromboembolism (doubled); vascular disease; age 65 to 75 years; and sex category – застойная сердечная недостаточность, АГ, возраст ≥ 75 лет (умножить на два), СД 2 типа, предшествующий инсульт, ТИА или тромбоэмболия (умножить на два); сосудистые заболевания; возраст от 65 до 75 лет; пол). При этом рекомендуется учитывать соотношение риска и пользы для каждого пациента. Шкала CHA2DS2-VASc была создана для выявления пациентов, имеющих высокий риск инсульта, несмотря на низкое число баллов в соответствии со шкалой CHADS2. Алгоритм оценки следующий: пациент оценивается по шкале CHADS2, если набрано 2 балла, то пациент получает назначение, если менее 2 баллов – проходит повторную оценку по шкале CHA2DS2-VASc и в этом случае получает назначение также в соответствии с числом набранных баллов (табл. 1).
В случае если число баллов превышает или равно 2, рекомендуется прием пероральных антикоагулянтов; если обнаружен один клинически значимый фактор риска (1 балл), то возможными вариантами терапии являются прием пероральных антикоагулянтов, что предпочтительно, или низкие дозы аспирина. Возможен также отказ от антитромботической терапии, если факторов риска нет (0 баллов), но допустим прием низких доз аспирина, отсутствие терапии предпочтительнее. Прием антикоагулянтов рекомендован при всех формах ФП (пароксизмальной, персистирующей, длительно персистирующей, постоянной), кроме бессимптомной.
История применения антикоагулянтов непрямого действия насчитывает более полувека, медицинское использование варфарина было начато в 1954 г. Их эффективность для профилактики кардиоэмболического инсульта подтверждена клиническими исследованиями. По данным исследования ACTIVE W (Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events – Исследование клопидогрела с ирбесартаном при фибрилляции предсердий; открытое подысследование с целью сравнения комбинации аспирина и клопидогрела и пероральных антикоагулянтов), проводившиеся в течение 1,5 лет наблюдения показали, что при ФП пероральные антикоагулянты эффективнее предотвращают инсульт, чем комбинация антиагрегантов «клопидогрел + аспирин» [1].
Однако терапия варфарином имеет ряд ограничений: непредсказуемый антикоагулянтный ответ; узкое терапевтическое окно; медленное развитие/окончание эффекта; взаимодействие со многими лекарственными средствами и пищевыми продуктами; возможность резистентности к варфарину – и, как следствие перечисленных свойств, связана с необходимостью проведения постоянного контроля антикоагулянтного эффекта и частой коррекции дозы для поддержания эффективности и безопасности лечения. К недостаточному применению антикоагулянтов приводят переоценка существующего у пациентов риска развития кровотечения (например у пациентов пожилого возраста, имеющих серьезные кровотечения в анамнезе), то есть боязнь геморрагических осложнений, а также ожидаемая плохая приверженность лечению, то есть когда по субъективному мнению врача ожидаемые риски превосходят ожидаемую пользу.
Причиной такой избыточной боязни осложнений является частота, с которой они наблюдаются на фоне применения варфарина; с этим препаратом, по данным Управления по контролю качества пищевых продуктов и лекарственных препаратов США (Food and Drug Administration – FDA), связывают 13% от всех сообщаемых побочных эффектов лекарств. Большинство из этих сообщаемых случаев – кровотечения различной локализации, в том числе внутричерепные (геморрагические инсульты и другие внутричерепные кровоизлияния), а также смертельные кровотечения. Следует отметить, что большая часть факторов риска инсульта и кровотечения при лечении антикоагулянтами совпадает: пожилой возраст, АГ, в анамнезе инфаркт миокарда или ИБС, наличие цереброваскулярных заболеваний. Факторами риска кровотечений при антикоагулянтной терапии служат анемия, кровотечения в анамнезе, почечная недостаточность, сопутствующее лечение антиагрегантами.
Опрос, проведенный среди российских врачей, показал, что 60% сотрудников стационаров, 50% – специализированных поликлиник и 30% – районных поликлиник полагают, что более 10 человек из числа их пациентов нуждаются в приеме варфарина. Наиболее распространенными причинами отмены варфарина врачами являются сложности, вызванные потребностью в частом контроле международного нормализованного соотношения (МНО), побочные эффекты и нежелательные явления, когнитивные нарушения, а также назначение лекарств, несовместимых с варфарином.
Эффект варфарина ослабляют многие широко распространенные лекарственные средства. В этот список входят популярные антибиотики, препараты для снижения холестерина, оральные контрацептивы, противоязвенные препараты, витамины K и C, коэнзим Q10, парацетамол, барбитураты, вальпроевая кислота, препараты, содержащие компоненты растительного происхождения – женьшень и зверобой. Пища, богатая витамином K, также снижает эффективность варфарина. Частота назначений антикоагулянтов нередко не соответствует потребностям пациента, его индивидуальной степени риска инсульта. Назначение антикоагулянтов пациенту, который в них не нуждается, ведет к повышению риска осложнений (кровотечений). Неназначение антикоагулянтов нуждающемуся в них пациенту означает, что пациент оставлен наедине с риском потенциально смертельного осложнения – инсульта.
В настоящее время в распоряжении врача есть новые антикоагулянты, как пероральные (ривароксабан, апиксабан, эдоксабан, бетриксабан, дабигатран), так и парентеральные (низкомолекулярный гепарин, нефракционированный гепарин). Новые пероральные антикоагулянты имеют предсказуемую фармакодинамику, сравнительно небольшое количество взаимодействий с другими лекарственными средствами и пищевыми продуктами, более широкий по сравнению с варфарином терапевтический диапазон, при этом необходимости в проведении рутинного контроля коагуляции не возникает. Препараты не требуют индивидуального подбора, то есть используются в фиксированных дозах. Важным преимуществом новых антикоагулянтов является лучшее соотношение риска и ожидаемой пользы.
Первым представителем пероральных антикоагулянтов – прямых ингибиторов фактора X – является препарат Ксарелто® (ривароксабан). Он обладает высоким сродством к ключевому звену коагуляционного каскада – активированному фактору X. Ксарелто блокирует синтез нового тромбина, регулирует его образование за счет прямого воздействия на фактор X, не влияя при этом на пул, уже имеющийся в кровотоке и тканях тромбина. Таким образом, ривароксабан эффективно предотвращает образование тромбов, не затрагивая антикоагулянтные, репаративные и противовоспалительные функции тромбина. В отличие от непрямых ингибиторов фактора Xа, Ксарелто® блокирует как свободный, так и связанный в тромбе фактор Xа.
Как отметила в заключение профессор И.И. Чукаева, профилактика инсульта и системных тромбоэмболий является краеугольным камнем в лечении больных с ФП, и стратегия антикоагулянтной терапии должна избираться одновременно с антиаритмической. Новые пероральные антикоагулянты, в частности Ксарелто® (ривароксабан), открывают новые возможности в профилактике инсульта и системных тромбоэмболий у больных ФП неклапанного генеза.
Доказательная медицина для профилактики инсульта. Исследование ROCKET AF
Инсульт является важной проблемой здравоохранения, подчеркнула д.м.н., профессор кафедры терапии факультета усовершенствования врачей МОНИКИ им. М.Ф. Владимирского Н.П. САНИНА, ведь это заболевание приводит к высокой инвалидизации, высокой смертности и, как следствие, к потерям для пациента и его семьи, а также является тяжелой нагрузкой для системы здравоохранения. Последствия инсульта всем хорошо известны, и их перечисление звучит угрожающе: параличи, речевые и когнитивные расстройства, снижение памяти, нарушения в когнитивной и эмоциональной сферах. В таких странах, как Япония и США, риск инсульта и смертность от него удалось заметно снизить благодаря широкому применению антикоагулянтной терапии, но в России, подчеркнула профессор Н.П. Санина, адекватное лечение назначается только 26% пациентов из тех, кому показана такая терапия. Цифры по регионам могут различаться, например, в Московской области только 16% пациентов с ФП, перенесших инсульт, получают антикоагулянты.
ФП является сильным независимым фактором риска инсульта. Как показало Фрамингемское исследование, ФП повышает риск инсульта в 4,8 раза [2]. Кроме того, как показало итальянское популяционное исследование [3] и испанское ретроспективное исследование [4], ФП увеличивает риск повторного инсульта. Риск инсульта, согласно рекомендациям, оценивают по шкале CHADS2, где (C) – хроническая сердечная недостаточность (1 балл); (H) – АГ (1 балл); (A) – возраст ≥ 75 лет (1 балл); (D) – СД (1 балл); (S) – инсульт или ТИА (2 балла). Сумма баллов может быть от 0 до 6. В клинических исследованиях доказано наличие корреляции между частотой инсульта у пациентов без антитромботической терапии с числом баллов при расчете на 100 пациенто-лет. Так, при 6 баллах эта частота составляет 18,2, а при 0 баллов – 1,9 (примерно в 10 раз меньше).
Как уже было сказано, стратегия лечения больных с ФП наравне с выбором одного из двух вариантов борьбы с аритмией (контроль частоты сердечных сокращений (ЧСС) или контроль ритма) предполагает и антикоагулянтную терапию, направленную на профилактику инсульта. По словам профессора Н.П. Саниной, врачи не любят использовать варфарин, наиболее часто назначаемый в России оральный антикоагулянт, из-за сложностей его применения [5]. Требуется регулярный контроль МНО и коррекция дозы, что затруднительно у пожилых пациентов или пациентов с массивной сопутствующей терапией. Любое отклонение от терапевтического интервала МНО чревато осложнениями или недостаточностью профилактического эффекта. Поэтому понятна потребность врача в принципиально новых препаратах, максимально приближающихся к «идеальному» антикоагулянту.
В настоящее время разработаны новые антикоагулянты, которые представлены прямыми антикоагулянтами, блокирующими один фактор (IIа или Xа). Это ривароксабан, апиксабан, эдоксабан, бетриксабан, ксимелогатран, дабигатран, AZD 0837. Кроме того, существуют непрямые блокаторы фактора Xа, например фондапаринукс. «Идеальный» антикоагулянт должен обладать эффективностью, доказанной в ходе рандомизированных клинических исследований; предсказуемым дозозависимым эффектом; широким терапевтическим окном; быстрым началом и четко ограниченным окончанием действия; не иметь взаимодействий с другими лекарственными средствами и пищевыми продуктами; иметь пероральный прием, фиксированную дозу, антидот, одну точку приложения в коагуляционном каскаде, оказывая при этом влияние как на свободный, так и на связанный в тромбе фактор свертывания крови [6].
Свойства ривароксабана таковы, что его можно рассматривать как препарат, максимально близкий к идеальному антикоагулянту. Абсолютная биодоступность при приеме дозы 10 мг – 80–100%; при приеме дозы 20 мг – 60% и повышается до 80% при приеме с пищей, максимальная концентрация в плазме достигается через 2–4 часа; связывание с белками плазмы – 92–95%; 1/3 препарата выводится из организма в неизмененном виде через почки; 2/3 препарата метаболизируется в печени в неактивные вещества; средний период полувыведения составляет 5–7 часов у здоровых добровольцев и 11–13 часов у пациентов, ривароксабан не имеет взаимодействий с пищевыми продуктами и ограниченный потенциал взаимодействия с другими лекарственными средствами, сочетается с антибиотиками, статинами, антиаритмиками, гипотензивными, ферментативными, нестероидными противовоспалительными препаратами, противоязвенными, антидепрессантами и другими лекарственными средствами. Ривароксабан эффективно ингибирует как свободный, так и связанный в тромбе фактор Xа. Ксарелто® обладает широким терапевтическим коридором, не требуя контроля параметров коагуляции, не влияет на тромбоцитарное звено гемостаза, не вызывая аутоиммунной стимуляции тромбоцитов и требуя контроля за их числом. Препарат предназначен для приема в фиксированной дозе внутрь один раз в день.
В последние годы был проведен целый ряд крупных клинических исследований новых антикоагулянтов. В их числе – рандомизированное двойное слепое с двойным плацебоконтролем исследование ROCKET AF (Rivaroxaban Once daily oral direct Factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation – Прямое ингибирование фактора Xa при пероральном приеме ривароксабана один раз в сутки по сравнению с антагонистами витамина K для профилактики инсульта и эмболии при фибрилляции предсердий), в котором испытывали ривароксабан в дозе 20 мг в сутки (15 мг в сутки для пациентов со сниженной функцией почек) и сравнивали с варфарином. В исследование были включены больные с неклапанной ФП и инсультом/ТИА или системной эмболией вне центральной нервной системы (ЦНС) в анамнезе либо как минимум с двумя из следующих факторов риска: сердечная недостаточность, АГ, возраст ≥ 75 лет, СД.
На протяжении исследования, управляемого по событиям (то есть для оценки основных параметров эффективности и безопасности требовалось определенное, заранее рассчитанное число событий), сравнивали частоту событий – инсульта и внецеребральной эмболии – у пациентов, слепо рандомизированных в группы ривароксабана или варфарина, что контролировалось двойным ослеплением. В группе варфарина частота событий составила 2,16 на 100 пациенто-лет, в группе ривароксабана – 1,71. Число случаев достижения первичной конечной точки, за которую была принята комбинация инсульта/ТИА и системной тромбоэмболии вне пределов ЦНС, в группе ривароксабана составляло 184 (7061 пациент в группе рандомизации), в группе варфарина – 221 (7082 пациента в лечебной группе). При оценке популяции всех рандомизированных пациентов ривароксабан оказался столь же эффективен, что и варфарин (p < 0,001 для гипотезы не меньшей эффективности). В группе пациентов, строго соблюдавших предписанный режим лечения, ривароксабан способен дополнительно снижать относительный риск инсульта на 21% по сравнению с варфарином [7].
Общие показатели безопасности ривароксабана и варфарина оказались сходными (частота событий первичной конечной точки безопасности составила 14,91 в группе ривароксабана и 14,52 в группе варфарина, р = 0,442). Однако ривароксабан статистически достоверно реже вызывал смертельные кровотечения (почти в два раза реже), а также кровотечения из жизненно важных органов и внутричерепные кровоизлияния. Примечательно, что в исследовании не выявлено увеличения числа инфарктов миокарда (ИМ), хотя около 17% участвовавших – пациенты с перенесенным ИМ. Согласно выводам, сделанным профессором Н.П. Саниной, ривароксабан может считаться серьезной альтернативой варфарину как средство профилактики инсульта у пациентов с ФП.
Антикоагулянтная терапия у сложных категорий пациентов
Термин «кардиоренальный синдром» первоначально был введен для обозначения снижения функции почек при тяжелой хронической сердечной недостаточности (ХСН). В настоящее время общепризнанным считается существование связи между сердечно-сосудистыми заболеваниями (ССЗ), сниженной функцией почек и смертностью, подчеркнул профессор кафедры госпитальной терапии № 2 РНИМУ им. Н.И. Пирогова, д.м.н. Г.Е. ГЕНДЛИН. Эта связь выявляется независимо от того, что первично: болезнь сердца или почек. Современная медицина выделяет 5 типов кардиоренального синдрома (КРС):
- I тип – острый КРС;
- II тип – хронический КРС;
- III тип – острый ренокардиальный синдром;
- IV тип – хронический ренокардиальный синдром;
- V тип – вторичный КРС (при системных заболеваниях, поражающих сердце и почки, – СД, сепсисе, амилоидозе и т.д.).
- повышение уровня креатинина сыворотки крови;
- сниженная скорость клубочковой фильтрации (СКФ), определяемая по формуле Кокрофта – Голта (Cockcroft-Gault) или по формуле из исследования MDRD (Modification of Diet in Renal Disease – Изменение диеты при заболеваниях почек);
- микроальбуминурия;
- макроальбуминурия (протеинурия).
Из числа больных с ХСН 29,8% имеют показатели СКФ 30–59 мл/мин [9]. Мягкая почечная недостаточность – сильный прогностический фактор повышения сердечно-сосудистой и общей смертности. Выживаемость больных с ХСН в значительной степени зависит от уровня МА. Согласно существующим клиническим рекомендациям, у каждого взрослого пациента с ССЗ необходимо определять величину СКФ по формуле MDRD. Величина СКФ ниже 60 мл/мин/1,73м2 должна рассматриваться как патологическая. Отношение «альбумин/креатинин мочи» может использоваться для выявления поражения почек у больных ССЗ. Уровень более 30 мг альбумина на 1 г креатинина должен рассматриваться как выходящий за пределы нормальных значений. Всех взрослых больных с ССЗ также необходимо обследовать на отношение «альбумин/креатинин мочи».
«Чем ниже скорость клубочковой фильтрации в популяции больных, тем чаще встречается фибрилляция предсердий. И наоборот, чем чаще фибрилляция предсердий, тем ниже скорость клубочковой фильтрации», – отметил профессор Г.Е. Гендлин. Имеются данные, что чем ниже СКФ, тем больше количество бессимптомных инсультов [10]. Общими факторами риска развития ФП и дисфункции почек являются ожирение, АГ, СД 2 типа, ССЗ, метаболический синдром; общими патогенетическими механизмами – воспаление, оксидативный стресс и активация ренин-ангиотензин-альдостероновой системы (РААС) [11]. Далее профессор Г.Е. Гендлин перешел к изложению результатов исследования, выполненного им в соавторстве с коллегами по кафедре госпитальной терапии № 2 РНИМУ им. Н.И. Пирогова.
Целью указанного исследования было изучение взаимосвязи ФП с функциональным состоянием почек, МА и почечной гемодинамикой у больных с ХСН. В исследование были включены 70 пациентов, из которых у 45 (64%) при 3-кратной регистрации электрокардиограммы (ЭКГ) отмечен синусовый ритм. При этом у 9 из них (13%) имелась пароксизмальная ФП в анамнезе, но последний раз она наблюдалась за 6 и более месяцев до начала исследования. У 25 пациентов (36%) диагностирована постоянная форма ФП. Больные с синусовым ритмом и ФП были сопоставимы по полу, возрасту и величине фракции выброса левого желудочка (ФВ ЛЖ).
СКФ у больных с синусовым ритмом несколько выше, чем у больных с постоянной ФП. Общий объем почечного кровотока у больных с синусовым ритмом также несколько больше, чем у больных с постоянной ФП. В ходе исследования сделан следующий вывод: фибрилляция предсердий при ХСН сопровождается более выраженным снижением СКФ, а также большей вероятностью развития микроальбуминурии, чем синусовый ритм9. Профессор Г.Е. Гендлин напомнил, что согласно клиническим рекомендациям по лечению ФП, выбор терапии зависит от количества баллов, набранных пациентом по шкале CHA2DS2-VASc. При количестве баллов ≥ 2 необходим прием пероральных антикоагулянтов, а при наличии 1 балла допустим прием антиагрегантов или антикоагулянтов (прием антикоагулянтов предпочтителен); при сумме баллов, равной 0, допустимо применение антиагрегантов или отсутствие терапии (последнее предпочтительно).
Среди доступных врачу в настоящее время пероральных антикоагулянтов (ОАК) – ингибиторы тромбина (дабигатран) или ингибиторы фактора Xa (ривароксабан). Другие ингибиторы фактора Xa, в частности апиксабан, эдоксабан, бетриксабан, пока не получили разрешения для использования в клинической практике. Антагонисты фактора Xa метаболизируются с использованием системы цитохрома. В рамках исследования ROCKET AF была оценена эффективность и безопасность редуцированной дозы ривароксабана (15 мг 1 раз в сутки) в сравнении с варфарином как средства предотвращения инсульта в когорте больных с ФП и умеренной почечной недостаточностью (клиренс креатинина (КлКр) 30–49 мл/мин). В исследовании ROCKET AF у 21% больных СКФ составляла 30–49 мл/мин/1,73м2, у 46% – 50–79 мл/мин/1,73м2, и только у 33% – > 80 мл/мин/1,73м2 [12]. Средний возраст больных со сниженной КлКр (3–49 мл/мин) достигал 79 лет; с КлКр 50–79 мл/мин – 71 год. ФП у больных из обеих этих групп, как правило, персистирующая. Больные из группы с КлКр 30–49 мл/мин получали в ходе исследования ROCKET AF низкую дозу ривароксабана – 15 мг.
У больных со сниженной функцией почек, участвовавших в исследовании ROCKET AF, отмечалась высокая частота сопутствующих заболеваний: 89,9–92,1% больных страдали АГ; 61,5–66,0% – ХСН; 31,8–42,6% – СД; 49,1–56,2% имели острое нарушение мозгового кровообращения (ОНМК) / ТИА /системную эмболию в анамнезе. У больных с более высоким КлКр частота сопутствующих заболеваний была ниже. В группе больных с КлКр 30–49 мл/мин оказалось значительно большее количество смертей и инсультов, чем в группе больных с КлКр 50–79 мл/мин. Серьезные кровотечения также чаще наблюдались в группе с более низкой СКФ.
Оценка по основной конечной точке безопасности, за которую была принята частота массивных и немассивных клинически значимых кровотечений, применение ривароксабана в дозе 15 мг 1 раз в сутки у больных с почечной недостаточностью было столь же безопасно, что и во всей популяции исследования. Следует отметить, что у пациентов, получавших ривароксабан, реже наблюдались кровотечения, влияющие на прогноз, – смертельные и кровотечения из жизненно важных органов [13].
Согласно выводам, сделанным профессором Г.Е. Гендлиным, пациенты с ФП, с почечной недостаточностью получают недостаточное антикоагулянтное лечение. Исследование ROCKET AF стало первым, в котором была подобрана доза нового перорального антикоагулянта именно для группы пациентов, страдающих почечной дисфункцией. «И тем не менее показано, что применение Ксарелто® вполне возможно у этих больных, он не хуже варфарина предотвращал развитие инсульта, с меньшим количеством кровотечений, внутричерепных, особенно смертельных, и из жизненно важных органов», – завершил свой доклад профессор Г.Е. Гендлин.
Заключение
Симпозиум показал, что возможности пероральной антикоагулянтной терапии для профилактики инсульта существенно расширяются. Если раньше врачи располагали практически всего одним препаратом (варфарином), то теперь имеется возможность выбора из нескольких препаратов с различным механизмом действия. По крайней мере, один из новых антикоагулянтов – Ксарелто® (ривароксабан) – не уступает варфарину, а в некоторых отношениях и превосходит его. Этот факт установлен в ходе исследований, в которых строго соблюдались принципы доказательной медицины.
1. Connolly S., Pogue J., Hart R., Pfeffer M., Hohnloser S., Chrolavicius S., Pfeffer M., Hohnloser S., Yusuf S. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial // Lancet. 2006. Vol. 367. № 9526. P. 1903–1912.
2. Wolf P.A., Abbott R.D., Kannel W.B. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study // Stroke. 1991. Vol. 22. № 8. P. 983–988.
3. Marini C., De Santis F., Sacco S., Russo T., Olivieri L., Totaro R., Carolei A. Contribution of atrial fibrillation to incidence and outcome of ischemic stroke: results from a population-based study // Stroke. 2005. Vol. 36. № 6. P. 1115–1119.
4. Penado S., Cano M., Acha O., Hernández J.L., Riancho J.A. Atrial fibrillation as a risk factor for stroke recurrence // Am. J. Med. 2003. Vol. 114. № 3. P. 206–210.
5. Fuster V., Rydén L.E., Cannom D.S. ACC/AHA/ESC 2006 Guidelines for the Management of Patients with Atrial Fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients With Atrial Fibrillation): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society // Circulation. 2006. Vol. 114. № 7. P. e257– e354.
6. Piccini J.P., Patel M.R., Mahaffey K.W., Fox K.A., Califf R.M. Rivaroxaban, an oral direct factor Xa inhibitor // Expert Opin. Investig. Drugs. 2008. Vol. 17. № 6. P. 925–937.
7. Patel M.R., Mahaffey K.W., Garg J., Pan G., Singer D.E., Hacke W., Breithardt G., Halperin J.L., Hankey G.J., Piccini J.P., Becker R.C., Nessel C.C., Paolini J.F., Berkowitz S.D., Fox K.A., Califf R.M. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation // N. Engl. J. Med. 2011. Vol. 365. № 10. P. 883– 891.
8. London G.M., Marchais S.J., Metivier F., Guerin A.P. Cardiovascular risk in end-stage renal disease: vascular aspects // Nephrol. Dial. Transplant. 2000. Vol. 15. Suppl. 5. P. 97–104.
9. Гендлин Г.Е., Резник Е.В., Сторожаков Г.И., Мелехов А.В., Ускова О.В., Федоровская Т.В. Взаимосвязь фибрилляции предсердий и дисфункции почек у больных с хронической сердечной недостаточностью // Нефрология и диализ. 2010. Т. 12. № 4.
10. Kobayashi M., Hirawa N., Yatsu K., Kobayashi Y., Yamamoto Y., Saka S., Andoh D., Toya Y., Yasuda G., Umemura S. Relationship between silent brain infarction and chronic kidney disease // Nephrol. Dial. Transplant. 2009. Vol. 24. № 1. P. 201–207.
11. Watanabe H., Watanabe T., Sasaki S., Nagai K., Roden D.M., Aizawa Y. Close bidirectional relationship between chronic kidney disease and atrial fibrillation: the Niigata preventive medicine study // Am. Heart J. 2009. Vol. 158. № 4. P. 629–636.
12. Hacke W., Caplan L. Challenges for cerebrovascular disease // Front. Neurol. 2010. Vol. 1. P. 3.
13. Hohnloser S.H., Connolly S.J. Atrial fibrillation, moderate chronic kidney disease, and stroke prevention: new anticoagulants, new hope // Eur. Heart J. 2011. Vol. 32. № 19. P. 2347–2349.
Новости на тему
13.02.2025
14.05.2024
05.02.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Возраст наступления инсульта – это показатель уровня развития здравоохранения в той или иной стране, отметила профессор И.И. Чукаева, заведующая кафедрой поликлинической терапии № 2 лечебного факультета РНИМУ им. Н.И. Пирогова, д.м.н., открывая сателлитный симпозиум компании «Байер», который прошел 15 июня 2012 г. в рамках Московского международного форума кардиологов. Среди вопросов, затронутых докладчиками, особое внимание было уделено роли фибрилляции предсердий как фактора риска инсульта и необходимости профилактической антикоагулянтной терапии у таких пациентов.
На протяжении многих лет в распоряжении врачей был варфарин, показавший себя эффективным антикоагулянтом. Однако, как было отмечено, варфарин обладает рядом недостатков: узкое терапевтическое окно, непредсказуемый антикоагулянтный эффект, множество взаимодействий с лекарствами и пищевыми продуктами. Все это требует регулярного лабораторного контроля показателей крови для подтверждения эффективности и безопасности проводимого лечения и ограничивает применение варфарина, получившего широкое распространение во врачебной практике. Неудовлетворенность врачей существующими лекарственными средствами привела к созданию и разработке новых перспективных препаратов, в частности Ксарелто® (ривароксабан).
Сравнение ривароксабана с варфарином в ходе клинического испытания показало, что новый препарат не уступает стандарту лечения, а у пациентов, строго соблюдающих предписанный режим лечения, даже способен более эффективно снижать риск инсульта, чем варфарин. Кроме того, при одинаковых суммарных показателях безопасности ривароксабан продемонстрировал меньшее число фатальных и тяжелых кровотечений, включая внутричерепные кровоизлияния и геморрагический инсульт. Было отмечено, что Ксарелто® (ривароксабан) показал такую же эффективность и безопасность у пациентов, имеющих сниженную функцию почек, нуждающихся в одновременном приеме низких доз антиагрегантов или уже перенесших инсульт или транзиторную ишемическую атаку, как и во всей популяции исследования.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
