Мультидисциплинарный подход к лечению и реабилитации инсульта. 13-я ежегодная конференция «Вейновские чтения». Сателлитный симпозиум компании «Такеда»
- Аннотация
- Статья
- Ссылки



Современные принципы лечения ишемического инсульта
Из всех органов наиболее чувствителен к ишемии головной мозг. Заведующий кафедрой неврологии с курсом нейрохирургии Института усовершенствования врачей Национального медико-хирургического центра им. Н.И. Пирогова, д.м.н. Олег Иванович ВИНОГРАДОВ напомнил, что оптимальный объем мозгового кровотока составляет 500 мл на 100 г/мин. При снижении мозгового кровотока до 20% от нормальной величины (> 10 мл/100 г/мин) происходит необратимое поражение клеток. Мозговая ткань погибает уже через пять минут, образуя зону некроза. Вокруг зоны некроза формируется зона ишемической полутени, или пенумбра (скорость кровотока > 20 мл/100 г/мин), в которой клетки сохраняют структурную целостность, но не функционируют. Если поражения в зоне некроза необратимы, то нейроны в зоне ишемической полутени в первые шесть часов с момента катастрофы можно спасти. Именно на это направлены терапевтические мероприятия в период острого инсульта.
На современном этапе лечение ишемического инсульта включает в себя пять направлений: неспецифическую терапию, специфическое лечение (реканализацию, нейропротекцию), профилактику и лечение осложнений (неврологических, терапевтических), раннюю вторичную профилактику инсульта и раннюю реабилитацию.
Цель базисной, или неспецифической, терапии инсульта – стабилизировать витальные функции и оптимизировать гемостаз путем:
- обеспечения адекватной респираторной функции;
- лечения кардиальной патологии;
- коррекции артериального давления;
- коррекции водно-электролитного баланса;
- обеспечения нутритивной поддержки;
- стабилизации уровня глюкозы в крови;
- нормализации температуры тела.
Специфическое лечение предусматривает реканализацию мозговых артерий с помощью медикаментозной реперфузии (системного или селективного тромболизиса) либо механического удаления тромба методом тромбо- или эмболоэкстракции.
Результаты исследований по успешному применению системного тромболизиса в виде постоянных инфузий в течение 60 минут в период трехчасового терапевтического окна изменили подходы к лечению острого инсульта, что нашло отражение в международных клинических рекомендациях.
Европейская организация по борьбе с инсультом (European Stroke Organisation) в 2009 г. рекомендовала проводить системный внутривенный тромболизис (с помощью rt-PA в дозе 0,9 мг/кг (максимум 90 мг) 10% – болюсно, 90% – в виде постоянной инфузии в течение 60 минут) пациентам с ишемическим инсультом в пределах трехчасового терапевтического окна (класс I, уровень доказательности А).
Однако на практике по такой схеме внутривенный тромболизис получали небольшое количество больных острым ишемическим инсультом. Метаанализ трех исследований (ECASS-I, ECASS-II, ATLANTIS) продемонстрировал, что вероятность потенциального эффекта от тромболитической терапии сохраняется в течение 4,5 часа1. Этот вывод нашел подтверждение в исследовании ECASS-III. Было установлено, что системный тромболизис эффективен в первые 4,5 часа от развития инсульта при сопоставимом с плацебо профиле безопасности2. Полученные результаты дали основание расширить показания для проведения тромболизиса. Так, в 2013 г. Американская ассоциация по борьбе с инсультом (American Stroke Association) уже рекомендовала проводить системную тромболитическую терапию больным ишемическим инсультом в период до 4,5 часа от начала развития заболевания.
О.И. Виноградов привел клинический случай, подтверждающий эффективность проведения своевременного системного тромболизиса. Пациентка С., 67 лет. 4 июня 2006 г. в 13.30 у нее остро развились расстройство речи и правосторонний гемипарез. В 15.50 она поступила в приемное отделение Национального медико-хирургического центра им. Н.И. Пирогова. Компьютерная томография головного мозга позволила исключить геморрагический инсульт. В 16.25 пациентке начали проводить системный тромболизис: в течение одной минуты было введено 7,5 мг rt-PA в/в болюсно, затем в течение 60 минут – 67,5 мг rt-PA. В 16.40 появились движения в ноге и купировался сенсорный элемент афазии. В 17.05 появились движения в руке и вербальная продукция, парез в ноге – 4 балла. В 17.25 полностью восстановилась сила в правой ноге, парез в руке – 3 балла, сохранялась невыраженная моторная афазия, сумма баллов по шкале тяжести инсульта Национального института здоровья CША (National Institutes of Health Stroke Scale – NIHSS) снизилась с 11 до 6. Спустя 24 часа была выполнена компьютерная томография головного мозга: геморрагическая трансформация свидетельствовала о реканализации окклюзированной левой средней мозговой артерии. Магнитно-резонансная ангиография артерий виллизиева круга подтвердила восстановление кровотока по левой средней мозговой артерии.
Внутриартериальный тромболизис показан пациентам с ишемическим инсультом вследствие окклюзии средней мозговой артерии, которые имеют выраженный неврологический дефицит и находятся в шестичасовом терапевтическом окне. К преимуществам внутриартериального тромболизиса можно отнести использование меньших доз тромболитиков, доставку тромболитика непосредственно к месту окклюзии и более высокую частоту реканализации по сравнению с внутривенным тромболизисом.
Докладчик привел пример успешного применения селективного тромболизиса.
Пациент Ж., 53 года. 22 января 2009 г. в 11.20 остро развились расстройство речи и правосторонний гемипарез. Спустя 4 часа 20 минут пациент был доставлен в приемный покой. Дуплексное сканирование брахиоцефальных артерий продемонстрировало стеноз левой внутренней артерии 80%. Поскольку время для проведения системного тромболизиса было упущено, пациенту назначили селективный тромболизис. С помощью ангиографии определили место расположения тромба и осуществили реканализацию адгезированной артерии.
Одним из новых методов лечения пациентов с ишемическим инсультом является тромбэкстракция, когда эндоваскулярная терапия осуществляется при помощи стента-ретривера. Она предназначена для больных ишемическим инсультом без грубых нарушений сознания, но с довольно тяжелым двигательным дефицитом. Тромбэкстракция, как и тромболизис, оцениваются международным экспертным сообществом как наиболее эффективные.
О.И. Виноградов проиллюстрировал этот тезис клиническим примером. Пациент Д., 48 лет. 20 октября 2015 г. у пациента развились сенсомоторная афазия, правосторонний гемипарез и гемигипестезия. Через 3 часа 20 минут он был доставлен в Национальный медико-хирургический центр им. Н.И. Пирогова. Из анамнеза: в марте 2015 г. перенес ишемический инсульт в бассейне левой средней мозговой артерии (с полным восстановлением), была верифицирована постоянная форма фибрилляции предсердий, рекомендован прием новых оральных антикоагулянтов, которые пациент принимал нерегулярно, а потом одномоментно принял несколько таблеток. Биохимический анализ крови показал высокий уровень креатинина – 114 мкмоль/л. Показатели коагулограммы также были неблагоприятными: международное нормализованное отношение – 4,02, протромбиновое время – 47,2, протромбиновый индекс – 12,2. Такому пациенту проведение тромболитической терапии противопоказано. Ангиография головного мозга продемонстрировала окклюзию средней мозговой артерии. Больному провели тромбэкстракцию – с помощью стента Solitaire удалили тромб из мозговой артерии. В результате была достигнута реканализация средней мозговой артерии.
Далее О.И. Виноградов рассмотрел возможности нейропротекции в лечении ишемического инсульта. Нейропротекция включает в себя фармакологические и немедикаментозные воздействия с целью повышения жизнеспособности нейронов в неблагоприятных условиях. Опираясь на результаты исследований, докладчик проанализировал эффективность ряда нейропротективных лекарственных средств – цитиколина, блокаторов кальциевого канала, антагонистов глутамата, антиоксидантов – в плане улучшения исходов болезни.
Исследование INWEST продемонстрировало, что раннее назначение нимодипина приводит к худшим исходам инсульта, что, предположительно, связано с антигипертензивным эффектом препарата3.
Данные рандомизированного контролируемого исследования по оценке эффективности блокатора NMDA-рецепторов показали, что функциональное состояние пациентов в группе, получавшей терапию магнезией в 12-часовом терапевтическом окне, было сопоставимо с состоянием пациентов в группе плацебо, однако смертность в группе лечения была выше4.
Не улучшает исход инсульта терапия антагонистами глицина – систематический обзор исследований, посвященных использованию антагонистов глутамата у больных инсультом, не обнаружил увеличения благоприятных исходов после лечения и снижения уровня смертности5.
Антиоксиданты улучшали функциональное состояние у пациентов с ишемическим инсультом в первый месяц, однако результаты нивелировались к исходу третьего месяца (р > 0,05)6.
Согласно исследованию CASTA, в котором оценивалась эффективность Церебролизина в сравнении с плацебо, статистически значимые различия между исследуемыми группами отсутствовали7. По мнению лектора, причины провала исследования заключались в выборе неадекватного терапевтического окна, отсутствии целенаправленного отбора пациентов, использовании заведомо недостаточных дозировок препарата и т.д.
Одним из эффективных нейропротекторов считается цитиколин (Цераксон®). Цитиколин – это донатор холина в процессе синтеза ацетилхолина и незаменимый метаболит в биосинтезе фосфолипидов – основных компонентов клеточных мембран. Результаты исследования динамики объема инфаркта головного мозга на фоне применения препарата Цераксон® показали значимое снижение прироста объема очага инфаркта по сравнению с плацебо8. Полное восстановление в группе терапии препаратом Цераксон® 2000 мг/сут в течение трех месяцев наблюдалось достоверно (р = 0,0043) чаще в сравнении с группой плацебо (27,9 против 20,2%). Следует подчеркнуть, что частота неблагоприятных исходов была существенно меньше в группе лечения, чем в группе плацебо (54,6 против 64,7%).
Эффективность цитиколина (препарата Цераксон®) изучалась в исследовании ICTUS, в которое были включены пациенты и с тромболитической терапией в анамнезе, и без нее. Наибольшая эффективность цитиколина отмечалась у пациентов старшей возрастной группы со среднетяжелым инсультом, которым ранее не проводился тромболизис9.
Обновленный метаанализ 2016 г. продемонстрировал, что назначение препарата Цераксон® пациентам после инсульта ассоциируется с более достоверным достижением благоприятного исхода заболевания. Это преимущество наиболее выражено в группе ранее не получавших тромболитическую терапию пациентов, которым препарат назначался в течение первых 24 часов после инсульта10.
Реабилитационный потенциал у больных с инсультом. Оценка, сохранение, расширение
Доцент кафедры неврологии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, к.м.н. Александр Николаевич КОМАРОВ напомнил, что медико-социальная реабилитация – комплексный процесс. Его цель – свести к минимуму функциональные последствия поражения центральной нервной системы и негативное влияние заболевания на жизнь больного и ухаживающих за ним лиц, помочь больному стать более самостоятельным.
С учетом современных запросов в медико-социальной реабилитации (эффективность, применение современных незатратных приемов, а также ограниченность во времени и финансовых ресурсов) хорошо зарекомендовал себя мультидисциплинарный подход. Он предусматривает участие не только невролога, но и врача по лечебной физкультуре, терапевта, психотерапевта, психолога, инструктора по труду, травматолога-ортопеда, уролога, хирурга, физиотерапевта.
По мнению докладчика, оценка состояния здоровья пациента должна основываться на Международной классификации функционирования, ограничений жизнедеятельности и здоровья, которая использует несколько моделей (медицинскую, социальную и биопсихосоциальную), реализуемых в течение реабилитационного процесса в стационаре.
В настоящее время допустимо проводить определение степени нарушения функций по функциональному классу (ФК), при этом используются два критерия – степень нарушения функции и возможность ее компенсации с помощью медико-технических средств. Различают следующие функциональные классы:
- ФК-0 – нет нарушения функций;
- ФК-1 – имеются легкие нарушения функций (25%), которые компенсируются полностью;
- ФК-2 – умеренное нарушение функций (25–50%), не компенсируется с помощью вспомогательных средств;
- ФК-3 – значительное нарушение функций (51–75%), некомпенсируемое или слабо компенсируемое;
- ФК-4 – резко выраженное и полное (свыше 75%) нарушение функций, которое не компенсируется.
В рамках этого формируются несколько уровней восстановления нарушенных функций: первый уровень – истинное восстановление, второй уровень – компенсация функций, третий уровень – реадаптация/приспособление к дефекту.
При разработке индивидуальной программы реабилитации следует учитывать все факторы, способные повлиять на течение восстановительного процесса. Реабилитационный прогноз формируется исходя из реабилитационной способности пациента, состояния его организма и наличия мотивации. Реабилитационные цели устанавливаются индивидуально для каждого больного и корректируются в процессе реабилитации. Все это вместе формирует реабилитационный потенциал.
Задача специалистов – расширить потенциал для того, чтобы пролечить максимальное количество пациентов в реабилитационных центрах. Этому могут помешать спастичность, боль, патологические установки, одиночество, депрессия у пациента, а также непрофессионализм медицинских работников и экономические трудности. Помочь в решении проблемы может быстрое оформление группы инвалидности, что позволит консолидировать усилия медицины и социальной защиты, подключить государственные гарантии для реабилитации пациента с нарушением функций.
В последнее время большое значение на постгоспитальном этапе реабилитации пациентов после инсульта придается принципам подготовки к реабилитационному процессу, или прекондиционирования. Они включают обеспечение техническими средствами и создание безбарьерной среды, профессиональный уход, интермиттирующую гипоксию, коррекцию ограничений, медикаментозный «допинг», функциональное питание.
Прерывистая гипоксия – новый метод тренировки, реабилитации и терапии. Кратковременное воздействие умеренных степеней гипоксии стимулирует аэробный обмен в большинстве органов и тканей, повышает общую неспецифическую резистентность организма к нагрузкам, способствует развитию адаптации к различного рода неблагоприятным воздействиям. Доказано, что острая ежедневная интермиттирующая гипоксия совместно с минимальной физической нагрузкой достоверно улучшает скорость и выносливость у больных с поражением центральной нервной системы.
Важную роль играют профилактика спастичности и лечение положением, правильный подбор диет-столов с формированием гипохолестериногенных меню и оптимизацией основных строительных и энергетических компонентов для профилактики остеопороза.
Существенную пользу в быстрой и безопасной подготовке к реабилитационному процессу приносят мобильные реабилитационные бригады, организованные в рамках государственного контракта. Основная задача мобильных бригад – проведение индивидуализированной комплексной реабилитации для формирования эргономичного трансфера, достижения бытовой и социальной независимости, интеграции в социум пациентов с выраженными ограничениями в передвижении и самообслуживании.
Курс комплексной реабилитации включает:
- разработку и применение индивидуальных программ с учетом выявленных противопоказаний;
- формирование реабилитационного диагноза с учетом оценки реабилитационного потенциала и ограничивающих факторов;
- коррекцию реабилитационного лечения;
- проведение индивидуальной и дифференцированной реабилитации с использованием качественных средств ухода, индивидуального мультидисциплинарного подхода и наиболее эффективных методов для достижения максимальной эффективности.
Для расширения реабилитационного коридора и повышения общей эффективности реабилитации когнитивных, двигательных и других функций показана терапия препаратами, обладающими нейропротективными, нейрорепаративными свойствами. А.Н. Комаров представил результаты исследования по оценке эффективности нейропротективной терапии цитиколином (препарат Цераксон®) на этапе амбулаторной реабилитации у пациентов, перенесших церебральный инсульт более полутора лет назад, с двигательными и координаторными нарушениями, а также у пациентов с психопатологическими нарушениями.
В исследование были включены 57 пациентов в возрасте от 41 до 72 лет (57,3 ± 9,7 года). По данным выписок и результатам нейровизуализации, 82,5% пациентов перенесли ишемический инсульт, 17,5% – геморрагический инсульт. Тяжесть инсульта варьировалась от 2 до 15 баллов по шкале NIHSS, функциональный исход – от 4 баллов по модифицированной шкале Рэнкин, индекс мобильности составлял 2–4 балла.
Путем простого распределения участники исследования были разделены на две группы. Пациенты группы сравнения (n = 36) получали интермиттирующую гипоксию по тренинг-схеме и базисную терапию (антигипертензивные, антиагрегантные средства и пр.). Пациенты не принимали ноотропные или сосудистые средства. Пациенты основной группы (n = 21) дополнительно за 21 день до предполагаемого курса получали интермиттирующую гипоксию по тренинг-схеме и за десять дней Цераксон® в дозе 1000 мг/сут перорально. Пациенты продолжали прием препарата в течение 30 дней на фоне медицинской реабилитации. Следует уточнить, что цитиколин не относится к препаратам с преимущественным действием на рецепторы возбуждающего типа, не провоцирует судорожные приступы и обладает удовлетворительным профилем безопасности.
Через месяц лечения был проведен статистический анализ, результаты которого подтвердили эффективность и безопасность применения препарата Цераксон® для расширения реабилитационного потенциала. По окончании курса амбулаторной реабилитации был зарегистрирован регресс жалоб в обеих группах, при этом наибольшая межгрупповая разница была достигнута по таким показателям, как головокружение (38,9 в группе сравнения и 28,6% в основной группе), метеочувствительность и нарушение походки (41,7 и 33,3% соответственно).
Анализ динамики неврологической симптоматики по шкале NIHSS показал преимущество в группе, получавшей Цераксон®, по сравнению с группой контроля. Нейропротективная терапия препаратом Цераксон® на этапе амбулаторной реабилитации сопровождалась увеличением доли пациентов с хорошим функциональным исходом по шкале Рэнкин в 1,3 раза (с 22,2 до 28,6%), а также уменьшением доли тяжелой инвалидизации в 2,9 раза (с 13,9 до 4,8%).
Резюмируя вышесказанное, А.Н. Комаров констатировал, что комплексное прекондиционирование достоверно ускоряет восстановление самообслуживания и повышает выносливость пациентов с поражением центральной нервной системы на третьем этапе реабилитации.
Быть, а не казаться. Оригинальный цитиколин (Цераксон®), путь создания, доказательная эффективность применения
Оригинальным считается лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических и клинических исследований. По словам доцента кафедры фармакологии Первого Санкт-Петербургского государственного медицинского университета им. И.П. Павлова, к.м.н. Михаила Владимировича ПЧЕЛИНЦЕВА, оригинальный препарат Цераксон® (цитиколин) обладает самой широкой доказательной базой среди нейропротекторов. Доказательная база препарата представлена доклиническими фармакодинамическими, фармакокинетическими и токсикологическими исследованиями, клиническими исследованиями фаз I–III, метаанализами и систематическим обзором.
Цитиколин является органическим веществом, которое относится к группе нуклеотидов – биомолекул, играющих важную роль в клеточном метаболизме. По сути, цитиколин – незаменимый предшественник фосфатидилхолина, основного фосфолипида всех клеточных мембран, в том числе нейрональных. Холин также принимает участие в синтезе ацетилхолина, а цитиколин выступает донором холина в процессах его синтеза. Экзогенный цитиколин позволяет экономить запасы холина в организме, тормозить распад мембранных фосфолипидов, улучшать передачу нервного импульса.
Впервые на его уникальные свойства обратили внимание еще в 1950-е гг., когда E.P. Kennedy из Гарвардского университета обнаружил, что цитидин-5-дифосфохолин – природный предшественник биосинтеза фосфолипидов11. В 1981 г. L.A. Horrocks и соавт. продемонстрировали позитивное влияние цитиколина при церебральной ишемии и по результатам исследований запатентовали этот эффект12.
В доклинических исследованиях токсичность препарата изучалась на моделях животных при однократном введении цитиколина разными путями. При введении доз цитиколина, эквивалентных дозам холина, вызывающим холинергические кризы, каких-либо признаков токсичности не отмечалось. Введение цитиколина 2000 мг/кг внутрь в течение 14 дней хорошо переносилось13, 14.
Цитиколин назначали кроликам-альбиносам (800 мг/кг) в фазе органогенеза, признаков материнской или эмбриофетальной токсичности выявлено не было.
Оценка кинетики цитиколина в клетках головного мозга крыс при внутривенном введении продемонстрировала его способность наращивать концентрацию в течение 48 часов.
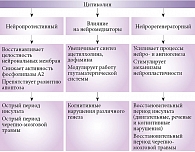
В экспериментальных работах на моделях гипоксии и ишемии было показано, что цитиколин эффективно воздействует на большинство звеньев ишемического каскада, благодаря чему были определены основные нейропротективные механизмы препарата. Цитиколин активирует биосинтез фосфатидилхолина и предотвращает его катаболизм из нейрональных мембран. Он тормозит активность фосфолипаз, не допуская формирования свободных радикалов, препятствует процессам окислительного стресса и апоптоза, модулирует дофаминергическую и глутаматергическую нейротрансмиссию. Обнаруженные нейропротективные механизмы позволили выделить три основных фармакодинамических эффекта цитиколина: нейропротективный, влияние на нейромедиаторы и нейрорегенераторный (рисунок).
Комплексный эффект цитиколина позволяет применять его в различных ситуациях: в острый период инсульта и восстановительный период, а также при черепно-мозговых травмах и когнитивных нарушениях различного генеза.
Клиническая эффективность и безопасность цитиколина изучались в многочисленных исследованиях фаз I–III.
Цель клинических исследований фазы I, которые проводятся на здоровых добровольцах, – выяснить переносимость и безопасность препарата, его фармакокинетику и биодоступность. Так, в клиническом исследовании фазы I с участием 12 здоровых добровольцев переносимость цитиколина при приеме внутрь 600 или 1000 мг в сутки в течение пяти дней определялась как хорошая, только в нескольких случаях имели место головные боли15.
Оценка фармакокинетики цитиколина показала, что после всасывания препарат распадается на холин и цитидин, которые в последующем участвуют в синтезе медиаторов фосфатидилхолина, а также в синтезе фосфолипидов клеточных мембран16.
В другом исследовании был проведен анализ нежелательных явлений у 2817 пожилых пациентов, принимавших цитиколин. Нетяжелые побочные эффекты в виде диареи и периодических болей в эпигастрии отмечались лишь в 5% случаев17.
Исследования фазы II проводятся на популяции пациентов 100–300 человек с патологией, для лечения которой и разрабатывался препарат. Пациенты отбираются по жестким критериям включения. На этом этапе необходимо получить доказательства эффективности нового препарата, подобрать оптимальные дозу и схему приема для исследований фазы III.
М.В. Пчелинцев охарактеризовал три основных клинических исследования фазы II для цитиколина. В двойном слепом исследовании фазы II с участием 165 пациентов с инсультом цитиколин в дозе 1000 мг/сут превосходил плацебо в восстановлении моторной функции нижних конечностей и способствовал реабилитации после гемиплегии18. Во втором двойном слепом исследовании цитиколин назначали в дозе 750 мг/сут в течение десяти дней, не позднее чем через 48 часов после развития инсульта19. Наблюдение за пациентами в течение трех месяцев показало, что цитиколин эффективнее плацебо устранял моторный дефицит (р < 0,05), мышечную гипертонию (р < 0,03), способствовал восстановлению походки (р < 0,02), улучшению динамики изменений на ЭЭГ и показателей психометрических тестов (р < 0,05). В третьем двойном слепом исследовании было продемонстрировано положительное влияние перорального приема цитиколина 500 мг/сут в течение шести недель на ишемические очаги в головном мозге у пациентов с мозговым инфарктом20.
Клинические исследования фазы III – рандомизированные исследования на больших группах пациентов (1000–3000). На этом этапе важно подтвердить эффективность и безопасность препарата для определенного показания в определенной популяции пациентов. Кроме того, может изучаться зависимость эффекта от дозы.
Комплексный эффект цитиколина был подтвержден клиническими исследованиями фазы III. Ретроспективный анализ результатов рандомизированного двойного слепого плацебоконтролируемого исследования показал, что у пациентов с умеренным или тяжелым инсультом лечение цитиколином увеличивало вероятность полного восстановления, при этом серьезных нежелательных явлений, связанных с приемом препарата, не отмечалось21.
В масштабном многоцентровом исследовании 899 пациентов получали лечение цитиколином в дозе 2000 мг в сутки в течение шести недель. Было продемонстрировано достоверное снижение инвалидизации спустя три месяца после терапии цитиколином22.
Таким образом, оригинальный препарат Цераксон® (цитиколин) прошел все необходимые доклинические исследования и все фазы клинических исследований. Цераксон® зарегистрирован и используется в странах Европы, Азии, Южной Америки, России для лечения мозгового инсульта, черепно-мозговой травмы, когнитивных нарушений. Цераксон® – единственный нейропротектор, включенный в Европейские рекомендации по лечению инсульта.
Как известно, после регистрации препарата вслед за тремя фазами клинических исследований наступает очередь фазы IV. На этом этапе проходит сбор дополнительной информации об эффективности и безопасности препарата на достаточно большой популяции, проводится оценка таких параметров, как сроки лечения, взаимодействие с другими лекарственными средствами, анализ применения у больных разных возрастных групп и т.д.
В отношение цитиколина были проведены два основных метаанализа и один систематический обзор. Метаанализ десяти рандомизированных плацебоконтролируемых исследований (4420 пациентов с ишемическим инсультом) подтвердил тот факт, что цитиколин увеличивает вероятность полного восстановления после инсульта на 30% в сравнении с плацебо23. Метаанализ 12 рандомизированных плацебоконтролируемых исследований (2706 пациентов с черепно-мозговой травмой) показал, что цитиколин способствует достижению полной независимости пациентов24. Кокрайновский систематический обзор 14 рандомизированных клинических исследований (1336 пациентов с когнитивными нарушениями) продемонстрировал, что цитиколин способствует уменьшению когнитивных и поведенческих нарушений25.
Далее М.В. Пчелинцев остановился на такой проблеме, как оригинальные препараты и дженерики. В настоящее время в России около 80% объема рынка лекарств составляют воспроизведенные препараты малоизвестных фирм, не имеющих устойчивой репутации в мире. Далеко не всегда дженерики соответствуют оригинальным препаратам, к тому же уровень доказательности эффективности дженериков по сравнению с оригинальными препаратами минимальный. Не случайно в настоящее время разрабатывается комплекс мер по инвентаризации Государственного реестра лекарственных средств на предмет выявления дженериков, эффективность и терапевтическая безопасность которых не подтверждены исследованиями, с последующим их поэтапным исключением из реестра.
Дженерики препарата Цераксон® никогда не испытывались в крупных доказательных исследованиях. Кроме того, трудности в изучении биоэквивалентности дженериков препарата Цераксон® обусловлены тем, что цитиколин является природным соединением, постоянно находящимся в организме человека. Стереоизомерный состав молекул цитиколина в дженериках различных производителей отличается, что может влиять на терапевтическую активность.
Противостояние и одновременно сосуществование оригинальных и дженерических лекарственных средств на фармацевтическом рынке будут продолжаться, поэтому в основе выбора врачом препарата для медикаментозной терапии должна лежать уверенность в его доказанной эффективности и безопасности. По мнению М.В. Пчелинцева, использование оригинального препарата Цераксон® позволяет врачу быть уверенным в полной реализации фармакодинамических эффектов препарата и, следовательно, в потенциально успешном лечении широкого круга неврологических заболеваний, при которых он применяется.
Заключение
Ведение больных с инсультом подразумевает комплекс мероприятий, направленных на снижение летальности в остром периоде инсульта, функциональной зависимости пациента, частоты рецидивов, профилактику и своевременное лечение когнитивных нарушений. Крайне важным подходом считается оптимальная терапия с помощью нейропротекторов. Наиболее изученным из этого класса препаратов является цитиколин (Цераксон®), который обладает самой внушительной доказательной базой. Такие основные фармакодинамические эффекты препарата Цераксон®, как нейропротективный, нейрорегенераторный и влияние на нейромедиаторы, позволяют применять его при различной патологии центральной нервной системы – в острый период инсульта и восстановительный период, при черепно-мозговых травмах и когнитивных нарушениях различного генеза. Высокая клиническая эффективность и безопасность оригинального препарата Цераксон® позволили включить его в Европейские и Североамериканские рекомендации по лечению инсульта.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


