От чего зависит прогноз двигательных и когнитивных функций у пациентов с сосудистыми заболеваниями нервной системы: клинико-визуализационные примеры
- Аннотация
- Статья
- Ссылки
- English
Цель – проанализировать собственные клинико-нейровизуализационные данные пациентов с различными вариантами церебральной ишемии (инсульт, болезнь малых церебральных сосудов) для выделения факторов, влияющих на двигательные или когнитивные функции.
Материал и методы. Проанализированы данные 417 пациентов (178 из них перенесли острый церебральный инсульт) среднего, пожилого и старческого возраста согласно классификации Всемирной организации здравоохранения. Всем пациентам проведены клиническое и нейровизуализационное исследования (компьютерная или магнитно-резонансная томография), в том числе с трактографией и морфометрией стратегических зон головного мозга. В качестве клинических методов использовались данные неврологического осмотра, а также объективные методы, шкалы для оценки двигательного и когнитивного дефицита, предусмотренные клиническими рекомендациями, и шкала Э. Хайма для диагностики копинг-стратегий.
Результаты и выводы. Для прогнозирования исходов и разработки эффективных индивидуальных реабилитационных программ для пациентов с сосудистыми заболеваниями головного мозга необходимо использовать комбинированные методики – и клинические, и нейровизуализационные. Для поддержания функциональной независимости пациента, перенесшего ишемический инсульт, важна целостность церебральных структур. Снижение показателей фракционной анизотропии менее порогового значения 0,963 или радиальной диффузии менее 0,776, по данным магнитно-резонансной трактографии, рассматривается как неблагоприятный прогностический фактор в аспекте восстановления двигательных функций до уровня функциональной независимости (чувствительность модели – 95,8%, специфичность – 87,7%). Из планиметрических показателей, по данным компьютерной томографии, для когнитивного восстановления после перенесенного церебрального инсульта неблагоприятным прогностическим фактором служат большие поперечные размеры таламусов. При хронической церебральной ишемии, обусловленной болезнью мелких церебральных сосудов, в отношении двигательного статуса негативным прогностическим фактором является использование неадаптивной копинг-стратегии для психологической защиты в стрессовых ситуациях, связанных с постуральной неустойчивостью. Эти параметры следует учитывать при выборе фармакотерапии, физической терапии и оказании психологической помощи пациентам с заболеваниями сосудов головного мозга.
Цель – проанализировать собственные клинико-нейровизуализационные данные пациентов с различными вариантами церебральной ишемии (инсульт, болезнь малых церебральных сосудов) для выделения факторов, влияющих на двигательные или когнитивные функции.
Материал и методы. Проанализированы данные 417 пациентов (178 из них перенесли острый церебральный инсульт) среднего, пожилого и старческого возраста согласно классификации Всемирной организации здравоохранения. Всем пациентам проведены клиническое и нейровизуализационное исследования (компьютерная или магнитно-резонансная томография), в том числе с трактографией и морфометрией стратегических зон головного мозга. В качестве клинических методов использовались данные неврологического осмотра, а также объективные методы, шкалы для оценки двигательного и когнитивного дефицита, предусмотренные клиническими рекомендациями, и шкала Э. Хайма для диагностики копинг-стратегий.
Результаты и выводы. Для прогнозирования исходов и разработки эффективных индивидуальных реабилитационных программ для пациентов с сосудистыми заболеваниями головного мозга необходимо использовать комбинированные методики – и клинические, и нейровизуализационные. Для поддержания функциональной независимости пациента, перенесшего ишемический инсульт, важна целостность церебральных структур. Снижение показателей фракционной анизотропии менее порогового значения 0,963 или радиальной диффузии менее 0,776, по данным магнитно-резонансной трактографии, рассматривается как неблагоприятный прогностический фактор в аспекте восстановления двигательных функций до уровня функциональной независимости (чувствительность модели – 95,8%, специфичность – 87,7%). Из планиметрических показателей, по данным компьютерной томографии, для когнитивного восстановления после перенесенного церебрального инсульта неблагоприятным прогностическим фактором служат большие поперечные размеры таламусов. При хронической церебральной ишемии, обусловленной болезнью мелких церебральных сосудов, в отношении двигательного статуса негативным прогностическим фактором является использование неадаптивной копинг-стратегии для психологической защиты в стрессовых ситуациях, связанных с постуральной неустойчивостью. Эти параметры следует учитывать при выборе фармакотерапии, физической терапии и оказании психологической помощи пациентам с заболеваниями сосудов головного мозга.


Введение
Инсульт является одной из ведущих причин смертности и инвалидизации в мире. Среди факторов смертности инсульт занимает второе место, среди факторов, определяющих совокупную смертность и инвалидность, – третье [1].
Двигательные нарушения вследствие церебрального инсульта в раннем периоде заболевания наблюдаются более чем у 70% пациентов [2]. Инвалидность вследствие перенесенного церебрального инсульта во многом определяется двигательными нарушениями. Так, 15–30% больных имеют тяжелую инвалидность, около 40% – менее тяжелую [3].
Постинсультные двигательные нарушения имеют не только медицинское, но и социальное значение, поскольку существенно снижают качество жизни пациентов, ограничивают их бытовую и профессиональную активность, повышают риск развития психоэмоциональных расстройств [4]. Снижение моторных и когнитивных функциональных способностей пациентов негативно отражается на ухаживающих за ними лицах [5].
Раннее прогнозирование степени восстановления всех функций после инсульта позволяет индивидуализировать подходы к реабилитации и повысить ее эффективность [6]. Одним из важных оценочных инструментов общего состояния больного является шкала реабилитационной маршрутизации (ШРМ) с четко прописанными критериями перевода и маршрутизации в зависимости от результатов оценки тяжести состояния пациента и его способности к самообслуживанию [7]. Данная шкала помогает оценить степень восстановления больного после церебрального инсульта, а также степень его зависимости от помощи окружающих. Согласно действующим клиническим рекомендациям, помимо данной шкалы обязательны к применению «трехложечная проба», шкала комы Глазго, TOAST, шкала Рэнкина, индекс Ривермид и NIHSS и др. [8].
В диагностике и прогнозировании исходов после церебрального инсульта помогают нейровизуализационные методы: классический компьютерно-томографический и современная диффузионно-тензорная магнитно-резонансная томография (ДТ-МРТ). Последняя позволяет оценить целостность различных проводящих путей головного мозга, включая кортикоспинальный тракт, повреждение которого влечет за собой двигательный дефицит [9]. Показатели фракционной анизотропии, полученные с помощью ДТ-МРТ, отражают степень целостности и организации белого вещества головного мозга, что делает ДТ-МРТ важным дополнительным инструментом в прогнозировании неврологических исходов [10, 11]. Ряд клинических, в том числе психологических тестовых методик, в отсутствие избыточных финансовых затрат повышают эффективность прогнозирования двигательных и когнитивных функций.
В данной работе особый акцент сделан на функции постуральной устойчивости.
Цель – проанализировать собственные клинико-нейровизуализационные данные пациентов с различными вариантами церебральной ишемии (инсульт, болезнь малых церебральных сосудов) для выделения факторов, влияющих на двигательные или когнитивные функции.
Материал и методы
Проанализированы данные 446 пациентов среднего, пожилого и старческого возраста согласно классификации Всемирной организации здравоохранения. Всем пациентам проведены клиническое и нейровизуализационное исследования (компьютерная или магнитно-резонансная томография) с трактографией и морфометрией стратегических зон головного мозга. Клинические методы предусматривали анализ данных неврологического осмотра, классические объективные методы – использование шкал, рекомендованных для оценки двигательного и когнитивного дефицита: ШРМ, Монреальской шкалы оценки когнитивных функций (MoCA), Краткой шкалы оценки психического статуса (MMSE – Mini-Mental State Examination), шкалы Э. Хайма для диагностики копинг-стратегий.
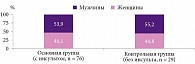
Основную группу составили 207 пациентов, перенесших церебральный инсульт, и 185 пациентов без инсульта в анамнезе с диагностированной с помощью клинических нейровизуализационных методов болезнью малых (мелких) церебральных сосудов. Контрольную группу представляли 54 пациента. Возраст участников исследования составил 20–94 года. Наблюдение за пациентами осуществлялось на базе Клиники Башкирского государственного медицинского университета и клинического госпиталя ветеранов войн (Уфа, Россия).
На первом этапе данные 76 пациентов (41 мужчины и 35 женщин) с двигательным дефицитом после перенесенного церебрального инсульта сопоставлялись с данными 29 пациентов без перенесенного церебрального инсульта в анамнезе по клинико-нейровизуализационным параметрам с использованием ДТ-МРТ. Пациенты обследовались клинически и параклинически с применением ДТ-МРТ на аппарате OPTIMA 360 (GE) с напряженностью магнитного поля 1,5 Т. Применялась 16-канальная поверхностная квадратическая катушка для головного мозга. Стандартный протокол, согласно клиническим рекомендациям, включал в себя набор программ с получением T1- и T2-взвешенных изображений, а также изображений T2-FLAIR с подавлением сигнала от свободной воды и диффузионно-тензорных изображений (DTI) с коэффициентами диффузии b0 и b1000 с/мм2.
Трактографию выполняли в 25 направлениях с первичным получением цветовой карты фракционной анизотропии и последующим объемным моделированием кортикоспинальных трактов. Реконструкция полученных изображений осуществлялась с помощью пакета рабочих программ Volume Viewer 7. Анализ DTI проводился на рабочей станции AW Volume Share 7 с помощью программного обеспечения READY View. На изображениях оценивали значения фракционной анизотропии (ФА), плотность трактов, показатели радиальной и аксиальной диффузии, средний коэффициент диффузии. В качестве клинического обследования использовалась ШРМ. Для описательной статистики применяли программу Excel, для анализа данных – Stattech v. 7.1.8.
Все пациенты подписали информированное добровольное согласие (ИДС) на участие в исследовании. Для пациентов основной группы на первом этапе критериями включения в исследование были наличие одного или нескольких эпизодов острого нарушения мозгового кровообращения по типу ишемического инсульта в анамнезе в течение 12 месяцев от момента осмотра, количество баллов по ШРМ – от 1 до 5 включительно. Общая характеристика вошедших в данную выборку пациентов представлена в табл. 1.
Группы оказались сопоставимы по полу, однако пациенты основной группы с перенесенным инсультом были старше пациентов контрольной группы (рис. 1).
На втором этапе обследовано 102 пациента (69 мужчин и 33 женщины) в возрасте 40–82 лет в раннем восстановительном периоде ишемического инсульта, подписавших ИДС на участие в исследовании. Уровень состояния функционирования и ограничения жизнедеятельности по ШРМ – от 3 до 5 баллов без выраженной деменции (не менее 10 баллов по MMSE). Выполнены полное клиническое, неврологическое, нейропсихологическое обследование и анализ данных компьютерной томографии (КТ) головного мозга с морфометрией стратегических зон головного мозга, проведенной в остром периоде ишемического инсульта. В качестве нейровизуализационного контроля использовались результаты КТ 25 пациентов без острого церебрального инсульта (исследование выполнялось по другим показаниям).
Третий этап предполагал анализ клинических и психологических данных пациентов с хронической ишемией головного мозга вследствие болезни малых церебральных сосудов без инсульта в анамнезе с двигательным дефицитом в виде координаторно-постуральных расстройств. В программу исследований этих пациентов включалась оценка по шкале Э. Хайма для диагностики копинг-стратегий.
Результаты и обсуждение
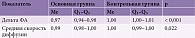
На первом этапе в основной группе церебральный инсульт слева диагностирован у 36 (47,4%) пациентов, справа – у 40 (52,6%). Все больные находились в ясном сознании. Кортикоспинальные тракты строились в ручном режиме по зонам интереса обоих полушарий головного мозга. Диффузионные метрики проанализированы как в левом, так и в правом полушарии (табл. 2). Медиана дельты ФА у пациентов, перенесших инсульт (основная группа), составила 0,97, у пациентов без инсульта (контрольная группа) – 1,0 (p < 0,001), медиана дельты средней скорости диффузии – 0,99 и 1,0 соответственно (p = 0,022).
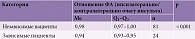
Проанализировано отношение ФА в пораженном и непораженном полушариях головного мозга у пациентов с различными значениями ШРМ. Показатель ШРМ преобразован в категориальный признак: количество баллов от 0 до 3 оценивалось как независимость пациента от окружающих, от 4 до 6 – как зависимость пациента от окружающих (табл. 3).
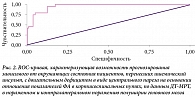
При ROC-анализе зависимости результатов ШРМ и ФА получена кривая, представленная на рис. 2. Площадь под ROC-кривой составила 0,959 ± 0,018, 95%-ный доверительный интервал 0,924–0,994. Полученная модель статистически значима (p < 0,001).
Пороговое значение отношения показателей ФА в пораженном и непораженном полушариях головного мозга, по данным ДТ-МРТ, в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,963. Вероятность зависимости пациента от окружающих прогнозировалась при значении отношения ФА ниже данной величины. Чувствительность и специфичность модели составили 95,8 и 87,7% соответственно.
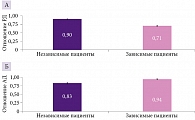
При анализе соотношения показателей радиальной диффузии (РД) и аксиальной диффузии (АД) с клиническими данными (ШРМ) выявлено, что значения РД у пациентов, зависимых от окружающих, были ниже (0,71 против 0,90), а значения АД — выше (0,94 против 0,83), что также статистически значимо (p < 0,001) (рис. 3).
При ROC-анализе пороговое значение отношения РД в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,776. При значении отношения ВК РД ниже данной величины можно прогнозировать зависимость пациента от помощи окружающих.
ROC-анализ также показал высокую вероятность функциональной зависимости пациента при уровне АД ≥ 0,888 (наивысшее значение индекса Юдена).
На втором этапе исследования были проанализированы планиметрические показатели морфометрии структур головного мозга, по данным КТ, у пациентов, перенесших ишемический инсульт. Ранее нами были опубликованы результаты, указывающие на то, что для когнитивного восстановления после перенесенного церебрального инсульта неблагоприятным прогностическим фактором служит большой поперечный размер таламусов [12, 13], измеренный в остром периоде инсульта с помощью КТ. На данном этапе мы соотнесли показатели размеров указанных структур, оцененные в первый день инсульта, с данными пациентов без инсульта, чтобы аргументированно говорить о том, что эти размеры не меняются в остром периоде инсульта. Полученные результаты представлены в табл. 4. Различия оказались статистически незначимы, что подтверждает полученные нами ранее данные и отрицает возможность изменения изучаемых морфометрических параметров в остром периоде инсульта.
На клинические исходы при сосудистых заболеваниях мозга влияют не только морфологические прогностические факторы, но и психологические [14]. На третьем этапе мы проанализировали результаты клинико-психологического исследования 185 пациентов, в частности 104 женщин, в возрасте 56–87 лет (средний возраст – 67,6 ± 7,68 года) с признаками хронической церебральной ишемии вследствие болезни малых церебральных сосудов. Диагноз устанавливали на основании клинических и нейровизуализационных данных.
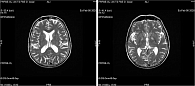
Для наглядности результаты МРТ головного мозга одной из пациенток с типичными признаками болезни малых церебральных сосудов представлены на рис. 4. Исследование проведено в аксиальной, коронарной и сагиттальной проекциях с учетом стандартов описательной картины сосудистых изменений, по данным нейровизуализации STRIVE 2, c использованием импульсных последовательностей T1, T2, FLAIR, DWI b0 и b1000, Т2*, SWAN.
Пациентка Н., 67 лет, с клиническими признаками хронической церебральной ишемии, без указаний на инсульт в анамнезе. Полушария большого мозга, мозжечка развиты, сопоставимы с двух сторон. Дифференциация серого и белого вещества в них сохранена. Кортикальная пластина не истончена, равномерно представлена на всех уровнях. В глубоком белом веществе, лобно-теменных и височных областях небольшие единичные очаги измененного, гиперинтенсивного по Т2 и FLAIR сигнала размером не более 3 × 5 × 4 мм. Явления перивентрикулярного лейкоареоза выражены умеренно, со стороны передних рогов глубиной не превышают 5–6 мм – Fazecas I. По ходу нижней лобной извилины справа, суб- и юкстакортикально в пределах белого вещества, очаг округлой формы диаметром до 18 мм, с признаками умеренного ограничения диффузии на картах измеряемого коэффициента диффузии и повышением сигнальных характеристик на T2 и FLAIR. На остальном протяжении признаков локального ограничения диффузии в головном мозге нет. На уровне подкорковых ядер в режимах градиентного эха определены небольшие (2–5 мм в диаметре) кальцификаты, очаги церебрального микрокровоизлияния, характеризующиеся потерей сигнала с сопутствующим артефактом «блуминга». Периваскулярные пространства Робина – Вирхова первого, второго и третьего типов, в большей степени выраженные на уровне подкорковых ядер (первого типа, шириной до 1–2 мм). Субтенториально в правом полушарии мозжечка небольшая (остаточная) киста размером около 5 × 11 × 7 мм. Еще один кистовидный очаг щелевидной формы размером до 5 × 11 × 5 мм в латеробазальных отделах правого полушария мозжечка, частично сливается с одной из его борозд. Желудочковая система головного мозга не деформирована. Боковые желудочки на уровне тел шириной до 12–15 мм. Третий желудочек шириной до 8 мм, четвертый – аксиально 9 × 20 мм. Субарахноидальные пространства без признаков выраженного расширения, соответствуют значениям по шкале медиальной темпоральной атрофии 1 баллу, по шкале глобальной церебральной атрофии – 1-й степени с легким «открытием борозд» и небольшим увеличением желудочков.
С целью выявления психологических расстройств таким пациентам был предложен метод диагностики копинг-стратегий Э. Хайма для определения способа борьбы со стрессом. Метод предусматривает изучение 26 ситуационно-специфических вариантов типов поведения, реагирования на сложную ситуацию, борьбы со стрессом (копинга), распределенных в соответствии с тремя основными сферами психической деятельности на когнитивный, эмоциональный и поведенческий копинг-механизмы. Как негативный исход в плане моторных функций исследованы постуральная неустойчивость и падения. Выявлено, что при хронической церебральной ишемии, вызванной болезнью мелких церебральных сосудов, негативным прогностическим фактором служит использование неадаптивных копинг-стратегий для психологической защиты в стрессовых ситуациях, связанных с постуральной неустойчивостью. Эти данные соотносятся с результатами наших более ранних аналогичных исследований [15]. Неадаптивными копинг-стратегиями пользовался каждый четвертый пациент данной выборки. Преимущественно это была стратегия «активного избегания», которая проявлялась пассивностью, уединением, стремлением к покою и изоляции, отказом от межличностных контактов и нежеланием решать проблемы.
Выводы
Представленные клинико-нейровизуализационные данные соответствуют ранее полученным результатам. Прогноз двигательных и когнитивных функций у пациентов с сосудистыми заболеваниями нервной системы зависит от множества морфофункциональных и клинических показателей, в том числе психологических. Это необходимо учитывать при прогнозировании исходов и разработке индивидуальных реабилитационных программ для пациентов с сосудистыми заболеваниями головного мозга. Для функциональной независимости пациента, перенесшего ишемический инсульт, важна целостность церебральных структур. Снижение показателей ФА менее порогового значения 0,963 или РД менее 0,776, по данным магнитно-резонансной трактографии, рассматривается как неблагоприятный прогностический фактор в аспекте восстановления двигательных функций до уровня функциональной независимости (чувствительность модели – 95,8%, специфичность – 87,7%). Из планиметрических показателей, по данным КТ, для когнитивного восстановления после перенесенного церебрального инсульта неблагоприятным прогностическим фактором считаются большие поперечные размеры таламусов. При хронической церебральной ишемии, вызванной болезнью мелких церебральных сосудов, для двигательного статуса негативным прогностическим фактором является использование неадаптивных копинг-стратегий для психологической защиты в стрессовых ситуациях, связанных с постуральной неустойчивостью. Указанные параметры следует учитывать при выборе методов эффективной фармакотерапии, физической терапии и психологической помощи пациентам с заболеваниями сосудов головного мозга.
L.R. Akhmadeeva, PhD, Prof., R.R. Gizatullin, D.E. Baykov, PhD, E.M. Kharisova, G.A. Bulyakova, M.V. Savchenko
Bashkir State Medical University
Clinical Hospital ‘Russian-Railroads-Medicine’, Ufa
Academy of Sciences of Bashkortostan Republic
Contact person: Leila R. Akhmadeeva, Leila_ufa@mail.ru
In the modern paradigm, cerebrovascular diseases are classified depending on the caliber of arteries in which circulatory disorders occur and the rate of development of clinical symptoms.
The purpose of this work was to analyze our own clinical and neuroimaging data of patients with various types of cerebral ischemia (after a stroke and those suffering from small cerebral vessel disease) to identify factors that influence motor or cognitive functions.
Material and methods. The study included data from 417 patients (178 of whom were cerebral stroke survivors) from middle to old age according to the WHO classification. All of them underwent clinical and neuroimaging (computed tomography or magnetic resonance imaging) studies with tractography and morphometry of strategic areas of the brain. As clinical methods, we used neurological examination results, including those measured with different scales recommended for assessing motor and cognitive deficits in Russian official clinical guidelines and E. Heim scale for diagnosing coping strategies.
Results and conclusions. To predict outcomes and more effectively build individual rehabilitation programs for patients with vascular diseases of the brain, it is important to use a combination of the results of clinical and neuroimaging techniques. For the functional independence of a patient who has suffered an ischemic stroke, the integrity of cerebral structures plays an important role: a decrease in fractional anisotropy below a threshold value of 0.963 or radial diffusivity below 0.776 according to magnetic resonance tractography are unfavorable prognostic factors for the restoration of motor functions to the level of functional independence (model sensitivity – 95.8% and specificity – 87.7%). Of the planimetric indicators according to computed tomography for cognitive recovery after a cerebral stroke, the large transverse sizes of the thalamuses turned out to be an unfavorable prognostic factor. In chronic cerebral ischemia caused by small cerebral vessel disease, the use of maladaptive coping strategies for psychological protection in stressful situations associated with postural instability was a negative prognostic factor for motor status. These parameters, along with those previously known, should be taken into account for the selection of effective methods of pharmacotherapy, physical therapy and psychological care for patients with diseases of the cerebral vessels.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.