Наружный генитальный эндометриоз и риски малигнизации
- Аннотация
- Статья
- Ссылки
- English
В статье рассмотрены существующие теории, а также генетические, молекулярные и иммунологические аспекты, обусловливающие малигнизацию наружного генитального эндометриоза.
В статье рассмотрены существующие теории, а также генетические, молекулярные и иммунологические аспекты, обусловливающие малигнизацию наружного генитального эндометриоза.
Наружный генитальный эндометриоз – хроническое рецидивирующее прогрессирующее заболевание, при котором обнаруживают ткань, сходную с эндометрием, вне полости матки.
До сих пор нет единой теории, объясняющей этиологию и патогенез наружного генитального эндометриоза [1, 2]. Наиболее известная теория связывает развитие заболевания с ретроградными менструациями или рефлюксом эндометрия. Однако она неспособна объяснить возникновение эндометриоза у женщин без матки, например при синдроме Майера – Рокитанского – Кюстера – Хаузера. Согласно теории целомической метаплазии, эндометриоз образуется из мезотелиальных клеток на поверхности яичников, переходящих в эндометриальные железистые клетки, что не исключает вероятность его развития у мужчин и детей допубертатного возраста [3].
Согласно еще одной теории, эндометриоз является результатом миграции и пролиферации эндометриальных стволовых клеток в течение эмбриогенеза. Так, на брюшине у плодов женского пола были обнаружены небольшие очаги, состоящие из эндометриальных клеток. Было сделано предположение, что это остатки или результат метаплазии мюллеровых протоков.
Наружный генитальный эндометриоз – патологический процесс, характеризующийся наличием клеток, сходных с эндометрием, но способных защищаться от разрушения иммунными клетками за счет экспрессии специфических антигенов и секреции иммуносупрессивных факторов.
Чаще всего наружный генитальный эндометриоз рассматривают как доброкачественное заболевание, однако для него свойственны характеристики, напоминающие злокачественный процесс: развитие локальных и отдаленных фокусов, прикрепление и инвазия в другие ткани с последующим повреждением органов, самозащита от физиологического апоптоза [4, 5].
В исследованиях последних десятилетий показан повышенный риск малигнизации при диагнозе «наружный генитальный эндометриоз». Так, L.A. Brinton и соавт., в течение 14 лет изучавшие риск развития опухолей различных локализаций у пациентов с установленным диагнозом «эндометриоз», установили, что в данной популяции риск развития рака яичника выше в 1,9 раза, рака молочной железы – в 1,3 раза, злокачественных новообразований кроветворной системы – в 1,4 раза [6].
В большинстве опубликованных исследований эндометриоз-ассоциированных опухолей отмечался повышенный риск развития рака яичников у лиц с генитальным эндометриозом [7, 8]. Согласно данным M. Kvaskoff и соавт., среди пациентов с наружным генитальным эндометриозом наиболее часто встречались рак яичника (преимущественно светлоклеточная и эндометриоидная карцинома), рак щитовидной железы, рак эндометрия, рак молочной железы [9]. Несмотря на эпидемиологически подтвержденную связь между раком яичника и эндометриозом, прямых доказательств этого не обнаружено [10].
Первые гистологические доказательства связи эндометриоза с опухолью яичника были предоставлены J.A. Sampson в 1925 г. Он же является создателем основной теории этиологии эндометриоза.
J.A. Sampson сформулировал три критерия эндометриоз-ассоциированной малигнизации, определяющие происхождение рака из эндометриоидной ткани [11]:
- подтверждена локализация эндометриоидного очага рядом с опухолью;
- происхождение карциномы из эндометриоидной ткани, а не инвазия в нее из другого источника;
- обязательное наличие ткани, похожей на эндометриоидную, окруженную характерными железами.
В 1953 г. R.B. Scott предложил учитывать гистологический переход из доброкачественной эндометриоидной ткани в опухолевую в качестве четвертого критерия эндометриоз-ассоциированного рака яичника [12].
Однако при проведении гистологического исследования редко удается верифицировать все вышеуказанные критерии для подтверждения малигнизации эндометриоидной ткани, что в свою очередь может привести к недооценке ситуации и ложному заключению.
Свыше 80% эндометриоз-ассоциированных опухолей расположены в яичниках. Экстрагенитальные неоплазии обнаруживаются в одной пятой случаев [13]. Наиболее частая локализация экстрагенитальных опухолей – ректосигмоидный отдел кишки, ректовагинальная перегородка и брюшина таза – области, поражаемые глубоким инфильтративным эндометриозом [14].
Рак яичника представляет собой комплекс различных злокачественных форм с высоким уровнем смертности и пятилетней выживаемостью менее 49%. Он занимает третье место в структуре самых распространенных злокачественных новообразований репродуктивной системы женщин [15].
На сегодняшний день принято выделять отдельную группу эндометриоз-ассоциированных опухолей яичников.
Существует теория, что гистологически эндометриоз-ассоциированный рак яичника происходит из атипического эндометриоза яичника [16]. Атипический эндометриоз характеризуется гиперплазией эндометриальных желез с цитологической атипией или наличием клеток с набухшими ядрами [17]. Подобные изменения обнаруживаются в 80% эндометриоз-ассоциированных опухолей. Однако данных, доказывающих процесс перехода атипической ткани эндометриоза в опухолевую, накоплено недостаточно.
Остаются также неизученными причины малигнизации. В некоторых исследованиях установлено схожее микроокружение в тканях эндометриоза и эндометриоз-ассоциированных опухолей. В развитии процессов участвуют одни и те же медиаторы воспаления и цитокины [18, 19]. Считается, что они появляются под воздействием комплекса патогенетических факторов, таких как генетические мутации, эндокринный дисбаланс, окислительный стресс, иммунная дисрегуляция. Не исключено генотоксическое влияние повышенной концентрации эстрогенов в эндометриоидных гетеротопиях на ДНК, что может инициировать дополнительные мутации и, как следствие, канцерогенез [7].
Таким образом, вопрос о рисках малигнизации эндометриоидной ткани и причинах данного перехода до сих пор остается недостаточно изученным.
Окислительный стресс
Одной из наиболее распространенных теорий возникновения генитального эндометриоза является теория ретроградного заброса менструальной крови и эндометрия, которая также может объяснить патогенез малигнизации. Депозиты гемосидерина были обнаружены не только в эндометриоидных клетках, но и в клетках эндометриоидного и светлоклеточного рака яичника [20]. Железо индуцирует активные формы кислорода. Избыточное содержание железа в тканях может приводить к канцерогенезу через индукцию окислительного стресса и мутагенез. В 2015 г. Т. Iwabuchi и соавт. доказали, что ферритин, ядерный фактор 2, наряду с гемоксигеназой, глутатион S-трансферазой Pi 1 и глутатион-зависимыми пероксидазами участвует в антиоксидантной защите и изменение экспрессии генов данных молекул может вносить вклад в туморогенез при постоянном повреждении ДНК [21]. Таким образом создается микроокружение, способствующее пролиферации и выживанию опухолевой клетки.
Иммунологические факторы
Эндометриоз ассоциирован с хронической неэффективной воспалительной реакцией, в которой ключевую роль играют макрофаги. Они обнаружены в стенках эндометриоидных кист, перитонеальной жидкости и эндометриоидных гетеротопиях. Макрофаги секретируют множество провоспалительных факторов: трансформирующий фактор роста β (TGF-β), васкулоэндотелиальный фактор роста, интерлейкин 1 (IL-1), простагландин Е2 (PGE2), фактор, ингибирующий миграцию макрофагов. Активированные макрофаги усиливают окислительный стресс через продукцию перекисных липидов [19]. IL-1 индуцирует экспрессию циклооксигеназы 2 и IL-8, запускающих миграцию, пролиферацию и ангиогенез эндометриоидной ткани [22]. PGE2 повышает синтез эстрогенов через активацию белка острой регуляции стероидогенеза и ароматазы, приводя к активации лейкоцитов и ангиогенеза [20].
В эндометриоидных гетеротопиях отмечена повышенная адгезивная способность к компонентам внеклеточного матрикса, таким как коллаген 4, ламинин, витронектин и фибронектин. Очаги эндометриоза также характеризуются сниженной экспрессией Е-кадгерина, β-катинина и интегринов (молекул клеточной адгезии) [21]. Комплекс «Е-кадгерин – β-катенин» играет ключевую роль в эпителиальных контактах и поддержании архитектоники ткани. Инициация канцерогенеза и его прогрессирование связаны с нарушением экспрессии кадгеринов и интегринов [22].
Анализ генетической экспрессии продемонстрировал, что путь активации системы комплемента является наиболее значимым при переходе эндометриоза в эндометриоз-ассоциированный рак. Уровни экспрессии факторов комплемента (С7, фактор D, B, H) в образцах рака яичника и эндометриоза были значительно более высокими, чем в ткани нормального эндометрия [22]. Прослеживалась тенденция к возрастанию концентрации факторов классического пути комплемента от ткани нормального эндометрия к эндометриоидной, атипическому эндометриозу и раку. Для маннан-связывающей лектиновой протеазы 1 характерна обратная картина, что свидетельствует о непричастности лектинового пути активации комплемента к развитию эндометриоз-ассоциированного воспаления. Важно отметить, что активность системы комплемента не наблюдалась при других формах рака яичника, таким образом ее можно рассматривать в качестве отличительной черты эндометриоз-ассоциированных опухолей [23].
Помимо исследования ex vivo значимая активация системы комплемента при эндометриозе и эндометриоз-ассоциированных опухолях яичников была показана in vitro на трансгенной модели мышей MUC1, у которых развивается эндометриоидный рак яичника, близкий к человеческому [24]. Мышь является гетерозиготой по MUC1, экспрессируя этот ген на поверхности эпителия яичников, имеет онкоаллель LoxP-Stop-LoxP K-rasG12D и инактивированный ген PTENloxP/loxP [25]. В ткани эндометриоидных опухолей яичников этих мышей также наблюдался высокий уровень экспрессии генов системы комплемента, что может быть использовано как преклиническая модель исследования биологии микроокружения опухолей яичников.
Предрасполагающим фактором в патогенезе эндометриоза и дальнейшего перехода его в опухоль является дисрегуляция Т-регуляторных клеток [1, 26]. Они определяются экспрессией транскрипционного фактора Foxp3, признанного главным геном контроля развития Т-регуляторных клеток и их последующего функционирования. Регуляторные Т-клетки Foxp3+ играют ключевую роль в обеспечении иммунного ответа и поддержании иммунологической толерантности, которая позволяет иммунной системе отличать собственные антигены от чужеродных. Результаты исследования Y. Tanaka и соавт. продемонстрировали более низкие уровни активированных Т-лимфоцитов Foxp3+ в ткани эндометриоидных кист яичников и образцах эндометрия пациенток с эндометриозом по сравнению с тканью эндометрия здоровых женщин, в то время как общее число Т-регуляторных клеток в указанных образцах тканей не различалось [27]. Таким образом, снижение уровня активных Т-регуляторных клеток может вносить свой вклад в распространение эндометриоза. В то же время была установлена обратная корреляция между повышенной экспрессией в ткани эпителиального рака яичника Т-регуляторных лимфоцитов Foxp3+, уровнем экспрессии клеток и общей выживаемостью пациентов [28].
Молекулярно-генетические факторы
Многочисленные исследования были посвящены поиску генетических нарушений, подтверждающих связь между эндометриозом и злокачественными новообразованиями. Геномная нестабильность и утрата гетерозиготности считаются маркерами инактивации участков генов, отвечающих за супрессию опухолей [29–42].
Наиболее часто в литературе описываются мутации генов KRAS, опухолевого белка p53, PTEN, гена фермента фосфоинозитид-3-киназы (PIK) и ARID1A, которые связывают с опухолевой трансформацией эндометриоза. На основании секвенирования и результатов иммуногистохимических исследований продемонстрировано, что мутации, найденные в эндометриоз-ассоциированных опухолях яичников, обнаруживаются в предшествующей эндометриоидной ткани [29]. Проводились исследования утраты гетерозиготности, показавшие, что в образцах опухолей яичников, ассоциированных с эндометриозом, такие участки встречаются чаще, чем в образцах доброкачественных эндометриом. В 1996 г. X. Jiang и соавт. впервые установили три участка хромосомы (9p, 11q, 22q) с утраченной гетерозиготностью, которые обнаруживаются при эндометриозе яичников и опухолях яичников, предположив это доказательством их общего генетического происхождения [30].
Роль генов KRAS и PTEN в патогенезе эндометриоза и ассоциированного с ним рака была достоверно подтверждена в 2005 г., когда D.M. Dinulescu и соавт. была разработана экспериментальная модель эндометриоза и эндометриоидного рака яичника на мышах. Активация экспрессии онкогенного гена KRAS на эпителиальной поверхности яичника приводит к развитию эндометриоза яичника, в совокупности с инактивацией PTEN – к переходу доброкачественного процесса в инвазивную эндометриоидную аденокарциному яичника [25].
Роль гена-супрессора опухоли PTEN в развитии рака яичника
Ген PTEN кодирует одноименный белок – фосфатазу с двойной субстратной специфичностью, которая является негативным регулятором фосфоинозитид-3-киназного сигнального пути (PI3K/AKT). В связи с этим проводились многочисленные исследования с целью определить роль данного гена в патогенезе опухолей различных локализаций. Впервые соматические мутации и утрата гетерозиготности гена в эндометриоидной ткани были подтверждены в 2000 г. в исследовании в N. Sato и соавт. [31]. Утрата гетерозиготности обнаружена в 27,3% светлоклеточных карцином яичника, 42,1% эндометриоидных карцином и 27,3% одиночных эндометриоидных кист. В то же время соматические мутации установлены в 20,0, 8,3 и 20,6% случаев соответственно. В другом исследовании было показано, что инактивация PTEN имела место более чем в 75% случаев рака яичника, ассоциированного с эндометриозом [32]. Подобные результаты были подтверждены в работах других исследователей [33].
Нарушение работы белка KRAS в эндометриоз-ассоциированных опухолях
Белки RAS, включающие группу из трех белков (H, N и K), являются семейством гидролаз гуанозинтрифосфата с двумя конформационными формами: дифосфатной (неактивной) и трифосфатной (активной). Эти белки запускают сигнальный каскад митогенактивированных киназ и PI3K/AKT. Онкогенный белок KRAS кодируется геном KRAS-2 и является участником каскада рецептора эпидермального фактора роста. Мутации данного гена характерны для 25% опухолей различных локализаций. При этом для рака поджелудочной железы характерна наибольшая встречаемость мутаций – около 90% [34, 35]. Внимание к его изучению началось с разработанной модели эндометриоза на мышах, однако в ней проявления эндометриоза наблюдались через восемь месяцев после первой индукции KRAS [25]. Согласно данным K. Suda и соавт., в 42,6% эндометриоидных кист яичников обнаружена мутация данного гена [22]. В других исследованиях частота встречаемости мутации была ниже – 25% [36].
Роль гена ARID1A
Ген ARID1A кодирует белок BAF250a, который является частью АТФ-зависимого комплекса SWI/SNF, участвующего в ремоделировании хроматина и обладающего функцией подавления опухолей. Хроматин регулирует активность генов (чаще оказывая подавляющее действие), отвечающих за обновление и дифференцировку клеток. Считается, что мутация ARID1A – наиболее важное событие для запуска эндометриоз-ассоциированной малигнизации [37, 38]. Согласно данным исследований, 46–57% светлоклеточных карцином яичника и 14,3% эндометриоидных карцином характеризуются мутацией ARID1A [39, 40]. При этом в образцах высокодифференцированных серозных опухолей яичников мутации не обнаружены [41, 42]. В 2019 г. в Испании было проведено проспективное исследование в отношении 185 пациентов с эндометриозом, у 23 из которых установлен атипический эндометриоз. Согласно полученным данным, утрата экспрессии белка BAF250a чаще встречалась при атипическом эндометриозе, чем при обычном, – 23,8 и 3,0% случаев соответственно (p = 0,004) [43]. Утрата экспрессии белка BAF250a в эндометриомах может служить индикатором риска малигнизации [44].
Участие PI3K/AKT сигнального пути в инициации канцерогенеза
Фосфоинозитид-3-киназный сигнальный путь играет ключевую роль в пролиферации и выживании клеток в ответ на ростовые факторы, гормоны и цитокины. Мутации фосфатидилинозитол-4,5-бисфосфат-3-киназного сигнального пути наиболее частые при раке. Этот путь – физиологическая мишень PTEN. Соматические мутации данного сигнального пути включают мутации субъединиц гена PIK3 (фосфоинозитид-3-киназы), чаще всего PIK3CA. Анализ литературы указывает на связь мутации PIK3CA и атипического эндометриоза [43–46]. Показано также, что мутация H107R-киназного домена белка обнаруживается в 43% образцов светлоклеточной карциномы яичника, 75 и 88% образцов эндометриоидной ткани и атипического эндометриоза соответственно. Именно поэтому авторами выдвинута гипотеза, что мутация PIK3CA является ранним событием в процессе туморогенеза, инициируя переход эндометриоза в атипический и затем в рак [43]. Установлено, что активация сигнального пути приводит к изменению семейства белков FOXO1, которые через белок 1, связывающий инсулиноподобный фактор роста, влияют на устойчивость к прогестерону при эндометриозе. Подобная активирующая мутация была обнаружена в 40% наблюдений эндометриоз-ассоциированного рака яичника [46]. В опухолях различных локализаций (молочная железа, легкие, тело матки) часто наблюдается сочетание мутации ARID1A и PIK3CA [47], что также подтверждается в клетках светлоклеточной карциномы яичника [48].
Транскрипционный фактор p53 как маркер опухолевой трансформации
В атласе генома рака проанализировано 489 высокодифференцированных опухолей яичников и установлено, что в 96% случаев имела место мутация TP53, гена белка p53, являющегося антионкогеном [49]. Были также проведены исследования, продемонстрировавшие достоверное увеличение встречаемости генотипа INS/INS гена TP53 (p16) у пациенток с наружным генитальным эндометриозом (p = 0,005) [50].
В 2004 г. было проведено исследование по оценке уровня экспрессии белка р53 в тканях эндометрия здоровых женщин, эндометриоидных очагах, образцах атипического эндометриоза и рака яичника [51]. Получены результаты об отсутствии экспрессии данного белка как в ткани нормального эндометрия, так и в эндометриоидной ткани. Однако была выявлена экспрессия во всех образцах атипического эндометриоза и в 82,4% образцов эндометриоз-ассоциированного рака яичника. Этот факт можно использовать в качестве маркера ранней диагностики предопухолевых изменений эндометриоидной ткани. Новых исследований по оценке связи между экспрессией белка опухолевой супрессии p53 и эндометриоз-ассоциированной малигнизации не проводилось.
Ген фермента серин/треонин протеинфосфатазы 2А – PPP2R1A
Ген PPP2R1A участвует в подавлении роста и деления клеток. Мутация данного гена в клетках светлоклеточной карциномы яичника встречается редко – до 10% случаев, мутация генов ARID1A и PIK3CA чаще – в 62 и 51% случаев соответственно [52]. Показано также, что мутация данного гена сочетается с другими, названными выше мутациями [40].
Ядерный фактор гепатоцитов 1β – маркер светлоклеточной карциномы яичника
Ядерный фактор гепатоцитов 1β (HNF-1β) является фактором транскрипции, участвующим в процессе эмбриогенеза и тканеспецифичной экспрессии генов. Впервые данные о его высоком уровне экспрессии в эндометриоз-ассоциированной светлоклеточной карциноме яичников по сравнению с другими формами рака яичника были опубликованы А. Tsuchiya и соавт. в 2003 г. [53]. Результаты последующих работ подтвердили высокую экспрессию HNF-1β в клетках светлоклеточного рака и серозной карциномы яичника по сравнению с полным ее отсутствием при других формах заболевания [54, 55]. Таким образом, экспрессия HNF-HNF-1β может быть достоверным критерием диагностики светлоклеточного рака яичника.
В 2022 г. S. Mortlock и соавт. также установили связь на уровне генов между эндометриозом и эпителиальными опухолями яичников [56], что еще раз подчеркивает актуальность изучения механизмов, объединяющих эти процессы.
МикроРНК
МикроРНК (миРНК) – малые некодирующие последовательности РНК, представляющие собой цепи из 19–22 нуклеотидов. Их функция заключается в регулировании транскрипции матричной РНК (мРНК): миРНК присоединяется к некодируемому концу 3’ таргетной мРНК и вызывает прекращение ее трансляции, деградацию или дестабилизацию. Нарушение баланса миРНК/мРНК может приводить к нарушению нормальной физиологии ткани [57].
Количество и состав миРНК в нормальной ткани эндометрия и эндометриоидной ткани различны. Предпринимаются попытки разработать метод неинвазивной диагностики эндометриоза с помощью определения специфических миРНК в крови [58, 59]. За последние десятилетия установлено, что при онкологических процессах гены локализованы в нестабильных геномных сайтах, ассоциированных с развитием рака, и дисрегулированы под действием миРНК [60]. Канцерогенная активность миРНК может быть реализована двумя способами [61]:
- активированы миРНК, которые подавляют гены супрессии опухолей, так называемые онко-миРНК, инактивация миРНК, подавляющих канцерогенез, усиливает процессы малигнизации;
- некоторые миРНК обладают собственной онкогенной активностью.
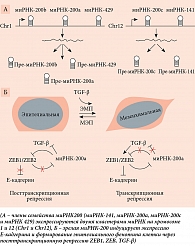
Семейство миРНК-200 – одно из наиболее изученных в патогенезе эндометриоза (отмечено снижение их активности) и метастазировании рака. Оно включает пять типов – миРНК-200а, миРНК-200b, миРНК-200с, миРНК-141 и миРНК-429 [62, 63]. Установлено, что их мишенью являются гены PTEN, ген белка катенин β1, которые играют важную роль в регуляции эпителиально-мезенхимального перехода (ЭМП). Наряду с миРНК этот процесс регулирует TGF-β и белок ZEB1, участвующий в метастазировании [64]. При повышении уровня TGF-β снижается экспрессия миРНК-200 и активируется ZEB1, который в свою очередь является транскрипционным репрессором Е-кадгерина. Е-кадгерин – белок межклеточной адгезии, потеря которого приводит к диссоциации опухолевых клеток и их повышенной способности к метастазированию, характерной для эпителиального фенотипа клеток. Таким образом, активация ZEB1 под воздействием миРНК-200 приводит к утрате кадгерина и переходу эпителиальных клеток в мезенхимальные клетки, более склонные к инвазии (рисунок) [65].
Процесс ЭМП запускается усиленным сигналингом TGF-β через активацию экспрессии белков ZEB1 и ZEВ2, что приводит к транскрипционной репрессии Е-кадгерина и формированию мезенхимального, инвазивного фенотипа клетки. ЭМП поддерживается двойной отрицательной обратной связью: подавлением транскрипции миРНК-200 с помощью ZEB1/ZEB2. Однако данный процесс обратимый: повышение экспрессии миРНК-200 приводит к обратному мезенхимально-эпителиальному переходу (МЭП), восстанавливает экспрессию Е-кадгерина и эпителиальный фенотип клетки.
В 2017 г. были опубликованы данные о способности ингибитора миРНК-141 останавливать процесс эпителиально-мезенхимального перехода, что служит дополнительным подтверждением участия миРНК в патогенезе опухолевой прогрессии [66].
В 2020 г. N. Nakamura и соавт. также показали прямую ассоциацию уровня миРНК-486-5р в крови, перитонеальной и асцитической жидкостях пациенток с эндометриоидными кистами яичников и раком яичника с тяжестью течения эндометриоза и наличием злокачественного процесса [67].
Кроме того, была продемонстрирована сниженная активность миРНК-125 [68], которая является супрессором генов человеческого эпидермального фактора роста 2 и 3 (HER2 и HER3). Повышенная активность этих генов отмечена в эндометриоидных очагах, а также в клетках рака яичника, развившегося из эндометриомы.
Как уже отмечалось ранее, прогрессирование эндометриоза в эндометриоидный рак зависит от активации онкогена KRAS и делеции гена PTEN. Инактивация последнего является ранним событием в опухолевой трансформации эндометриоза. PTEN служит мишенью миРНК-21, миРНК-26а, миРНК-214. Вероятнее всего, его активность в эндометриомах и раке яичника снижена в связи с повышенной активностью указанных миРНК [68, 69].
Заключение
Связь эндометриоза с повышенным риском малигнизации не оставляет сомнений.
Эндометриоз-ассоциированные опухоли представляют особый интерес для дальнейшего изучения.
В литературе описано большое число генов (PTEN, KRAS, PIK3CA, PPPR1A, ARID1A), мутация которых может быть предиктором или маркером малигнизации. Изменение экспрессии различных белков (p53, HNF-1β, кадгеринов и интегринов) обнаруживается в эндометриоз-ассоциированных опухолях.
Отмечено также специфичное микроокружение ткани эндометриоз-ассоциированного рака яичника, которое подтверждает особые черты данных опухолей и позволяет выделить их в отдельный вид патологического процесса.
Высокий уровень окислительного стресса и нарушенная работа макрофагов – характерные для эндометриоза факторы. С ними ассоциируется повышенный риск перехода ткани в злокачественную.
Поскольку эндометриоз – распространенное гинекологическое заболевание хронического и рецидивирующего течения, изучение рисков и механизмов малигнизации требует дальнейшего изучения.
Обзор подготовлен в рамках темы ФНИ № 1021062812154-3-3.2.2.
M.I. Yarmolinskaya, MD, PhD, Prof., A.S. Revenko, A.S. Denisova, PhD
The Research Institute of Obstetrics, Gynecology and Reproductology named after D.O. Ott
North-Western State Medical University named after I.I. Mechnikov
Contact person: Maria I. Yarmolinskaya, m.yarmolinskaya@gmail.com
Endometriosis-associated ovarian cancer is a particular group of tumors, that shares similar pathophysiological characteristics with endometrioid lesion. However, the carcinogenic pathway and malignant progression of endometrioid associated ovarian carcinoma remain poorly understood. The risk of malignant transformation is 1.2–1.9 times higher among patients with endometriosis.
This review focuses on different theories of endometrioid malignant transformation as well as genetic, molecular and immunological factors triggering cancer promotion.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.