Гипогликемическая терапия сахарного диабета 2 типа: проблемы долгосрочной безопасности
- Аннотация
- Статья
- Ссылки
- English
В статье приводятся данные многоцентровых международных исследований долгосрочной безопасности применения гипогликемических препаратов разных групп.
В статье приводятся данные многоцентровых международных исследований долгосрочной безопасности применения гипогликемических препаратов разных групп.
Распространенность сахарного диабета (СД) продолжает катастрофически увеличиваться. Если в 2000 г. в мире насчитывалось 171 млн (2,8%) больных, в 2015 г. – 415 млн, то к 2040 г., по прогнозам экспертов Международной федерации диабета (International Diabetes Federation – IDF), их число повысится на 55% – более 642 млн. Необходимо также учитывать, что в половине случаев (46,5%) сахарный диабет остается недиагностированным [1].
Поскольку сахарный диабет – хроническое заболевание, для его контроля пациенту необходимо принимать гипогликемические препараты пожизненно.
Поэтому встает вопрос не только об эффективности, но и безопасности такой терапии.
Лекарственная безопасность является одним из приоритетных направлений современной медицины и фармации. Его актуальность определяется динамическим ростом фарминдустрии, повышением сенсибилизации пациентов к химическим и биологическим веществам в результате полипрагмазии, применением недоброкачественных медикаментов (нарушение правил хранения, подделки и т.д.). Так, за последние 40 лет с фармацевтического рынка по разным причинам, связанным с недостаточной безопасностью, было изъято 130 лекарственных средств.
На сегодняшний день заболеваемость и смертность, ассоциированные с применением лекарств, – одна из основных проблем здравоохранения. «Лекарственные» болезни ежегодно уносят жизни 140–200 тыс. жителей США и занимают четвертое место среди причин смерти после сердечно-сосудистых, онкологических заболеваний и инсультов.
Наиболее уязвимыми оказываются пациенты детского и пожилого возраста. Побочные реакции терапии часто становятся независимой причиной госпитализации или продления ее сроков – с 6,8 до 10,6 дня. Следовательно, увеличиваются расходы здравоохранения. Так, финансовые затраты, связанные с нивелированием нежелательных эффектов препаратов, в США в 1995 г. составили 76,6 млрд долларов, в 2000 г. – более 177 млрд долларов, в странах Евросоюза – примерно 20% общего бюджета [2].
Нежелательные явления: вопросы терминологии, классификация
Под нежелательными явлениями (эффектами) понимается любое неблагоприятное изменение в состоянии пациента, получающего фармацевтический продукт. Данные изменения могут носить как субъективный, так и объективный характер. К последним, в частности, относятся аномальные значения лабораторных анализов.
Термины «нежелательные (побочные) реакции» и «нежелательные (побочные) эффекты» взаимозаменяемы. Однако первое используется применительно к пациенту, второе – к свойствам препарата.
Согласно классификации, разработанной комитетом экспертов Всемирной организации здравоохранения (World Health Organization – WHO), побочные реакции лекарственных средств подразделяются на четыре типа:
- тип А – зависимые от дозы препарата (обусловлены фармакологическими свойствами);
- тип В – независимые от дозы (аллергические (псевдоаллергические), идиосинкразия);
- тип С – при длительном приеме препарата (толерантность, синдром отмены, лекарственная зависимость, кумулятивные эффекты, эффекты подавления выработки гормонов);
- тип D – отсроченные эффекты (канцерогенные, мутагенные, тератогенные, эмбриотоксические).
Неблагоприятные побочные реакции типа D встречаются редко и носят дозозависимый характер.
Система фармаконадзора
Программа WHO по международному мониторингу лекарственных средств реализуется с 1968 г. Фармаконадзор – это научные исследования и виды деятельности, связанные с выявлением, оценкой, пониманием и предотвращением побочных эффектов или любых других проблем, связанных с препаратом.
В настоящее время участниками данной программы являются 86 стран, в том числе Россия (с 1997 г.) [3].
Координирующий центр, расположенный в Уппсале (Швеция), отвечает за ведение глобальной базы данных о побочных реакциях – Виджибэйс. Сегодня база данных насчитывает более 5 млн сообщений.
В нашей стране контроль безопасности лекарств осуществляется в соответствии с Федеральным законом от 05.06.1998 № 86 «О лекарственных средствах».
В октябре 2007 г. на базе Научного центра экспертизы средств медицинского применения создан Федеральный центр мониторинга безопасности. Источниками информации о побочных реакциях препаратов служат данные постмаркетинговых клинических исследований, спонтанные сообщения, мониторинг данных стационара, рецептурный мониторинг, результаты метаанализов.
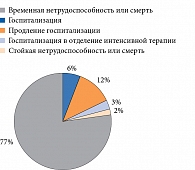
В то же время многие исследователи отмечают, что при развитии побочных реакций вследствие приема лекарственных средств лишь небольшая часть пациентов обращается к врачам – 10 из 36%. В лучшем случае это заканчивается временной нетрудоспособностью, в худшем – стойкой утратой трудоспособности или смертью больного (рисунок) [4].
Изучение безопасности гипогликемических препаратов
Началом активного изучения отдаленных результатов антидиабетической терапии следует считать 60–70-е гг. прошлого века. Результаты исследования UGDP (1960–1968 гг.) показали повышение риска сердечно-сосудистой смерти у больных СД, получавших препараты сульфонилмочевины первой генерации – толбутамид, ацетогексамид, толазамид и хлорпропамид [5].
Был сделан вывод: производные сульфонилмочевины (первой генерации) повышают риск смерти больных СД. По этой причине данные препараты были названы убийцами и запрещены к использованию в США и ряде других стран.
Последующий многократный анализ полученных данных позволил объяснить неуспех университетского исследования и сделать окончательный вывод. Производные сульфонилмочевины (ПСМ) представляют опасность только для пациентов с серьезными сердечно-сосудистыми заболеваниями.
В 80-е гг. прошлого века получены производные сульфонилмочевины второй генерации. Они отличались большей эффективностью при меньшей токсичности и имели дозы в 100 раз ниже. Речь, в частности, идет о глипизиде, глибенкламиде, глибуриде, глимепириде, гликлазиде (Диабетон МВ, «Лаборатории Сервье», Франция) и гликвидоне. Указанные препараты используются и в настоящее время.
В дальнейшем изучение отдаленных последствий лечения разными антигипергликемическими препаратами продолжилось. Наибольший интерес представляют такие, как канцерогенность, тератогенность, сердечно-сосудистые осложнения: острое нарушение мозгового кровообращения (ОНМК), острый инфаркт миокарда (ОИМ), сердечно-сосудистая смерть [6].
Применение сахароснижающих препаратов и риск развития рака
Эпидемиологические наблюдения свидетельствуют о том, что пациенты с СД подвергаются существенно более высокому риску образования различных типов опухолей.
С одной стороны, СД 2 типа и рак имеют много общих факторов развития, однако потенциальные биологические связи между заболеваниями до конца не ясны. С другой – результаты наблюдательных исследований показали, что некоторые препараты, используемые для коррекции гликемии, могут как повышать, так и снижать риск развития рака [7].
Бигуаниды
Препараты группы бигуанидов не стимулируют секрецию инсулина, но, увеличивая периферическую утилизацию глюкозы тканями через активирование пострецепторных механизмов действия инсулина и транспортеров глюкозы, уменьшают инсулинорезистентность. Второй важный механизм их действия – замедление глюконеогенеза и снижение продукции глюкозы печенью посредством ингибирования окисления липидов. В настоящее время используется только диметилбигуанид – метформин.
Снижение риска развития онкологических заболеваний у пациентов, принимавших метформин, продемонстрировано в ряде исследований. Наибольший интерес представляет работа S.L. Bowker и соавт. (2006). Авторами обследовано 10 309 пациентов с СД 2 типа, которым впервые были назначены метформин, ПСМ и инсулин. Средний возраст больных – 63,4 ± 13,3 года. 55,0% участников – мужчины. Частота смертей от рака составила 4,9% (162 из 3340) среди получавших ПСМ, 3,5% (245 из 6969) – метформин и 5,8% (84 из 1443) – инсулин. Полученные результаты продемонстрировали двукратное увеличение частоты развития онкологических заболеваний в группе инсулинотерапии по сравнению с группой терапии метформином – относительный риск (ОР) 1,9 (95%-ный доверительный интервал (ДИ) 1,5–2,4, p < 0,0001). В группе ПСМ такой риск также оказался значительно выше – 1,3 (95% ДИ 1,1–1,6, p = 0,012) [8].
Риск злокачественных новообразований у больных СД 2 типа в зависимости от вида проводимой терапии изучали C.J. Currie и соавт. [9]. В ретроспективное когортное исследование было включено 62 809 пациентов с СД 2 типа старше 40 лет. Участников разделили на четыре группы: монотерапия метформином (31 421) или ПСМ (7439), комбинированная терапия метформином и ПСМ (13 882) и инсулинотерапия (10 067). Исследователи регистрировали любую форму солидной опухоли или рак молочной железы, толстой кишки, поджелудочной железы или простаты. Наименьший ОР был отмечен у принимавших метформин. Для сравнения – при применении комбинированной терапии «метформин + ПСМ» (по сравнению с монотерапией метформином) ОР составил 1,08 (95% ДИ 0,96–1,21), ПСМ – 1,36 (95% ДИ 1,19–1,54), различных режимов инсулина – 1,42 (95% ДИ 1,27–1,60). Инсулинотерапия по сравнению с терапией метформином повышала риск развития колоректального рака – ОР 1,69 (95% ДИ 1,23–2,33), рака поджелудочной железы – 4,63 (95% ДИ 2,64–8,10), но не влияла на риск развития рака молочной железы, простаты. Риски при лечении ПСМ и инсулином были практически одинаковыми. Сделан вывод: секретагоги и инсулин чаще приводят к развитию солидного рака по сравнению с метформином. Комбинация с последним значительно снижает указанный риск. Использование аналогов инсулина не ассоциируется с повышенным риском развития рака по сравнению с использованием человеческого инсулина.
При анализе полученных данных установлено, что в группе пациентов, получавших метформин, значительно снижался риск развития рака толстой кишки и поджелудочной железы. Однако такой закономерности не наблюдалось в отношении рака предстательной и молочной железы. Редуцирование роста злокачественных клеток на фоне монотерапии метформином составило 0,54 (95% ДИ 0,43–0,66).
Даже добавление метформина к проводимой сахароснижающей терапии уменьшало риск малигнизации до 0,54 (95% ДИ 0,43–0,66).
Необходимо отметить, что применение метформина при синдроме поликистозных яичников, который характеризуется инсулинорезистентностью и выступает в качестве фактора риска развития рака тела матки, способствует нивелированию возможной атипической гиперплазии эндометрия.
Интерес представляют исследования российских ученых, в которых бигуаниды наряду с гиполипидемическими препаратами и диетой назначались на длительный срок более чем 300 больным раком молочной железы и толстой кишки, подвергшимся оперативному лечению. Через три – семь месяцев наблюдения зафиксировано повышение кумулятивной выживаемости [10].
Противоопухолевый эффект метформина, скорее всего, связан с активацией циклической аденозинмонофосфат-зависимой протеинкиназы (АМПК), контролирующей обмен глюкозы и липидов. АМПК активирует путь аденозинмонофосфат/аденозинтрифосфат (АМФ/АТФ). Последний играет ключевую роль в клеточном энергетическом балансе за счет увеличения уровня АТФ. Известно, что многие метаболические эффекты метформина реализуются в присутствии АМПК, в том числе ингибирование mTOR (mammalian target of rapamycin) с последующим восстановлением чувствительности клеток к инсулину и снижением гиперинсулинемии как фактора развития опухолей. Кроме того, mTOR регулирует многие звенья клеточного метаболизма, в том числе биосинтез аминокислот, гомеостаз глюкозы, жировой обмен, играя существенную роль в адипогенезе и накоплении липидов. Таким образом, mTOR-киназа объединяет клеточные сигналы от факторов роста, питания и скорости метаболизма для регуляции синтеза белка и роста клеток [11].
Использование рапамицина, ингибитора mTOR, и его производных при лечении некоторых онкологических заболеваний оказало положительный эффект.
Производные сульфонилмочевины
Действие ПСМ направлено на стимулирование секреции инсулина бета-клетками островков Лангерганса для преодоления имеющейся инсулинорезистентности и восполнения дефицита инсулина.
В упомянутом выше исследовании C.J. Currie и соавт. [9] монотерапия ПСМ характеризовалась высоким риском развития онкопатологии – 1,36 (95% ДИ 1,19–1,54).
Убедительные данные представлены M. Monami и соавт. (2009) [12], которые оценили заболеваемость раком у пациентов с СД 2 типа, получавших разные препараты ПСМ. В опытную группу вошли 195 пациентов (средний возраст 69,0 ± 9,2 года), у которых за период наблюдения появились злокачественные новообразования. В контрольную – 195 больных, у которых за период наблюдения рак не развился. Пары подбирали по возрасту, полу, длительности диабета, индексу массы тела, уровню гликированного гемоглобина (HbA1c), наличию сопутствующих заболеваний, вредных привычек (курение и злоупотребление алкоголем). Воздействие сахароснижающих препаратов оценивали в течение десяти лет до наступления события либо соответствующей индексной даты.
После поправки результатов относительно приема сопутствующих препаратов установлено, что терапия метформином или гликлазидом (Диабетоном МВ) более 36 месяцев достоверно снижает риск развития рака (скорректированный ОР 0,28 (95% ДИ 0,13–0,57), p < 0,001 и 0,40 (95% ДИ 0,21–0,57), p = 0,004 соответственно). Применение глибенкламида не менее 36 месяцев, наоборот, ассоциировалось с возрастанием указанного риска (скорректированный ОР 2,62 (95% ДИ 1,26–5,42), p = 0,009). Лечение инсулином, глитазонами и/или акарбозой не характеризовалось значимыми различиями в заболеваемости раком. Таким образом, ПСМ при длительном лечении по-разному влияют на риск развития рака. Представляется важным дальнейшее изучение возможного защитного действия гликлазида (Диабетона МВ), а также степени риска, связанного с применением глибенкламида.
Многофакторный анализ показал, что терапия не менее 36 месяцев стимуляторами секреции инсулина, препаратами, повышающими чувствительность к инсулину (сенситайзерами), инсулином или акарбозой достоверно не влияет на риск злокачественных новообразований (скорректированный ОР 0,72 (95% ДИ 0,43–1,19), 0,85 (95% ДИ 0,52–1,39), 1,01 (95% ДИ 0,64–1,59) и 0,65 (95% ДИ 0,11–3,95) соответственно).
После поправки на прием других сахароснижающих препаратов терапия метформином более 12 или 36 месяцев ассоциировалась с достоверным снижением риска развития рака (p < 0,001 для обоих сравнений), в то время как терапия тиазолидиндионами (глитазонами), инсулином или акарбозой не влияла на таковой.
Инкретины
Два недавно разработанных класса препаратов либо усиливают (ингибиторы дипептидилпептидазы 4 (иДПП-4)), либо имитируют эффект гормонов кишечника – инкретинов (агонисты глюкагоноподобного пептида 1 (аГПП-1)). В результате улучшается глюкозозависимая секреция инсулина, уменьшаются постпрандиальные уровни глюкагона и замедляется опорожнение желудка. Первым представителем класса миметиков инкретина стал эксенатид, который гомологичен ГПП-1 примерно на 50%.
У мышей и крыс на фоне введения лираглутида в дозах, существенно превышающих используемые при лечении СД 2 типа, описано развитие С-клеточной гиперплазии и С-клеточных опухолей, включая карциномы. Однако в отношении человека на данный момент подобного эффекта препарата не доказано.
В то же время в клинических исследованиях, в том числе долгосрочных, отмечалось умеренное повышение уровня кальцитонина [13]. Данные препараты противопоказаны при наличии семейных форм медуллярного рака щитовидной железы или синдроме множественной эндокринной неоплазии 2 типа.
В исследованиях на животных показано, что инкретины усиливают транскрипцию гена инсулина, активируют пролиферацию бета-клеток, ингибируют их апоптоз, способствуют неогенезу [14, 15].
Результаты клинических исследований продемонстрировали безопасность как аГПП-1, так и иДПП-4 в отношении риска развития онкологических заболеваний.
Однако опыт применения указанных препаратов относительно небольшой (в России более 10 лет), поэтому необходим более длительный период наблюдения.
Инсулин и его аналоги
Согласно данным, полученным как в условиях in vitro, так и в некоторых многоцентровых исследованиях, препараты инсулина способны увеличивать риск злокачественных новообразований у пациентов с СД. Однако потенциальный риск не сопоставим с реальной пользой – возможностью длительного контроля гликемии и, как следствие, предотвращением развития микрососудистых осложнений. Кроме того, инсулин воздействует на уже образовавшиеся раковые клетки и не вызывает роста новых.
Поэтому консультативная группа Европейской ассоциации по изучению диабета (European Association for the Study of Diabetes – EASD) инициировала проведение независимых исследований для определения связи между инсулинотерапией и частотой злокачественных новообразований. Особенно актуально было подтвердить безопасность использования аналогов инсулина, поскольку это вызывает наибольшую тревогу.
В 2009 г. L.G. Hemkens и соавт. [16] при сравнении эффектов разных типов инсулина у больных диабетом зафиксировали увеличение риска малигнизации при применении инсулина гларгин.
Исследователи проанализировали данные 127 031 пациента. Большая часть больных страдала СД 2 типа, их средний возраст – 67 лет. 39% пациентов получали инсулин. Всех участников разделили на четыре группы: первая – 95 804 (75,4%) пациентов – получала только человеческий инсулин, вторая – 4103 (3,2%) – инсулин аспарт, третья – 3269 (2,6%) – инсулин лизпро, четвертая – 23 855 (18,8%) пациентов – инсулин гларгин.
В каждой группе проводилось дополнительное титрование дозы препаратов, что позволило сделать вывод о существовании дозозависимого эффекта инсулинотерапии на риск малигнизации. Это значительно усложнило объективную оценку полученных результатов. Так, частота развития рака среди применявших человеческий инсулин превышала таковую среди применявших аналоги инсулина. Однако дозы человеческого инсулина были значительно выше – средняя доза человеческого инсулина 37 Ед/сут, инсулина гларгин 22 Ед/сут. При введении стандартной дозы как человеческого, так и инсулина гларгин (50 Ед/сут) риск развития рака составлял 1,57 (95% ДИ 1,54–1,60) и 1,78 (95% ДИ 1,68–1,89) соответственно.
Плюсами исследования стали большой объем базы данных и продолжительный период наблюдения (с января 2001 по июнь 2005 г.), недостатком – маленький период применения инсулина гларгин (1,31 года). Следовательно, полученные результаты не могут в полной мере отражать риск развития рака в течение жизни. Тем не менее, если считать стимуляцию роста раковых клеток одним из пусковых факторов малигнизации клеток, можно предположить, что и результат воздействия препарата, обладающего данным свойством, проявится в более ранние сроки. Необходимо также учитывать средний возраст пациентов и отсутствие данных по разным возрастным группам и органоспецифичности.
Шотландское исследование включало пациентов, получавших инсулин с 2002 по 2004 г. [17]. Первая группа применяла инсулин гларгин (447 (1,2%) больных), вторая – инсулин гларгин в комбинации с любым другим инсулином сравнения (3512 (9,7%) пациентов), третья – любой инсулин, за исключением инсулина гларгин (32 395 (89,1%) пациентов). Изучался риск озлокачествления клеток в наиболее уязвимых при СД тканях: молочной и предстательной железы, желудочно-кишечного тракта.
Увеличение риска малигнизации при использовании инсулина гларгин по сравнению с использованием инсулина нейтрального протамина Хагедорна (НПХ) не зафиксировано – 1,55 (95% ДИ 1,01–2,37) против 1,02 (95% ДИ 0,77–1,36). Риск новообразований в молочной железе не превышал средние показатели риска в популяции. Следует учесть, что средний возраст пациентов, получавших инсулин гларгин, составлял 68 лет, получавших другие виды инсулина – 55 лет, комбинированную терапию – 41 год. Это могло повлиять на полученный результат.
Кроме того, средний индекс массы тела был выше в группе инсулина гларгин – 30 кг/м2 (в других группах 26,8 и 28,9 кг/м2 соответственно), что также могло существенно повлиять на оценку данных. Установлено, что ожирение и инсулинорезистентность относятся к факторам риска малигнизации.
Недостатками исследования следует считать небольшое количество пациентов, получавших инсулин гларгин, и непродолжительный период наблюдения.
В шестилетнем рандомизированном клиническом исследовании ORIGIN, направленном на оценку эффектов терапии инсулином гларгин по сравнению с эффектами стандартной терапии на исходы сердечно-сосудистых заболеваний, не было обнаружено какой-либо связи между применением инсулина гларгин и повышением риска развития любого онкологического заболевания (ОР 1,0, р = 0,97). Ни совокупный анализ по всем видам рака, ни анализ по конкретным типам опухолей не показали повышения риска для пациентов, получавших инсулин гларгин [18].
В исследовании C.J. Currie и соавт. [9] при анализе данных 2286 пациентов на монотерапии инсулином гларгин и 1262 пациентов на терапии НПХ-инсулином связи между видом используемого инсулина и риском малигнизации клеток не установлено. Более того, при добавлении к схеме лечения бигуанидов (метформина) отмечалось редуцирование случаев образования раковых опухолей. Однако, несмотря на трехлетний период наблюдения, сравнение результатов групп в зависимости от величины дозы, возраста, длительности заболевания не проводилось.
Выводы описанных выше работ неоднозначны, во многом противоречивы и, следовательно, не могут быть основанием для отмены терапии инсулином гларгин. Для определения дальнейшей тактики и выявления фактов влияния инсулина гларгин на рост раковых клеток необходимо проведение дополнительных проспективных клинических исследований в разных странах с детальным изучением дозозависимости, если такая существует, и определением частоты развития онкопатологии среди лиц разных возрастных групп.
Исходя из опубликованных на сегодняшний день данных, нельзя однозначно утверждать, что ПСМ, человеческий инсулин или его аналоги, инкретины или тиазолидиндионы влияют на возрастание риска развития онкологических заболеваний. Для подобного вывода нет достаточного количества убедительных данных. В то же время неоспоримо, что метформин является антионкогеном. Это доказано в экспериментальных и клинических исследованиях.
Сердечно-сосудистая безопасность сахароснижающих препаратов
Гипергликемия признана одним из основных факторов риска развития и прогрессирования сердечно-сосудистых заболеваний.
Результаты многочисленных исследований доказали, что нормализация углеводного обмена в значительной степени снижает риск развития и прогрессирования микрососудистых осложнений СД, таких как ретинопатия, нефропатия. Однако достоверно значимого ее влияния на риск развития основных неблагоприятных макрососудистых событий: инфаркта миокарда, инсульта, смерти от сердечно-сосудистых причин – не отмечено.
Для оценки рисков заболеваемости и смертности, связанных с СД, проведен анализ 102 проспективных исследований, включавших 698 782 пациентов без инфаркта миокарда, стенокардии и инсульта в анамнезе [19]. Было показано, что между гликемией натощак и сосудистым риском существует нелинейная (U-образная) зависимость, последний прогрессивно увеличивается при уровне глюкозы натощак более 5,59 ммоль/л. Наиболее эффективным для снижения риска неблагоприятных сердечно-сосудистых событий является мультифакторный подход. Он подразумевает одновременное воздействие на основные факторы риска: дислипидемию, артериальную гипертензию, гипергликемию. Однако интенсивная стратегия контроля гликемии сопряжена с увеличением количества гипогликемических эпизодов.
Метаанализ результатов исследований ACCORD, ADVANCE, VADT, UKPDS, проведенный F. Turnbull и соавт. (2009) [20], показал, что интенсивная стратегия контроля гликемии уменьшает риск основных неблагоприятных сердечно-сосудистых событий на 9%, инфаркта миокарда – на 15%, однако частота эпизодов гипогликемии возрастает в 2,48 раза.
Многочисленные исследования свидетельствуют, что гипогликемические состояния опасны для пациентов с сердечно-сосудистыми заболеваниями. На фоне гипогликемий увеличивается количество эпизодов ишемии миокарда, нарушений ритма сердца, изменяются показатели свертывающей системы крови, активируется симпатоадреналовая система.
В связи с вышесказанным безопасность терапии во многом определяется риском развития гипогликемических состояний.
Для того чтобы снизить риск развития гипогликемических состояний и связанных с ними нежелательных тяжелых последствий, сегодня установлены индивидуальные целевые значения показателей гликемии для пациентов с СД 2 типа в зависимости от возраста, наличия сосудистых осложнений и заболеваний, а также состояний, способствующих развитию гипогликемий [21].
Возникает вопрос: оказывает ли влияние характер сахароснижающей терапии на риск развития инфаркта миокарда и смерти от сердечно-сосудистых заболеваний [22]?
Производные сульфонилмочевины
Наиболее высокий риск развития гипогликемии наблюдается при приеме инсулина и ПСМ. Последние воздействуют на АТФ-зависимые калиевые каналы. Препараты ПСМ обладают различной селективностью и способностью влиять на процессы ишемического прекондиционирования. Поэтому были проведены исследования по оценке риска общей и сердечно-сосудистой смерти при использовании различных препаратов данной группы.
Для определения риска развития инфаркта миокарда и смерти от него в зависимости от предшествующей сахароснижающей терапии S.P. Johnsen и соавт. было проведено популяционное исследование «случай – контроль», охватившее 6636 больных, впервые госпитализированных по поводу инфаркта миокарда с 1994 по 2002 г. Авторы использовали данные национального регистра Hospital Discharge Registry [23]. Были также проанализированы истории болезни 66 839 пациентов соответствующего возраста и пола, имевших факторы риска развития инфаркта миокарда. Применение любого сахароснижающего препарата ассоциировалось с риском развития заболевания. Для пациентов, принимавших не менее 90 дней перед госпитализацией так называемые старые ПСМ (глибенкламид, хлорпропамид, глипизид), скорректированный ОР составил 2,07 (95% ДИ 1,81–2,37), новые ПСМ – 1,36 (95% ДИ 1,01–1,84), p = 0,01. Риск развития инфаркта миокарда у получавших инсулин был выше, чем у получавших пероральные сахароснижающие препараты (p < 0,005). Оцениваемый риск был сопоставим у препаратов, не относящихся к группе ПСМ (метформин – 78% больных, акарбоза – 19%, репаглинид – 3% больных), и новых ПСМ. Терапия комбинацией пероральных сахароснижающих препаратов не ассоциировалась с риском развития инфаркта миокарда. Однако отсутствие сахароснижающей терапии у больных СД 2 типа было связано с максимальным риском госпитализации по поводу инфаркта миокарда. При анализе более длительной сахароснижающей терапии – в течение 180 дней до госпитализации – существенных различий между разными группами терапии получено не было.
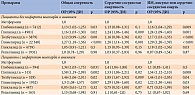
T.R. Schramm и соавт. [24] изучали смертность и сердечно-сосудистый риск на фоне приема различных секретагогов по сравнению с метформином у больных СД 2 типа, перенесших инфаркт миокарда, и без такового. В исследование включали пациентов старше 20 лет, начавших терапию секретагогами или метформином. Период наблюдения – с 1997 по 2006 г. Большинство пациентов (77%) получали секретагоги или метформин в виде монотерапии в течение всего периода наблюдения (в среднем 3,3 года). Проанализированы данные 107 806 пациентов, из них 9607 с инфарктом миокарда в анамнезе. В качестве конечных точек выбраны общая, сердечно-сосудистая смертность и комбинированная точка, включавшая инфаркт миокарда, инсульт или сердечно-сосудистую смерть. Достоверное повышение риска общей смертности и достижения комбинированной точки отмечено на фоне терапии глибенкламидом у пациентов с инфарктом миокарда и без такового в анамнезе. Статистически значимые различия зафиксированы и в отношении риска сердечно-сосудистой смерти (табл. 1). Аналогичные данные получены в группах других неселективных ПСМ – толбутамида, глипизида и глимепирида. При этом риск общей и сердечно-сосудистой смерти при приеме гликлазида и репаглинида значимо не отличался от такового при приеме метформина.
По показателям «общая смертность», «сердечно-сосудистая смертность» самыми безопасными оказались препараты гликлазид (Диабетон МВ) и репаглинид.
Анализ украинского национального регистра [25], включившего 64 288 пациентов, получавших глибенкламид (n = 50 341), глимепирид (n = 2479) или гликлазид (n = 11 368), продемонстрировал достоверно меньший риск общей смертности на терапии гликлазидом и глимепиридом по сравнению с терапией глибенкламидом – 0,33 (95% ДИ 0,26–0,41), р < 0,001 и 0,605 (95% ДИ 0,413–0,886), р < 0,001 соответственно. В отношении сердечно-сосудистой смертности достоверное снижение риска по сравнению с глибенкламидом отмечалось только в группе гликлазида – 0,29 (95% ДИ 0,21–0,38), р < 0,001.
Многоцентровое проспективное исследование ADVANCE и его продленная фаза ADVANCE-ON подтвердили, что эффективный гликемический контроль с помощью гликлазида МВ способствует снижению риска развития и прогрессирования диабетической нефропатии у больных СД 2 типа. При этом положительный эффект сохраняется в течение нескольких лет после завершения интервенции. Кроме того, терапия гликлазидом МВ не повышает частоту сердечно-сосудистых событий у пациентов с высоким сердечно-сосудистым риском, в том числе при длительном постинтервенционном наблюдении.
Сопоставление результатов исследования ADVANCE – ADVANCE-ON c результатами других проспективных исследований позволяет предположить, что гликлазид МВ способен сократить частоту макрососудистых событий у пациентов более молодого возраста с относительно коротким анамнезом диабета, у которых отсутствуют органические изменения сердечно-сосудистой системы [26].
Тиазолидиндионы
Примером развития нежелательных реакций уже в постмаркетинговый период является история с росиглитазоном.
В 2007 г. были опубликованы результаты метаанализа 42 исследований, свидетельствующие о достоверном увеличении риска развития инфаркта миокарда и пограничном (недостоверно значимом) увеличении сердечно-сосудистой смерти у больных, принимавших росиглитазон (основная группа – 15 565 больных, контрольная – 12 282) [27]. В группе росиглитазона ОР развития острого инфаркта миокарда составил 1,43 (95% ДИ 1,03–1,98), р = 0,03, а смерти от сердечно-сосудистых причин – 1,64 (95% ДИ 0,98–2,74), р = 0,06. Результаты промежуточного анализа в исследовании RECORD, полученные через 3,75 года от его начала, показали значительное увеличение риска развития сердечной недостаточности у больных, принимавших росиглитазон (ОР 2,15 (95% ДИ 1,3–3,75), p = 0,003) [28]. Это стало основанием для досрочного прекращения исследования.
После публикации в июне 2010 г. результатов двух исследований об увеличении количества сердечно-сосудистых катастроф на фоне приема росиглитазона [29, 30] уполномоченное подразделение Европейского медицинского агентства (European Medicines Agency – ЕМА) ограничило его применение, поскольку риск терапии значительно превышал ее пользу.
В 23 сентября 2010 г. ЕМА рекомендовало отозвать препараты, содержащие росиглитазон, с европейского рынка.
На сегодняшний день пиоглитазон остается единственным представителем данного класса, разрешенным к применению у больных СД 2 типа при наличии инсулинорезистентности и ожирения. Препарат не разрешается применять при сердечной недостаточности III–IV функционального класса по классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association – NYHA). С осторожностью – при сердечной недостаточности I–II функционального класса (NYHA). Лечение пациентов с ишемической болезнью сердца необходимо проводить с большой осторожностью. При остром инфаркте миокарда препарат должен быть отменен.
После истории с росиглитазоном Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) были определены требования к фармпроизводителям, согласно которым антидиабетический препарат может быть зарегистрирован для применения в реальной клинической практике на основании данных не только о достаточном сахароснижающем потенциале (динамика HbA1с не менее 0,6%), но и сердечно-сосудистой и общей безопасности [31]. Были также обозначены основные конечные точки, связанные с сердечно-сосудистыми исходами, – MACE. К ним относятся частота летальных исходов, связанных с сердечно-сосудистыми событиями, нефатальным инфарктом миокарда и нефатальным инсультом.
В июле 2008 г. экспертный комитет по эндокринологическим и метаболическим препаратам FDA выпустил руководство по оценке безопасности таблетированных сахароснижающих препаратов в отношении сердечно-сосудистых рисков в пре- и постмаркетинговых исследованиях. В результате существенно изменились оценка новых сахароснижающих препаратов и процедура вывода их на рынок. В руководстве рекомендуется использовать независимые сердечно-сосудистые конечные точки в фазах II и III клинических исследований; включать в исследование пациентов с высоким риском развития сердечно-сосудистых заболеваний; после одобрения препарата к применению проводить метаанализ сердечно-сосудистых событий фаз II и III клинических исследований и исследования по оценке сердечно-сосудистой безопасности. После опубликования указанного руководства количество исследований по оценке сердечно-сосудистой безопасности увеличилось в два раза, среднее число пациентов, включенных в исследование по оценке сердечно-сосудистых рисков в течение первых 36 месяцев, – в шесть раз.
Основная цель исследований сердечно-сосудистой безопасности новых сахароснижающих препаратов, в том числе и инкретинов, – показать отсутствие увеличения сердечно-сосудистого риска при использовании препаратов в рамках традиционных схем лечения по сравнению с приемом плацебо. Данные исследования не предназначены для проверки гипотезы о возможном преимуществе в виде снижения уровня HbA1c. Результаты контроля уровня глюкозы, оцениваемого по уровню HbA1c, должны быть сходными в двух группах при подборе гипогликемических средств в соответствии с местными руководствами по лечению. Сердечно-сосудистая безопасность и преимущества должны определяться независимо от оценки уровня HbA1c.
Инкретины
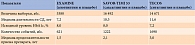
В 2014 г. были опубликованы результаты двух международных исследований по изучению сердечно-сосудистой безопасности ингибиторов ДПП-4 – SAVOR [32] и EXAMINE [33]. На основании полученных данных сделано заключение, что у пациентов с СД 2 типа и высоким сердечно-сосудистым риском добавление к стандартному лечению саксаглиптина не приводит ни к снижению, ни к повышению риска достижения первичной комбинированной конечной точки (смерть от сердечно-сосудистых заболеваний, инфаркт миокарда, ишемический инсульт). Терапия алоглиптином у больных с СД 2 типа и недавним острым коронарным синдромом не ассоциировалась с увеличением основных неблагоприятных сердечно-сосудистых событий по сравнению с плацебо (табл. 2).
Однако в исследовании SAVOR зафиксировано достоверное увеличение частоты госпитализаций в связи с сердечной недостаточностью. Авторы исследования рекомендовали избегать назначения саксаглиптина пациентам с сердечной недостаточностью. Данные результаты стали поводом усомниться в безопасности всего класса препаратов.
Однако в июле 2015 г. были представлены результаты исследования TECOS, в котором оценивалось влияние ситаглиптина на частоту сердечно-сосудистых событий, развитие панкреатита и рака поджелудочной железы по сравнению с плацебо. Через три года наблюдения у пациентов с СД 2 типа и установленными сердечно-сосудистыми заболеваниями добавление ситаглиптина к ранее назначенной терапии не привело к повышению риска серьезных сердечно-сосудистых событий, частоты госпитализации в связи с сердечной недостаточностью и риска развития других побочных реакций [34]. Результаты исследования реабилитировали иДПП-4 в отношении сердечно-сосудистой безопасности.
Изучение сердечно-сосудистой безопасности еще одного препарата данного класса линаглиптина еще продолжается.
В ноябре 2015 г. опубликованы результаты исследования empa-reg outcome [35], изучавшего влияние эмпаглифлозина при добавлении к стандартной терапии на частоту сердечно-сосудистых осложнений и смерти у пациентов с СД 2 типа. Лечение получили 7020 пациентов. Средняя продолжительность наблюдения составила 3,1 года. Значимых различий в частоте инфаркта миокарда или инсульта (по сравнению с плацебо) не выявлено. Однако в группе эмпаглифлозина были достоверно ниже сердечно-сосудистая смертность – 3,7 против 5,9% в группе плацебо (относительное снижение риска на 38%), частота госпитализации по поводу сердечной недостаточности – 2,7 и 4,1% соответственно (относительное снижение риска на 35%), общая смертность – 5,7 и 8,3% соответственно (относительное снижение риска на 32%).
Суммируя сказанное, можно предположить, что новые группы препаратов могут быть перспективны и безопасны в отношении риска развития сердечно-сосудистых осложнений у больных СД 2 типа. Однако, учитывая, что все исследования были недостаточно продолжительными, для того чтобы сделать окончательный вывод, представляется целесообразным проведение более длительного наблюдения.
Другие нежелательные реакции сахароснижающей терапии
При проведении исследований был установлен еще ряд побочных эффектов антигипергликемических препаратов. Так, в исследовании empa-reg outcome [35] среди пациентов, получавших эмпаглифлозин, отмечалось повышение частоты генитальных инфекций без увеличения частоты других нежелательных явлений.
Повышение частоты инфекций мочевыводящих путей (ИМП) зарегистрировано при применении ингибиторов натрий-глюкозного котранспортера 2 типа (sodium-glucose cotransporter type 2 – SGLT-2). Это новый класс пероральных сахароснижающих препаратов для лечения СД 2 типа, механизм действия которых направлен на снижение реабсорбции глюкозы в почечных канальцах и ее выведение с мочой. После приема первой таблетки выводится 70–100 г глюкозы.
В настоящее время в России зарегистрированы три препарата этого класса: дапаглифлозин, канаглифлозин и эмпаглифлозин.
Данные 12 рандомизированных плацебоконтролируемых исследований [36, 37] показали, что распространенность ИМП выше в группе дапаглифлозина, чем в группе плацебо, – 5,7 и 4,3% (для 5 и 10 мг препарата) и 3,7% соответственно. Как правило, ИМП развивались в первые месяцы лечения и в дальнейшем редко рецидивировали.
Пиелонефрит развивался с одинаковой частотой в обеих группах (0,1%). Чаще ИМП отмечались у женщин. При бактериологическом исследовании были обнаружены Escherichia coli, Klebsiella spp., Proteus spp. Стандартная антибактериальная терапия в большинстве случаев была эффективной.
Распространенность генитальных инфекций в той же популяции в группе дапаглифлозина составила 5,7 и 4,8% (для 5 и 10 мг препарата соответственно) случаев, в группе плацебо – 0,9%. Эти инфекции чаще фиксировались у женщин в начале лечения, хорошо купировались стандартной терапией и не приводили к исключению из исследования.
Данные побочные эффекты, по всей видимости, присущи данному классу сахароснижающих препаратов. Они также наблюдались при применении канаглифлозина и эмпаглифлозина [38].
Поэтому назначение дапаглифлозина пациентам с инфекциями мочевыводящих путей разрешено с осторожностью. Профилактическое использование антибиотиков у получающих данный препарат не рекомендуется. В случае развития пиелонефрита или уросепсиса препарат следует отменить.
Среди других нежелательных эффектов дапаглифлозина указывают дизурию. По данным проведенных исследований, она регистрируется у 2,1% больных. Помимо глюкозурии действие препарата приводит к выведению еще 375 мл жидкости в сутки, что составляет примерно одно дополнительное мочеиспускание. У 0,5% больных наблюдалась никтурия. Дополнительное выведение жидкости может иметь значение у больных с низким объемом циркулирующей крови и склонных к гипотонии. Поэтому необходимо соблюдать осторожность при назначении препарата пациентам, для которых снижение артериального давления может представлять риск, например лицам с сердечно-сосудистыми заболеваниями, получающим антигипертензивную терапию, со случаями гипотензии в анамнезе.
Важно отметить, что частота нежелательных реакций, связанных со снижением объема циркулирующей крови или нарушением функции почек, была выше среди больных старше 65 лет.
Для предотвращения побочных реакций необходимо четко следовать инструкции к препаратам.
Сохраняется настороженность в отношении возможной связи терапии инкретинами и развитием острого панкреатита. Известно, что острый панкреатит развивается в два-три раза чаще у больных СД 2 типа, чем в здоровой популяции.
J.S. Nachnani и соавт. [39] при изучении влияния ГПП-1 на состояние клеток поджелудочной железы крыс отметили появление признаков хронического панкреатита. Период наблюдения – 75 суток. В исследование были включены 10 самцов в возрасте восьми недель, которым ежедневно вводили 10 г эксенатида на кг массы тела. При проведении гистологического анализа выявлены изменение обычной гроздьевидной структуры клеток, толщины мембраны и фиброзирование клеточной мембраны, отечность и гиперемия, сопровождающиеся повышением амилазы в крови. Клинических признаков, снижения аппетита, изменения поведения и болевого синдрома не зафиксировано.
Случаи острого панкреатита зарегистрированы в период постмаркетингового применения практически у всех препаратов иДПП-4 и аГПП-1. Поводом для сомнений в безопасности указанных классов препаратов стали данные, полученные при анализе системы отчетов о нежелательных явлениях (Adverse events reporting system – AERS), поддерживаемой FDA. Анализировались спонтанные сообщения о случаях острого панкреатита, рака поджелудочной железы и щитовидной железы при приеме ситаглиптина и эксенатида с 2004 по 2009 г. [40]. В качестве терапии взяты росиглитазон, натеглинид, репаглинид, глипизид. Более высокий риск развития панкреатита, рака поджелудочной железы регистрировался при приеме инкретинов. FDA сочло, что данные, поступающие в AERS, не могут быть использованы для расчета рисков нежелательных явлений в популяции США – добровольные сообщения получены от популяции неопределенного размера, невозможно достоверно оценить частоту этих эффектов или установить причинно-следственную связь с длительностью применения препарата.
Однако в инструкции к препаратам были внесены дополнения о том, что в постмаркетинговых исследованиях отмечались случаи острого панкреатита. В 2013 г. появились сообщения о результатах гистологических исследований ткани поджелудочной железы, полученной у доноров, ранее страдавших СД 2 типа и получавших ситаглиптин (7 пациентов), эксенатид (1 пациент) и другую терапию (всего 20 больных). A. Butler и соавт. опубликовали следующие результаты: масса поджелудочной железы у пациентов, получавших инкретины, была на 40% больше, чем у больных СД 2 типа на другой терапии, отмечались гиперплазия альфа-клеток, усиление пролиферации и дисплазии экзокринных клеток.
Данные сообщения были рассмотрены FDA и ЕМА и расценены как недостаточно убедительные. Никакие изменения в отношении приема ситаглиптина и эксенатида внесены не были. Рекомендовано продолжить использование данных препаратов [41].
Китайские ученые провели исследование для выявления связи между риском развития панкреатита и терапией, основанной на инкретинах, у пациентов с СД 2 типа [42]. Исследователи сделали систематический обзор и метаанализ работ, опубликованных в базах данных Medline, Embase, Кокрановском центральном регистре контролируемых испытаний (CENTRAL), ClinicalTrials.gov. Оказалось, что частота панкреатита среди пациентов, принимавших инкретины, низка, и данные препараты не повышают риск его развития. Однако текущие данные не являются окончательными, для установления повышения риска, если таковой имеется, необходимо проведение обсервационных исследований с более тщательным дизайном.
Оценка безопасности применения препаратов инкретинового ряда (иДПП-4 и аГПП-1) в отношении рассматриваемого риска проводилась практически во всех клинических исследованиях с участием данных препаратов, в том числе в исследованиях по сердечно-сосудистой безопасности. Их результаты, а также результаты предшествовавших им исследований клинической эффективности и безопасности препаратов данных групп не показали увеличения риска развития острых панкреатитов, рака поджелудочной железы и рака щитовидной железы на фоне проводимой терапии.
Несмотря на противоречивость данных, необходимо информировать пациентов о симптомах острого панкреатита и прекращении лечения при его развитии.
Заключение
Безопасность препаратов с длинной историей – инсулина, производных сульфонилмочевины, бигуанидов – изучена очень хорошо. Благодаря этому сформулированы четкие показания и противопоказания к их применению. Изучение безопасности новых препаратов необходимо продолжать, так как для подтверждения побочных эффектов и выявления редких требуются годы. Согласно полученным результатам будут вноситься коррективы и в инструкции по применению этих препаратов.
Необходимо помнить, что безопасность больных – это вопрос не только денег и технологий. Ни деньги, ни технологии, ни приказы и даже законы не решат проблем безопасности лекарств. Значение имеют политическая воля руководства (административная и финансовая поддержка системы фармаконадзора) и профессиональная и гражданская ответственность работников здравоохранения.
O.M. Smirnova, I.V. Kononenko
Endocrinology Research Center
I.M. Sechenov First Moscow State Medical University
Contact person: Olga Mikhaylovna Smirnova, dr_smr@mail.ru
Drug-related safety is one of high-priority approaches in modern medicine and pharmacy. It is explained by extensive development of pharmaceutical industry, elevated sensitization level in patients to chemical and biological substances due to polypragmasy, use of poor-quality medications (improper storage, counterfeit etc.).
Here, the data on multi-center international studies on long-term safety of using hypoglycemic drugs of different groups are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.