Патогенетическое обоснование применения колекальциферола в комбинированной терапии наружного генитального эндометриоза
- Аннотация
- Статья
- Ссылки
- English
В настоящее время наружный генитальный эндометриоз (НГЭ) характеризуют как мультифакториальное заболевание с хроническим, рецидивирующим, прогрессирующим и иммунокомпетентным характером течения [1]. Современный подход к лечению больных НГЭ состоит в комбинации хирургического метода и гормономодулирующей терапии. Несмотря на наличие инновационных способов оперативного лечения эндометриоза и развитие методов медикаментозной терапии, число тяжелых форм заболевания и количество рецидивов не уменьшаются [2]. Болевой синдром, характерный для генитального эндометриоза, оказывает крайне негативное влияние на общее состояние и качество жизни пациенток с НГЭ. Имеющиеся научные представления полностью не раскрывают патогенез заболевания, а современные методы медикаментозной терапии являются недостаточно эффективными у части больных, что требует разработки новых патогенетически обоснованных методов терапии генитального эндометриоза для длительного, эффективного и безопасного лечения [3].
Витамин D – стероидный гормон с многообразием эффектов, в том числе с противовоспалительным, антипролиферативным, антиангиогенным, иммуномодулирующим и антидепрессивным действием [4, 5]. На сегодняшний день дефицит витамина D принял характер пандемии, особенно подвержены развитию дефицита витамина D люди, проживающие севернее 35-й параллели (в Северном полушарии), что обусловлено недостаточным уровнем инсоляции большую часть года.
В настоящее время опубликованы убедительные данные о влиянии витамина D на течение беременности, а также на гинекологические заболевания. На данный момент исследователи считают, что существует обратная корреляция между уровнем 25-гидроксикальциферола (25(ОН)D) и риском развития преэклампсии, привычного выкидыша, бесплодия, синдрома поликистозных яичников, миомы матки, генитального эндометриоза [6–8].
В течение длительного периода времени мы проводили исследования, посвященные изучению роли витамина D в патогенезе НГЭ, – оценивали эффективность применения колекальциферола на основании хирургически индуцированной модели эндометриоза у крыс, проводили анализ полиморфизма гена рецептора витамина D (VDR) у пациенток с генитальным эндометриозом и в популяции, изучали экспрессию рецепторов витамина D (VDR) в эутопическом и эктопическом эндометрии в зависимости от фазы менструального цикла и по сравнению с контрольной группой, а также разработали способ лечения генитального эндометриоза и оценили эффективность его применения в составе комбинированной терапии НГЭ [3, 4, 9–17]. В данной работе мы хотим отразить основные результаты проведенных нами исследований, а также представить информацию, опубликованную другими авторами.
Фундаментальной базой для оценки эффективности новых направлений медикаментозной терапии являются экспериментальные исследования. Известно несколько работ на моделях экспериментально индуцированного эндометриоза у животных, продемонстрировавших эффективность применения различных лекарственных форм колекальциферола и его аналога – селективного агониста рецепторов витамина D элокальцитола. Так, в модели на мышах М. Mariani и соавт. [18] показали, что селективный агонист VDR – элокальцитол – способен уменьшить общий вес эндометриоидных гетеротопий до 70%. В свою очередь M.A. Abbas и соавт. в модели экспериментального эндометриоза на крысах продемонстрировали уменьшение площади эндометриоидных имплантатов на 48,8%. При этом гистологическое исследование эндометриоидных гетеротопий крыс, получавших витамин D, показало развитие в стромальном компоненте имплантатов фиброза и апоптоза [19]. В 2014 г. B. Yildirim и соавт. [20] показали, что 1,25-дигидроксивитамин D при внутримышечном пути введения в экспериментальной модели эндометриоза на крысах уменьшает средний объем имплантатов по сравнению с контрольной группой, а также способствует снижению уровня васкулоэндотелиального фактора роста и матриксной металлопротеиназы 9. Исследование на экспериментальной модели эндометриоза на крысах, проведенное в Турции в 2016 г., продемонстрировало снижение уровня интерлейкина 6 (ИЛ-6) в перитонеальной жидкости после применения 1,25-дигидроксивитамина D [21].
В одной из наших работ проводилась оценка эффективности применения колекальциферола на крысах. Эксперимент был выполнен в несколько этапов. Первым этапом самкам крыс линии Wistar была проведена хирургическая индукция эндометриоза, после чего вторым этапом через две недели проводилась диагностическая лапароскопия. Далее все крысы случайным образом были разделены на четыре группы. Первая группа (А), в которую вошли восемь животных, получала колекальциферол ежедневно перорально в течение трех недель в дозе 2500 МЕ/кг; вторая группа (В), в которую было включено шесть особей, получала колекальциферол ежедневно перорально в течение трех недель в дозе 5000 МЕ/кг; третья группа (С – контрольная), состоявшая из 13 крыс, лечения не получала; четвертая (D – группа сравнения, n = 12) получала терапию диеногестом в дозе 1 мг/кг ежедневно перорально в течение трех недель. Применение колекальциферола способствовало достоверному регрессу, в некоторых случаях – полной резорбции эндометриоидных очагов. Важно отметить, что наблюдался прямой дозозависимый эффект (полная резорбция эндометриоидных гетеротопий определялась от 12,5 до 54,55% случаев в зависимости от применяемой дозы препарата) [10].
В современной литературе представлены всего несколько работ, посвященных исследованию связи полиморфных вариантов гена VDR с риском развития НГЭ [11]. Группа исследователей в одной из работ показала, что полиморфные варианты гена VDR не играют важной роли в патогенезе эндометриоза и/или бесплодия у исследованных бразильских женщин [22], в другом исследовании было продемонстрировано, что полиморфный вариант FokI гена VDR не связан с бесплодием, вызванным эндометриозом, в популяции бразильских женщин [23]. Еще одно исследование, проведенное в 2015 г. в Польше, показало, что наличие гаплотипа A-T BmsI/FokI гена VDR было значительным фактором риска для бесплодия, ассоциированного с эндометриозом [24].
Мы также проводили исследование ассоциации полиморфизма гена рецептора витамина D с риском развития НГЭ. Исследование выполнялось методом полимеразной цепной реакции – полиморфизма длин рестрикционных фрагментов (ПЦР – ПДРФ). У 211 женщин были исследованы частоты аллельных вариантов гена VDR, из них 129 больных генитальным эндометриозом первой – четвертой степени распространенности по пересмотренной классификации r-ASRM и 82 женщины контрольной группы, представленной популяционной выборкой. Было выявлено, что частота аллеля G полиморфного варианта rs1544410 (BsmI) гена VDR достоверно выше в группе пациенток с НГЭ по сравнению с популяционной выборкой (p = 0,048). Установлено наличие достоверных различий для генотипа G/G полиморфного варианта rs1544410 (BsmI) гена VDR у больных НГЭ относительно группы контроля (p < 0,05), согласно коэффициенту соотношения шансов, риск развития НГЭ в 1,9 раза выше при наличии данного генотипа (OR = 1,93; CI = 1,082–3,450). Сочетание генотипов A/A + G/A, напротив, достоверно чаще встречается в популяции (p = 0,025) по сравнению с больными генитальным эндометриозом [13].
Согласно литературным данным, аллель А данного полиморфного варианта связан с повышенной экспрессией гена VDR и способствует повышению сывороточного уровня кальцитриола по сравнению с вариантом G [25]. Среди пациенток с НГЭ, напротив, преобладает вариант G, что, вероятно, связано с пониженной экспрессией гена и сниженным сывороточным уровнем кальцитриола. Полученные данные могут иметь принципиальное значение при выборе необходимой дозы препарата для данной когорты пациенток.
Результаты изучения экспрессии VDR в современной литературе представлены всего в нескольких исследованиях и носят противоречивый характер [26–28]. Результаты проведенного нами иммуногистохимического исследования продемонстрировали экспрессию VDR как в эутопическом, так и в эктопическом эндометрии больных генитальным эндометриозом. Также мы обнаружили отсутствие циклических изменений уровня экспрессии рецепторов витамина D в эутопическом эндометрии пациенток с НГЭ по сравнению с контрольной группой, что может быть одной из причин эндометриоз-ассоциированного бесплодия [14].
Ряд исследований посвящен изучению связи низкого уровня витамина D c частотой и тяжестью течения эндометриоза [29–32]. Имеющиеся в настоящее время данные относительно влияния колекальциферола на болевой синдром носят противоречивый характер. Так, при проведении двойного слепого клинического исследования F. Almassinokiani и соавт. не обнаружили существенных различий в уменьшении выраженности хронической тазовой боли и дисменореи после лечения колекальциферолом или плацебо [33]. A. Lasco и соавт. в своем исследовании, напротив, установили, что колекальциферол при однократном приеме в дозе 300 000 МЕ за пять дней до предполагаемой менструации по сравнению с плацебо у женщин с дисменореей, ассоциированной с эндометриозом, статистически значимо уменьшает выраженность болевого синдрома [34]. Одним из возможных объяснений снижения интенсивности болевого синдрома может быть способность кальцитриола подавлять циклооксигеназу-2 и влиять на синтез простагландинов в эндометрии, инактивируя их вследствие усиления регуляции 15-гидроксипростагландин-дегидрогеназы [35].
Подтвердив эффективность применения колекальциферола в экспериментальной модели на животных, а также получив данные генетического и иммуногистохимического исследований, отражающих значимую роль витамина D в патогенезе генитального эндометриоза, нами был разработан способ лечения данного заболевания с применением в дополнение к стандартным схемам терапии колекальциферола [12].
Оценка клинической эффективности применения колекальциферола была выполнена у 440 женщин репродуктивного возраста с диагнозом НГЭ, установленным во время проведения операционной лапароскопии и подтвержденным морфологически [15]. Эндометриоз-ассоциированный болевой синдром был критерием включения в исследование. В контрольную группу вошли 30 женщин без гинекологической патологии с овуляторным менструальным циклом, подтвержденным уровнем прогестерона в сыворотке крови в секреторную фазу менструального цикла и наличием желтого тела при проведении ультразвукового исследования органов малого таза.
Всем пациенткам проводилось определение уровня 25(ОН)D в периферической крови, у 49 женщин из основной группы было выполнено определение уровня 25(ОН)D в перитонеальной жидкости. Уровень 25(ОН)D в периферической крови больных эндометриозом был достоверно ниже по сравнению с контрольной группой. У пациенток с НГЭ третьей – четвертой степени распространенности генитального эндометриоза отмечены более низкие уровни 25(ОН)D в крови по сравнению с первой – второй степенью заболевания, однако различия не были статистически значимыми. Также были выявлены зависимости между уровнем 25(ОН)D в периферической крови и перитонеальной жидкости (p < 0,001) и уровнем 25(ОН)D в перитонеальной жидкости и степенью распространенности заболевания (p = 0,004).
Метаанализ, опубликованный в 2020 г., оценивающий статус витамина D у больных эндометриозом, также показал, что пациентки с НГЭ имели более низкие уровни витамина D по сравнению с контрольной группой, при этом наблюдалась отрицательная связь между уровнями витамина D и тяжестью эндометриоза. Однако представленные исследования были сосредоточены на статусе витамина D, а не на эффективности его применения [36].
В зависимости от состава проводимой медикаментозной терапии 440 пациенток с эндометриоз-ассоциированным болевым синдромом были разделены на две подгруппы. Первую подгруппу составили 240 больных, 217 из них принимали колекальциферол в дополнение к стандартным схемам гормономодулирующей терапии: 104 пациентки в комбинации с аГнРГ 3,75 мг один раз в 28 дней внутримышечно в течение шести месяцев, 113 женщин в комбинации с диеногестом 2 мг в течение шести месяцев. 23 пациентки получали колекальциферол в качестве монотерапии, поскольку имели противопоказания к стандартной гормономодулирующей терапии либо отказались от ее применения. Вторую подгруппу составили 200 больных, получавших стандартную гормономодулирующую терапию, из них 103 женщины получали аГнРГ 3,75 мг внутримышечно один раз в 28 дней в течение шести месяцев и 97 больных – монотерапию диеногестом 2 мг в течение шести месяцев.
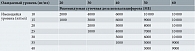
Суточная доза колекальциферола, используемого у пациенток первой подгруппы, подбиралась индивидуально, с учетом исходного уровня 25(ОH)D в крови и средних значений изменения его концентрации в крови на основании потребления в день согласно алгоритму GrassrootsHealth (общественная организация пропаганды здоровья – A Public Health Promotion Organization, http://www.grassrootshealth.net) (таблица).
При назначении препарата предпочтение отдавалось наиболее высоким допустимым дозам. Рекомендуемый уровень 25(OH)D для достижения ожидаемого эффекта составил 40–60 нг/мл (100–150 нмоль/л), что регламентировано последними клиническими рекомендациями по лечению дефицита витамина D у взрослых [37]. Назначенную суточную дозу препарата пациентки принимали однократно либо дробно. Через три месяца после начала лечения проводился контроль биохимических показателей (АЛТ, АСТ, билирубин) и уровня 25(OH)D с целью коррекции суточной дозы препарата при необходимости. До начала терапии и через шесть месяцев ее применения проводилась оценка болевого синдрома с помощью визуально-аналоговой шкалы боли Мак-Гилла (ВАШ) и психоэмоционального фона с помощью госпитальной шкалы тревоги и депрессии, разработанной A.S. Zigmond и R.P. Snaith.
На основании оценки динамики болевого синдрома по ВАШ более выраженное его уменьшение было отмечено в группе пациенток, получающих комбинированную терапию с колекальциферолом. При терапии только аГнРГ 3,75 мг болевой синдром отсутствовал у 77,7% пациенток, в случае комбинированного применения аГнРГ 3,75 мг с колекальциферолом – в 92,3%. При монотерапии диеногестом 2 мг болевой синдром отсутствовал в 74,2% случаев по сравнению с группой, получавшей сочетанную терапию диеногестом 2 мг с колекальциферолом, – 90,3%. В группе пациенток, которым после оперативного лечения была назначена монотерапия колекальциферолом, болевой синдром отсутствовал у 69,6% женщин.
Известно, что у пациенток с эндометриозом часто наблюдаются нарушения психоэмоционального фона, вплоть до депрессивных расстройств, в первую очередь обусловленные наличием болевого синдрома. На основании оценки психоэмоционального фона симптомы тревоги и депрессии были зарегистрированы у 262 (59,6%) женщин, из них 52 пациентки принимали в качестве терапии НГЭ сочетание аГнРГ с колекальциферолом, 77 женщин – сочетание диеногеста 2 мг с колекальциферолом, шесть больных – монотерапию колекальциферолом. Подгруппу сравнения составили 61 и 66 женщин, получавших аГнРГ 3,75 мг один раз в 28 дней и диеногест 2 мг соответственно. Отсутствие симптомов тревоги и депрессии отмечалось у большинства пациенток, принимавших витамин D: при сочетании применения колекальциферола c аГнРГ 3,75 мг – у 67,3% больных, при совместном применении колекальциферола с диеногестом 2 мг – у 80,5% больных; по сравнению с группой, получавшей только аГнРГ 3,75 мг, – 42,7% и группой, получавшей монотерапию диеногестом 2 мг, – 72,2%. В группе больных, которые после оперативного лечения применяли монотерапию колекальциферолом, отсутствие симптомов тревоги и депрессии наблюдалось у 66,7%.
Переносимость колекальциферола была оценена как хорошая, лишь у одной из пациенток была выявлена аллергическая реакция на колекальциферол, проявляющаяся крапивницей, в связи с чем препарат был отменен.
Результаты нашей работы показали, что пациентки, получавшие аГнРГ 3,75 мг или диеногест 2 мг в сочетании с колекальциферолом, отмечали более выраженное уменьшение болевого синдрома и стабилизацию психоэмоционального фона по сравнению со стандартной гормономодулирующей терапией.
При проведении анализа таких показателей, как отсутствие рецидива заболевания и улучшение качества жизни, наиболее эффективным оказалось комбинированное лечение аГнРГ или диеногестом 2 мг с колекальциферолом. У пациенток, имеющих противопоказания к стандартной гормономодулирующей терапии и получавших монотерапию колекальциферолом, не было зарегистрировано случаев рецидива заболевания и отмечалось улучшение общего самочувствия и качества жизни.
Заключение
Таким образом, применение колекальциферола у пациенток с НГЭ является перспективным направлением, повышающим эффективность лечения генитального эндометриоза как в качестве монотерапии, так и в дополнение к стандартным схемам лечения. Коррекция уровня витамина D имеет значение не только в лечении НГЭ, но и на этапе прегравидарной подготовки и в профилактике таких осложнений беременности, как гестационный сахарный диабет, преэклампсия, преждевременные роды. Обоснованное оценкой уровня 25(ОН)D включение колекальциферола в комбинированную терапию НГЭ может в том числе служить профилактикой снижения минеральной плотности костной ткани на фоне применения агонистов гонадотропин-рилизинг-гормона и диеногеста с учетом индивидуальных факторов риска у пациенток с эндометриозом. Принимая во внимание хорошую переносимость, эффективность, сравнительно низкую стоимость, возможность длительного применения препарата и назначение его в качестве противорецидивного метода терапии, в том числе на этапе планирования беременности у больных НГЭ, колекальциферол может быть использован в качестве перспективной патогенетически обоснованной таргетной терапии НГЭ.
Статья подготовлена в рамках темы ФНИ № 1021062812154-3-3.2.2.
M.I. Yarmolinskaya, A.S. Denisova
D.O. Ott Research Institute of Obstetrics, Gynecology and Reproductology, St. Petersburg
Mechnikov Northwestern State Medical University, St. Petersburg
Contact person: Maria I. Yarmolinskaya, m.yarmolinskaya@gmail.com
The high prevalence of genital endometriosis among patients of reproductive age and the significant negative impact of the disease on quality of life and fertility necessitate the search for new effective therapies. The study of the role of vitamin D in the pathogenesis and therapy of various diseases has recently become widespread. Vitamin D is considered to be a steroid hormone that can have a number of non-classical effects, including anti-inflammatory, antiproliferative, anti-angiogenic, immunomodulatory and antidepressant actions. These effects of vitamin D allow us to consider the possibility of its use in the treatment of genital endometriosis. This paper is a literature review from the PubMed database, as well as a brief reflection of our own research on the role of vitamin D in the pathogenesis of genital endometriosis and the possibility of its use as a therapy for the disease.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.