количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Небидо – новое качество жизни мужчин с возрастным андрогенным дефицитом
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №3 (26)
- Аннотация
- Статья
- Ссылки
- English
В статье рассмотрены наиболее достоверные клинические симптомы возрастного андрогенного дефицита (позднего гипогонадизма).
Приводятся критерии лабораторной диагностики этого заболевания, показания и противопоказания к его лечению. Отмечается, что постоянно присутствующие выраженные клинические и биохимические признаки возрастного андрогенного дефицита являются показанием к проведению заместительной гормональной терапии препаратами тестостерона, одним из которых является депо-препарат – ундеканоат тестостерона (Небидо).
На фоне терапии Небидо, в отличие от других препаратов для внутримышечного введения, концентрация тестостерона сохраняется в пределах границ его естественных колебаний на протяжении длительных временных интервалов (10–12 недель) между инъекциями. Результаты крупного международного исследования IPASS подтверждают, что Небидо способствует снижению тяжести эректильной дисфункции и увеличению жизненной активности мужчин с возрастным андрогенным дефицитом.
В статье рассмотрены наиболее достоверные клинические симптомы возрастного андрогенного дефицита (позднего гипогонадизма).
Приводятся критерии лабораторной диагностики этого заболевания, показания и противопоказания к его лечению. Отмечается, что постоянно присутствующие выраженные клинические и биохимические признаки возрастного андрогенного дефицита являются показанием к проведению заместительной гормональной терапии препаратами тестостерона, одним из которых является депо-препарат – ундеканоат тестостерона (Небидо).
На фоне терапии Небидо, в отличие от других препаратов для внутримышечного введения, концентрация тестостерона сохраняется в пределах границ его естественных колебаний на протяжении длительных временных интервалов (10–12 недель) между инъекциями. Результаты крупного международного исследования IPASS подтверждают, что Небидо способствует снижению тяжести эректильной дисфункции и увеличению жизненной активности мужчин с возрастным андрогенным дефицитом.
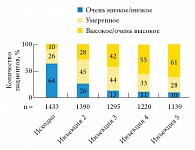
Рис. 1. Усиление полового влечения на фоне терапии Небидо
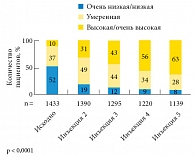
Рис. 2. Улучшение жизненной активности на фоне терапии Небидо
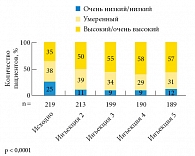
Рис. 3. Улучшение ответа на терапию ингибиторами фосфодиэстеразы 5-го типа на фоне терапии Небидо
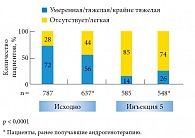
Рис. 4. Снижение тяжести эректильной дисфункции на фоне терапии Небидо у пациентов, ранее получавших андрогенотерапию, и без предшествующей терапии андрогенами
Возрастной андрогенный дефицит, или поздний гипогонадизм, – это гипогонадизм, который развивается у мужчин после нормального завершения периода полового созревания и формирования вторичных половых признаков. Возрастной андрогенный дефицит значимо снижает качество и продолжительность жизни. Позднему гипогонадизму присущи свойства как первичного, так и вторичного гипогонадизма, обусловленные возрастным уменьшением гормон-продуцирующей функции яичек и гипоталамо-гипофизарной системы.
Возрастной андрогенный дефицит – синдром, характеризующийся сниженными показателями тестостерона крови и типичными клиническими признаками [1]. Среди них можно выделить снижение полового влечения, эректильную дисфункцию, утрату мышечной массы и силы, уменьшение минеральной плотности костной ткани, депрессивные мысли, утомляемость, потерю жизненной силы, снижение плотности волосяного покрова на теле, ощущения жара и «приливы», а также уменьшение фертильного потенциала. В связи с многообразием тестостерон-регулируемых механизмов и индивидуальными особенностями прогрессирования возрастных изменений данные клинические проявления позднего гипогонадизма представлены у мужчин в разной степени и, с учетом низкой специфичности, ошибочно могут быть расценены как закономерные признаки старения. С одной стороны, это объясняет невысокую обращаемость больных возрастным андрогенным дефицитом за медицинской помощью. С другой – указывает на необходимость специалистам различного профиля (урологам, эндокринологам и врачам общей практики) внимательно интерпретировать жалобы и данные объективного обследования. В этом случае врачи имеют возможность заподозрить поздний гипогонадизм и рекомендовать проведение соответствующей лабораторной диагностики.
Учитывая общемировую тенденцию к увеличению продолжительности жизни населения, очевидно, что актуальность проблемы позднего гипогонадизма [2] будет возрастать. Анализ результатов популяционных исследований [3, 4] показал, что распространенность возрастного андрогенного дефицита варьирует в пределах 2–12%. При изучении структуры заболеваемости мужчин среднего и старшего возраста было установлено, что поздний гипогонадизм наблюдается значительно чаще среди пациентов, обратившихся к специалистам по поводу эректильной дисфункции (47%) [5] и к врачам общей практики в связи с различными жалобами (39%) [6]. Именно поэтому определение уровня тестостерона, не обязательное в популяции в целом, должно выполняться всем мужчинам с постоянными и множественными признаками гипогонадизма.
Наиболее специфичными для возрастного андрогенного дефицита являются симптомы копулятивных расстройств – снижение полового влечения, эректильная дисфункция, ослабление утренних эрекций, при этом ослабление либидо часто является самым первым проявлением позднего гипогонадизма [7, 8]. Кроме того, в последние годы появились доказательства участия андрогенов в регуляции мочеиспускания и роли возрастного андрогенного дефицита в развитии симптомов нижних мочевых путей [9]. Именно поэтому включение вопросов о состоянии сексуальной функции мужчин в алгоритм обследования специалистами различного профиля позволяет своевременно распознавать дефицит тестостерона и рекомендовать соответствующее обследование и лечение. При диагностике возрастного андрогенного дефицита из-за низкой специфичности рекомендовано отказаться от применения анкет, в том числе и ранее широко распространенного в клинической практике отечественных специалистов вопросника AMS (Aging Male Symptoms) [10].
При первичном обследовании мужчины с жалобами, характерными для гипогонадизма, следует убедиться в отсутствии других патологических состояний (недостатка питания, хронических интоксикаций, применения анаболических стероидов) или заболеваний, при которых также могут возникать аналогичные симптомы. Для этого необходимо провести тщательное объективное обследование: оценить распространенность волосяного покрова, признаки гинекомастии, состояние наружных половых органов и предстательной железы. Учитывая тесную связь между снижением уровня андрогенов, наличием метаболических расстройств и ожирением, на этом этапе также необходимо выполнить измерения для расчета индекса массы тела и соотношения «окружность талии/окружность бедер».
Для подтверждения диагноза гипогонадизма у мужчин с типичными жалобами и характерными симптомами необходима лабораторная диагностика. Нижней нормальной границей для общего тестостерона крови можно считать значение 12,1 нмоль/л. Принимая во внимание недостаточно высокую точность диагностики стероидных гормонов, измерение этого показателя рекомендуют выполнить дважды. Кроме того, концентрация глобулина, связывающего половые стероиды, дает возможность судить об уровне свободного тестостерона, который в норме должен превышать 243 пмоль/л [11]. У мужчин возрастной подгруппы от 40 до 79 лет клинические симптомы гипогонадизма – снижение жизненной силы и частоты утренних эрекций, эректильная дисфункция, снижение частоты размышлений сексуального характера – могут появляться последовательно по мере уменьшения уровней общего тестостерона крови в интервале от 11 до 8 нмоль/л и свободного тестостерона ниже значения 220 пмоль/л. Это позволяет рассматривать эти величины в качестве диагностических критериев возрастного андрогенного дефицита. Обязательным условием выполнения анализа является забор крови у пациентов в ранние утренние часы, когда концентрация тестостерона в крови максимальна. Для дифференциальной диагностики между видами гипогонадизма рекомендовано также определение уровня лютеинизирующего гормона.
Измерение концентрации тестостерона крови также рекомендовано мужчинам с заболеваниями, которым часто сопутствует гипогонадизм, – новообразованиями гипофиза, в том числе и после облучения зоны турецкого седла, хронической почечной недостаточностью в терминальной стадии и хроническим гемодиализом, умеренной и тяжелой степенями хронической обструктивной болезни легких, при мужском бесплодии, сахарном диабете 2 типа, остеопорозе и патологической предрасположенности к переломам костей, ВИЧ-инфицировании, осложненном саркопенией, а также при лечении препаратами групп опиатов и кортикостероидов, способными подавить секрецию тестостерона. Кроме того, принимая во внимание взаимосвязь дефицита андрогенов и скорости потери костной массы (остеопороза), всем мужчинам с первично диагностированным гипогонадизмом показано определение минеральной плотности костей.
Постоянно присутствующие выраженные клинические и биохимические признаки возрастного андрогенного дефицита являются показанием к проведению заместительной гормональной терапии (ЗГТ) препаратами тестостерона. ЗГТ тестостероном назначают с целью восстановления его содержания в крови в границах физиологических значений, поэтому для уточнения применяемого режима введения потребностям организма и предотвращения развития осложнений показано выполнение контрольных измерений. ЗГТ тестостероном противопоказана при раке предстательной железы, повышении уровня ПСА (> 4 нг/мл), раке грудной железы, тяжелой форме ночного обструктивного апноэ, мужском бесплодии, уровне гематокрита > 50% и выраженных симптомах нижних мочевых путей, обусловленных доброкачественной гиперплазией предстательной железы. В настоящее время для ЗГТ используется несколько лекарственных форм тестостерона, которые различаются по способу введения (пероральный, внутримышечный, чрескожный) и фармакокинетическим свойствам. Решение о назначении того или иного препарата принимается после разъяснений преимуществ и возможных осложнений применения каждого из них в ходе беседы врача с пациентом. Последнее время все больше публикаций свидетельствует о росте числа пациентов, которым длительно проводится ЗГТ депо-препаратом – ундеканоатом тестостерона (Небидо). На фоне терапии Небидо, в отличие от других препаратов для внутримышечного введения, концентрация тестостерона сохраняется в пределах границ его естественных колебаний на протяжении длительных временных интервалов (10–12 недель) между инъекциями.
Нормализация уровня тестостерона положительно сказывается на состоянии копулятивной функции – либидо, эрекции, эякуляции, удовлетворении от полового акта, общем сексуальном удовлетворении и значении Международного индекса эректильной функции [12]. Положительный эффект ЗГТ в отношении полового влечения может стать заметным уже спустя 3 недели от начала лечения и достигает максимума к 6-й неделе, улучшение настроения и качества жизни мужчины обычно отмечают через 1 месяц, а нормализацию показателей эректильной и эякуляторной функций – после 6 месяцев терапии [13].
В исследовании IPASS терапия Небидо в течение года привела к более чем шестикратному (p < 0,0001) увеличению доли пациентов, оценивающих уровень своего полового влечения (рис. 1) и жизненной активности (рис. 2) как «высокий» и «очень высокий». Лечение Небидо может быть эффективным более чем у половины мужчин с эректильной дисфункцией на фоне гипогонадизма [14], кроме того, оно повышает чувствительность к ингибиторам фосфодиэстеразы 5-го типа (рис. 3), что позволяет с успехом использовать комбинацию этих подходов при отсутствии эффекта от монотерапии [15]. Терапия Небидо также способствует снижению тяжести эректильной дисфункции у пациентов, ранее получавших лечение андрогенами (рис. 4).
Доказано, что на фоне ЗГТ тестостероном происходит нормализация соотношения мышечной и жировой массы тела, показателей углеводного и жирового обмена, минеральной плотности костей [16, 17]. Благодаря этим эффектам риски развития заболеваний сердечно-сосудистой системы у мужчин с инсулинорезистентностью и абдоминальным ожирением снижаются [18]. При использовании ЗГТ тестостероном с целью нормализации минеральной плотности костей положительная динамика обычно наблюдается при контрольных измерениях, выполненных в интервале от шести месяцев до трех лет после начала лечения [19]. За это время также было отмечено снижение выраженности депрессивных симптомов и улучшение когнитивной функции [20, 21]. В исследовании IPASS было продемонстрировано, что инъекции препарата Небидо привели к улучшению концентрации внимания мужчин, в том числе и тех, кто ранее уже получал ЗГТ другими препаратами тестостерона [13]. Этому отчасти способствовало улучшение качества сна, которое было отмечено большинством получавших лечение и страдающих бессонницей мужчин с гипогонадизмом.
Несмотря на низкую частоту развития нежелательных побочных эффектов, связанных с ЗГТ, все пациенты, получающие препараты тестостерона, нуждаются в регулярном (через 3, 6, 12 месяцев и далее – ежегодно) динамическом наблюдении для мониторинга эффективности проводимого лечения и раннего распознавания патологических проявлений. По мнению экспертов, концентрация тестостерона в крови на фоне ЗГТ, примерно равная среднему нормальному значению для соответствующей возрастной подгруппы, позволяет ликвидировать симптомы гипогонадизма.
Наиболее частым побочным эффектом ЗГТ тестостероном является повышение уровня гематокрита. Последствия этих изменений, которые, как правило, становятся заметны через 3 месяца и достигают своего максимума через 1 год после начала лечения, изучены недостаточно полно. В связи с наличием опасений, что они могут приводить к ухудшению реологических свойств крови и повышать вероятность тромбоза [22], повышение уровня гематокрита (> 50%) рассматривают как противопоказание к продолжению терапии.
В связи с тем что ЗГТ тестостероном не приводит к патологическим изменениям, представляющим угрозу для сердечно-сосудистой системы, перед началом и в ходе лечения нет необходимости выполнять оценку ее функции и консультировать мужчин у кардиолога. Исключение могут составлять лишь пациенты старшего возраста, длительно страдающие сопутствующими хроническими заболеваниями [23].
Коррекция возрастного андрогенного дефицита препаратами тестостерона приводит к незначительному росту уровня простатспецифического антигена (ПСА) в крови, который обычно прекращается спустя 12 месяцев. Ни в одной из работ не удалось выявить связи между андрогензаместительной терапией и повышением риска развития рака предстательной железы [24]. В связи с тем что ЗГТ тестостероном может влиять на прогрессирование уже имеющейся к началу лечения и не распознанной при первичном обследовании карциномы простаты, выполнение пальцевого ректального исследования и измерение ПСА должны быть включены в набор контрольных диагностических тестов при динамическом наблюдении. В исследовании IPASS необходимость выполнения биопсии простаты в связи с повышением уровня ПСА возникла у 4 (0,3%) мужчин, и ни в одном случае не было диагностировано рака предстательной железы. При этом за 12 месяцев наблюдения описан единственный эпизод острой задержки мочеиспускания на фоне увеличения размеров простаты.
В настоящее время продолжается накопление данных о безопасности длительного применения ЗГТ тестостероном при возрастном андрогенном дефиците. Полученные результаты позволяют сегодня предположить протективную роль сохранения адекватной андрогенной насыщенности организма в поддержании нормального функционирования обменных процессов, предотвращении метаболических расстройств и связанных с ними патологических изменений в работе органов и систем [25].
Возрастной андрогенный дефицит – синдром, характеризующийся сниженными показателями тестостерона крови и типичными клиническими признаками [1]. Среди них можно выделить снижение полового влечения, эректильную дисфункцию, утрату мышечной массы и силы, уменьшение минеральной плотности костной ткани, депрессивные мысли, утомляемость, потерю жизненной силы, снижение плотности волосяного покрова на теле, ощущения жара и «приливы», а также уменьшение фертильного потенциала. В связи с многообразием тестостерон-регулируемых механизмов и индивидуальными особенностями прогрессирования возрастных изменений данные клинические проявления позднего гипогонадизма представлены у мужчин в разной степени и, с учетом низкой специфичности, ошибочно могут быть расценены как закономерные признаки старения. С одной стороны, это объясняет невысокую обращаемость больных возрастным андрогенным дефицитом за медицинской помощью. С другой – указывает на необходимость специалистам различного профиля (урологам, эндокринологам и врачам общей практики) внимательно интерпретировать жалобы и данные объективного обследования. В этом случае врачи имеют возможность заподозрить поздний гипогонадизм и рекомендовать проведение соответствующей лабораторной диагностики.
Учитывая общемировую тенденцию к увеличению продолжительности жизни населения, очевидно, что актуальность проблемы позднего гипогонадизма [2] будет возрастать. Анализ результатов популяционных исследований [3, 4] показал, что распространенность возрастного андрогенного дефицита варьирует в пределах 2–12%. При изучении структуры заболеваемости мужчин среднего и старшего возраста было установлено, что поздний гипогонадизм наблюдается значительно чаще среди пациентов, обратившихся к специалистам по поводу эректильной дисфункции (47%) [5] и к врачам общей практики в связи с различными жалобами (39%) [6]. Именно поэтому определение уровня тестостерона, не обязательное в популяции в целом, должно выполняться всем мужчинам с постоянными и множественными признаками гипогонадизма.
Наиболее специфичными для возрастного андрогенного дефицита являются симптомы копулятивных расстройств – снижение полового влечения, эректильная дисфункция, ослабление утренних эрекций, при этом ослабление либидо часто является самым первым проявлением позднего гипогонадизма [7, 8]. Кроме того, в последние годы появились доказательства участия андрогенов в регуляции мочеиспускания и роли возрастного андрогенного дефицита в развитии симптомов нижних мочевых путей [9]. Именно поэтому включение вопросов о состоянии сексуальной функции мужчин в алгоритм обследования специалистами различного профиля позволяет своевременно распознавать дефицит тестостерона и рекомендовать соответствующее обследование и лечение. При диагностике возрастного андрогенного дефицита из-за низкой специфичности рекомендовано отказаться от применения анкет, в том числе и ранее широко распространенного в клинической практике отечественных специалистов вопросника AMS (Aging Male Symptoms) [10].
При первичном обследовании мужчины с жалобами, характерными для гипогонадизма, следует убедиться в отсутствии других патологических состояний (недостатка питания, хронических интоксикаций, применения анаболических стероидов) или заболеваний, при которых также могут возникать аналогичные симптомы. Для этого необходимо провести тщательное объективное обследование: оценить распространенность волосяного покрова, признаки гинекомастии, состояние наружных половых органов и предстательной железы. Учитывая тесную связь между снижением уровня андрогенов, наличием метаболических расстройств и ожирением, на этом этапе также необходимо выполнить измерения для расчета индекса массы тела и соотношения «окружность талии/окружность бедер».
Для подтверждения диагноза гипогонадизма у мужчин с типичными жалобами и характерными симптомами необходима лабораторная диагностика. Нижней нормальной границей для общего тестостерона крови можно считать значение 12,1 нмоль/л. Принимая во внимание недостаточно высокую точность диагностики стероидных гормонов, измерение этого показателя рекомендуют выполнить дважды. Кроме того, концентрация глобулина, связывающего половые стероиды, дает возможность судить об уровне свободного тестостерона, который в норме должен превышать 243 пмоль/л [11]. У мужчин возрастной подгруппы от 40 до 79 лет клинические симптомы гипогонадизма – снижение жизненной силы и частоты утренних эрекций, эректильная дисфункция, снижение частоты размышлений сексуального характера – могут появляться последовательно по мере уменьшения уровней общего тестостерона крови в интервале от 11 до 8 нмоль/л и свободного тестостерона ниже значения 220 пмоль/л. Это позволяет рассматривать эти величины в качестве диагностических критериев возрастного андрогенного дефицита. Обязательным условием выполнения анализа является забор крови у пациентов в ранние утренние часы, когда концентрация тестостерона в крови максимальна. Для дифференциальной диагностики между видами гипогонадизма рекомендовано также определение уровня лютеинизирующего гормона.
Измерение концентрации тестостерона крови также рекомендовано мужчинам с заболеваниями, которым часто сопутствует гипогонадизм, – новообразованиями гипофиза, в том числе и после облучения зоны турецкого седла, хронической почечной недостаточностью в терминальной стадии и хроническим гемодиализом, умеренной и тяжелой степенями хронической обструктивной болезни легких, при мужском бесплодии, сахарном диабете 2 типа, остеопорозе и патологической предрасположенности к переломам костей, ВИЧ-инфицировании, осложненном саркопенией, а также при лечении препаратами групп опиатов и кортикостероидов, способными подавить секрецию тестостерона. Кроме того, принимая во внимание взаимосвязь дефицита андрогенов и скорости потери костной массы (остеопороза), всем мужчинам с первично диагностированным гипогонадизмом показано определение минеральной плотности костей.
Постоянно присутствующие выраженные клинические и биохимические признаки возрастного андрогенного дефицита являются показанием к проведению заместительной гормональной терапии (ЗГТ) препаратами тестостерона. ЗГТ тестостероном назначают с целью восстановления его содержания в крови в границах физиологических значений, поэтому для уточнения применяемого режима введения потребностям организма и предотвращения развития осложнений показано выполнение контрольных измерений. ЗГТ тестостероном противопоказана при раке предстательной железы, повышении уровня ПСА (> 4 нг/мл), раке грудной железы, тяжелой форме ночного обструктивного апноэ, мужском бесплодии, уровне гематокрита > 50% и выраженных симптомах нижних мочевых путей, обусловленных доброкачественной гиперплазией предстательной железы. В настоящее время для ЗГТ используется несколько лекарственных форм тестостерона, которые различаются по способу введения (пероральный, внутримышечный, чрескожный) и фармакокинетическим свойствам. Решение о назначении того или иного препарата принимается после разъяснений преимуществ и возможных осложнений применения каждого из них в ходе беседы врача с пациентом. Последнее время все больше публикаций свидетельствует о росте числа пациентов, которым длительно проводится ЗГТ депо-препаратом – ундеканоатом тестостерона (Небидо). На фоне терапии Небидо, в отличие от других препаратов для внутримышечного введения, концентрация тестостерона сохраняется в пределах границ его естественных колебаний на протяжении длительных временных интервалов (10–12 недель) между инъекциями.
Нормализация уровня тестостерона положительно сказывается на состоянии копулятивной функции – либидо, эрекции, эякуляции, удовлетворении от полового акта, общем сексуальном удовлетворении и значении Международного индекса эректильной функции [12]. Положительный эффект ЗГТ в отношении полового влечения может стать заметным уже спустя 3 недели от начала лечения и достигает максимума к 6-й неделе, улучшение настроения и качества жизни мужчины обычно отмечают через 1 месяц, а нормализацию показателей эректильной и эякуляторной функций – после 6 месяцев терапии [13].
В исследовании IPASS терапия Небидо в течение года привела к более чем шестикратному (p < 0,0001) увеличению доли пациентов, оценивающих уровень своего полового влечения (рис. 1) и жизненной активности (рис. 2) как «высокий» и «очень высокий». Лечение Небидо может быть эффективным более чем у половины мужчин с эректильной дисфункцией на фоне гипогонадизма [14], кроме того, оно повышает чувствительность к ингибиторам фосфодиэстеразы 5-го типа (рис. 3), что позволяет с успехом использовать комбинацию этих подходов при отсутствии эффекта от монотерапии [15]. Терапия Небидо также способствует снижению тяжести эректильной дисфункции у пациентов, ранее получавших лечение андрогенами (рис. 4).
Доказано, что на фоне ЗГТ тестостероном происходит нормализация соотношения мышечной и жировой массы тела, показателей углеводного и жирового обмена, минеральной плотности костей [16, 17]. Благодаря этим эффектам риски развития заболеваний сердечно-сосудистой системы у мужчин с инсулинорезистентностью и абдоминальным ожирением снижаются [18]. При использовании ЗГТ тестостероном с целью нормализации минеральной плотности костей положительная динамика обычно наблюдается при контрольных измерениях, выполненных в интервале от шести месяцев до трех лет после начала лечения [19]. За это время также было отмечено снижение выраженности депрессивных симптомов и улучшение когнитивной функции [20, 21]. В исследовании IPASS было продемонстрировано, что инъекции препарата Небидо привели к улучшению концентрации внимания мужчин, в том числе и тех, кто ранее уже получал ЗГТ другими препаратами тестостерона [13]. Этому отчасти способствовало улучшение качества сна, которое было отмечено большинством получавших лечение и страдающих бессонницей мужчин с гипогонадизмом.
Несмотря на низкую частоту развития нежелательных побочных эффектов, связанных с ЗГТ, все пациенты, получающие препараты тестостерона, нуждаются в регулярном (через 3, 6, 12 месяцев и далее – ежегодно) динамическом наблюдении для мониторинга эффективности проводимого лечения и раннего распознавания патологических проявлений. По мнению экспертов, концентрация тестостерона в крови на фоне ЗГТ, примерно равная среднему нормальному значению для соответствующей возрастной подгруппы, позволяет ликвидировать симптомы гипогонадизма.
Наиболее частым побочным эффектом ЗГТ тестостероном является повышение уровня гематокрита. Последствия этих изменений, которые, как правило, становятся заметны через 3 месяца и достигают своего максимума через 1 год после начала лечения, изучены недостаточно полно. В связи с наличием опасений, что они могут приводить к ухудшению реологических свойств крови и повышать вероятность тромбоза [22], повышение уровня гематокрита (> 50%) рассматривают как противопоказание к продолжению терапии.
В связи с тем что ЗГТ тестостероном не приводит к патологическим изменениям, представляющим угрозу для сердечно-сосудистой системы, перед началом и в ходе лечения нет необходимости выполнять оценку ее функции и консультировать мужчин у кардиолога. Исключение могут составлять лишь пациенты старшего возраста, длительно страдающие сопутствующими хроническими заболеваниями [23].
Коррекция возрастного андрогенного дефицита препаратами тестостерона приводит к незначительному росту уровня простатспецифического антигена (ПСА) в крови, который обычно прекращается спустя 12 месяцев. Ни в одной из работ не удалось выявить связи между андрогензаместительной терапией и повышением риска развития рака предстательной железы [24]. В связи с тем что ЗГТ тестостероном может влиять на прогрессирование уже имеющейся к началу лечения и не распознанной при первичном обследовании карциномы простаты, выполнение пальцевого ректального исследования и измерение ПСА должны быть включены в набор контрольных диагностических тестов при динамическом наблюдении. В исследовании IPASS необходимость выполнения биопсии простаты в связи с повышением уровня ПСА возникла у 4 (0,3%) мужчин, и ни в одном случае не было диагностировано рака предстательной железы. При этом за 12 месяцев наблюдения описан единственный эпизод острой задержки мочеиспускания на фоне увеличения размеров простаты.
В настоящее время продолжается накопление данных о безопасности длительного применения ЗГТ тестостероном при возрастном андрогенном дефиците. Полученные результаты позволяют сегодня предположить протективную роль сохранения адекватной андрогенной насыщенности организма в поддержании нормального функционирования обменных процессов, предотвращении метаболических расстройств и связанных с ними патологических изменений в работе органов и систем [25].
1. Dohle G.R., Aver S., Bettocchi C. et al. Guidelines om Male Hypogonadism // EAU Guidelines, edition presented at the 27th EAU Annual Congress, Paris 2012. ISBN-13: 978-90-79754-99-1.
2. Корнеев И.А. Практические аспекты назначения заместительной гормональной терапии тестостероном при возрастном андрогенном дефиците у мужчин // Урология. 2012. № 5. C. 122–127.
3. Araujo A.B., O’Donell A.B., Brambilla D.J. et al. Prevalence and incidence of androgen deficiency in middle-aged and older men: estimates from Massachusets Male Ageing Study // J. Clin. Endocrinol. Metab. 2004. Vol. 89. № 12. P. 5920–5926.
4. Liu C.C., Wu W.J., Lee Y.C. et al. The prevalence of and risk factors for androgen deficiency in aging Taiwanese men // J. Sex. Med. 2009. Vol. 6. № 4. P. 936–946.
5. Köhler T.S., Kim J., Feia K. et al. Prevalence of androgen deficiency in men with erectile dysfunction // Urology. 2008. Vol. 71. № 4. P. 693–697.
6. Mulligan T., Frick M.F., Zuraw Q.C. et al. Prevalence of hypogonadism in males aged at least 45 years: HIM study // Int. J. Clin. Pract. 2006. Vol. 60. № 7. P. 762–769.
7. Zitzmann M., Faber S., Nieschlag E. Association of specific symptoms and metabolic risks with serum testosterone in older men // J. Clin. Endocrinol. Metab. 2006. Vol. 91. № 11. P. 4335–4343.
8. Bhasin S., Cunningham G.R., Hayes F.J. et al. Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline // J. Clin. Endocrinol. Metab. 2010. Vol. 95. № 6. P. 2536–2559.
9. Shigehara K., Namiki M. Late-onset hypogonadism syndrome and lower urinary tract symptoms // Korean J. Urol. 2011. Vol. 52. № 10. P. 657–653.
10. Moore C., Huebler D., Zimmermann T. et al. The Aging Males' Symptoms scale (AMS) as outcome measure for treatment of androgen deficiency // Eur. Urol. 2004. Vol. 46. № 1. P. 80–87.
11. Bhasin S., Pencina M., Jasuja G.K. et al. Reference ranges for testosterone in men generated usingliquid chromatography tandem mass spectrometry in a community-based sample of healthy nonobeseyoung men in the Framingham Heart Study and applied to three geographically distinct cohorts // J. Clin. Endocrinol. Metab. 2011. Vol. 96. № 8. P. 2430–2439.
12. Yassin A.A., Saad F., Traish A. Testosterone undecanoate restores erectile function in a subset of patients with venous leakage: a series of case report // J. Sex. Med. 2006. Vol. 3. № 4. P. 727–735.
13. Zitzmann M., Mattern A., Hanisch J.U. et al. IPASS: a study on the tolerability and effectiveness of injectable testosterone undecanoate for the treatment of male hypogonadism in a worldwide sample of 1,438 men // J. Sex. Med. 2013. Vol. 10. № 2. P. 579–588.
14. Yassin A.A., Saad F. Treatment of sexual dysfunction of hypogonadal patients with long-acting testosterone undecanoate (Nebido) // World. J. Urol. 2006. Vol. 24. № 6. P. 639–644.
15. Corona G., Maggi M. The role of testosterone in erectile dysfunction // Nat. Rev. Urol. 2010. Vol. 7. № 1. P. 46–56.
16. Saad F., Gooren L., Haider A. et al. An exploratory study of the effect of 12 months administration of the novel long-acting testosterone undecanoate on measures of sexual function and the metabolic syndrome // Arch. Androl. 2007. Vol. 53. № 6. P. 353–357.
17. Haider A., Gooren L.J., Padungton P. et al. Improvement of the metabolic syndrome and of nonalcoholic liver steatosis upon treatment of hypogonadal elderly men with parenteral testosterone undecanoate // Exp. Clin. Endocrinol. Diabetes. 2010. Vol. 118. № 3. P. 167–171.
18. Kapoor D., Goodwin E., Channer K.S. et al. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolaemia in hypogonadal men with type 2 diabetes // Eur. J. Endocrinol. 2006. Vol. 154. № 6. P. 899–906.
19. Saad F., Aversa A., Isidori A.M. et al. Onset of effects of testosterone treatment and time span until maximum effects are achieved // Eur. J. Endocrinol. 2011. Vol. 165. № 5. P. 675–685.
20. Giltay E.J., Tishova Y.A., Mskhalaya G.J. et al. Effects of testosterone supplementation on depressive symptoms and sexual dysfunction in men with metabolic syndrome // J. Sex. Med. 2010. Vol. 7. № 7. P. 2572–2582.
21. Zitzmann M., Weckesser M., Schoner O. et al. Changes in cerebral glucose metabolism and visuospatial capability in hypogonadal males under testosterone substitution therapy // Exp. Clin. Endocrinol. Diabetes. 2001. Vol. 109. № 5. P. 302–304.
22. Palacios A., Campfield L.A., McClure R.D. et al. Effect of testosterone enanthate on hematopoiesis in normal men // Fertil. Steril. 1983. Vol. 40. № 1. P. 100–104.
23. Basaria S., Coviello A.D., Travison T.G. et al. Adverse event associated with testosterone administration // N. Engl. J. Med. 2010. Vol. 363. № 2. P. 109–122.
24. Fernández-Balsells M.M., Murad M.H., Lane M. et al. Adverse effects of testosterone therapy in adult men: a systematic review and meta-analysis // J. Clin. Endocrinol. Metab. 2010. Vol. 95. № 6. P. 2560–2575.
25. Rosen R.C., Wu F.C., Roehborn C.G. et al. Registry of hypogonadism in men (RHYME): design of a multi-national longitudinal, observational registry of exogenous testosterone use in hypogonadal men // Aging Male. 2013. Vol. 16. № 1. P. 1–7.
Nebido – new quality of life in androgen deficiency in aging men
I.A. Korneyev
Saint Petersburg Pavlov State Medical University, Urology Department
Contact person: Igor Alekseyevich Korneyev, iakorneyev@yandex.ru
The author addresses basic clinical symptoms of androgen deficiency in aging men (ADAM, late-onset hypogonadism), laboratory diagnostic criteria, treatment indications and contraindications. In patients with marked persistent clinical and biochemical signs of androgen deficiency, testosterone replacement therapy is recommended, e.g. with depot testosterone undecanoate preparation (Nebido). Unlike other intramuscular testosterones, Nebido provides stable near-natural testosterone concentrations during the whole dosing interval (10–12 weeks). The results of the large-scale international study have shown that Nebido reduces the severity of erectile dysfunction and improves vitality in aging men with androgen deficiency.
Key words: androgen deficiency in aging men, testosterone, hormone replacement therapy, Nebido
I.A. Korneyev
Saint Petersburg Pavlov State Medical University, Urology Department
Contact person: Igor Alekseyevich Korneyev, iakorneyev@yandex.ru
The author addresses basic clinical symptoms of androgen deficiency in aging men (ADAM, late-onset hypogonadism), laboratory diagnostic criteria, treatment indications and contraindications. In patients with marked persistent clinical and biochemical signs of androgen deficiency, testosterone replacement therapy is recommended, e.g. with depot testosterone undecanoate preparation (Nebido). Unlike other intramuscular testosterones, Nebido provides stable near-natural testosterone concentrations during the whole dosing interval (10–12 weeks). The results of the large-scale international study have shown that Nebido reduces the severity of erectile dysfunction and improves vitality in aging men with androgen deficiency.
Key words: androgen deficiency in aging men, testosterone, hormone replacement therapy, Nebido
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье рассмотрены наиболее достоверные клинические симптомы возрастного андрогенного дефицита (позднего гипогонадизма).
Приводятся критерии лабораторной диагностики этого заболевания, показания и противопоказания к его лечению. Отмечается, что постоянно присутствующие выраженные клинические и биохимические признаки возрастного андрогенного дефицита являются показанием к проведению заместительной гормональной терапии препаратами тестостерона, одним из которых является депо-препарат – ундеканоат тестостерона (Небидо).
На фоне терапии Небидо, в отличие от других препаратов для внутримышечного введения, концентрация тестостерона сохраняется в пределах границ его естественных колебаний на протяжении длительных временных интервалов (10–12 недель) между инъекциями. Результаты крупного международного исследования IPASS подтверждают, что Небидо способствует снижению тяжести эректильной дисфункции и увеличению жизненной активности мужчин с возрастным андрогенным дефицитом.
Приводятся критерии лабораторной диагностики этого заболевания, показания и противопоказания к его лечению. Отмечается, что постоянно присутствующие выраженные клинические и биохимические признаки возрастного андрогенного дефицита являются показанием к проведению заместительной гормональной терапии препаратами тестостерона, одним из которых является депо-препарат – ундеканоат тестостерона (Небидо).
На фоне терапии Небидо, в отличие от других препаратов для внутримышечного введения, концентрация тестостерона сохраняется в пределах границ его естественных колебаний на протяжении длительных временных интервалов (10–12 недель) между инъекциями. Результаты крупного международного исследования IPASS подтверждают, что Небидо способствует снижению тяжести эректильной дисфункции и увеличению жизненной активности мужчин с возрастным андрогенным дефицитом.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
