Неходжкинские лимфомы. Современный взгляд на классификацию и новые стандарты терапии
- Аннотация
- Статья
- Ссылки






В России НХЛ составляют 2,55 % от всех злокачественных опухолей; в 2002 году выявлено 5532 новых случаев. Стандартизованный показатель заболеваемости лимфомами среди мужчин составил 8,2 на 100 000человек, заболеваемость среди женщин равна 7,2 на 100 000 человек.
В настоящее время морфоиммунологический вариант НХЛ устанавливается в соответствии с классификацией Всемирной организации здравоохранения 2001 г.[1]. При создании её на основе REAL-классификации были учтены все известные на сегодня сведения о биологии лимфоидных опухолей. Частота встречаемости различных вариантов НХЛ неодинакова: диффузная крупноклеточная лимфома – 30%, фолликулярная – 22%, маргинальной зоны – 8%, В-мелкоклеточная и периферическая Т-клеточная – 7%, зоны мантии – 5%, лимфома Беркитта – 3%, анапластическая крупноклеточная – 2%, другие варианты составляют – 12% [2].
Выделение подвариантов целесообразно не при всех вариантах НХЛ: при фолликулярной НХЛ выделение различных типов (I, II, III) основано на количественном определении бластных клеток, число которых минимально при I типе и превалирует при III типе; значительное увеличение представительства крупных клеток (III тип) отрицательно влияет на прогноз. При диффузной В-крупноклеточной НХЛ не принято разделение на подварианты, хотя отмечено ухудшение прогноза при большом количестве иммунобластов и центробластов (> 90%) в опухолевой ткани.
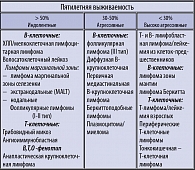
Деление НХЛ на варианты в зависимости от количества бластных клеток и, следовательно, определение степени злокачественности процесса, важно для клиницистов с точки зрения выбора адекватной терапевтической тактики. Поэтому разделение всех морфологических вариантов по степени злокачественности остается обоснованным требованием клиницистов. С момента публикации Рабочей Формулировки осуществлялось деление НХЛ по трем степеням злокачественности – низкая, промежуточная, высокая (1982 г.). Вариабельность течения НХЛ промежуточной степени легла в основу нового деления неходжкинских лимфом по прогнозу, основанному на сведениях о пятилетней выживаемости (табл. 1). В настоящее время выделяются опухоли с благоприятным прогнозом (низкая степень злокачественности, индолентные), агрессивные и высокоагрессивные НХЛ (высокая степень злокачественности) (1999 г.). “Агрессивные” НХЛ соответствуют привычному термину “НХЛ с промежуточным прогнозом”. Такое деление значительно более полно отражает различные клинические варианты опухоли [3]. Для клиницистов истинно практическое значение имеет деление на благоприятные опухоли и высокоагрессивные, принципиально отличающиеся друг от друга.
Опухоли низкой степени злокачественности (индолентные) характеризуются медленным прогрессированием, длительной выживаемостью (годы), умеренной чувствительностью к химиотерапии и отсутствием возможности излечения при использовании стандартной химиотерапии.
Значительных различий в выживаемости внутри этой группы не выявлено.
Агрессивные лимфомы быстро прогрессируют, выживаемость составляет месяцы, они умеренно и высоко чувствительны к химиотерапии и могут быть излечены стандартными методами химиотерапии. Однако внутри этой группы выявляются весьма значимые различия в продолжительности жизни: 5-летняя выживаемость колеблется от 14% при лимфоме зоны мантии до 38% и 68% при диффузной В-крупноклеточной лимфоме и III типе фолликулярной лимфомы (соответственно) [4].
Крайне неблагоприятным прогнозом отличаются высоко агрессивные НХЛ (таблица 1).
Разделение НХЛ на варианты только на основании морфологических особенностей создает немалые трудности.
Сложность интерпретации морфологических изменений при различных вариантах НХЛ демонстрируется тем, что при проведении ревизии готовых гистологических препаратов в центральных лабораториях диагноз подтверждается не более, чем в 85% случаев, в 6% – наличие опухоли отвергается, а 9% – это ошибочная трактовка варианта лимфомы. Клиницисту понятно, что это ведет к ошибочной лечебной тактике.
Различные клинические проявления НХЛ оказывают неодинаковое влияние на судьбу больных.
Было установлено, что наиболее значимыми факторами неблагоприятного прогноза являются: возраст старше 60 лет, повышение уровня ЛДГ (выше нормы), общее состояние больного, соответствующее 2-4 степени (ECOG), распространенность процесса – III-IV стадия, наличие более одного экстранодального очага поражения. Это было положено в 1993 году в основу создания Международного прогностического индекса – МПИ [35]. Размеры опухолевых масс, количество пораженных опухолью областей (нодальных и экстранодальных), дополнительные лабораторные показатели не были включены в МПИ, хотя в ряде клинических ситуаций, бесспорно, играют отрицательную роль. Возможно, это объяснялось тем, что не был четко установлен влияющий на прогноз размер: >5см?, >10см?
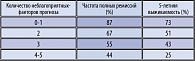
На основании наличия одновременно того или иного количества неблагоприятных факторов прогноза стали выделять четыре группы риска (степени) раннего прогрессирования болезни: низкая – отсутствие или присутствие лишь одного неблагоприятного признака, низкая/промежуточная – наличие двух факторов, промежуточная/высокая – присутствие трех и высокая – четырех и более неблагоприятных факторов (таблица 2).
Наличие двух и более факторов отчетливо отрицательно сказывается на прогнозе заболевания независимо от морфологического варианта опухоли. Было убедительно продемонстрировано влияние на 5-летнюю выживаемость неблагоприятных факторов прогноза, отрицательное значение которых отмечается внутри каждого морфоиммунологического варианта НХЛ: например, при диффузной крупноклеточной В-клеточной НХЛ 5-летняя выживаемость при низкой степени риска равна 72%, а при высокой – 22%, значительно отличаясь от усредненного показателя – 45%, (таблица 3) [36].
Позднее выяснилось, что возраст является независимым неблагоприятным фактором практически при всех НХЛ. Более того, было установлено, что значение определенных факторов прогноза неодинаково при агрессивных лимфомах для больных разного возраста. В связи с этим для больных < 60 лет выделен так называемый “соотнесенный с возрастом” (age-adjusted) Международный прогностический индекс, включающий стадии III и IV, увеличение уровня ЛДГ (выше нормы) и общее состояние 2-4 степени по ECOG. Формирование групп риска в этом случае выглядит иначе (таблица 4 ) [37].
Тщательное изучение всех аспектов прогнозирования течения болезни позволило определить значение и других клинико-лабораторных характеристик.
Неблагоприятные прогностические факторы оказывают отрицательное влияние на судьбу больных при любой стадии болезни.
Для диффузных В-крупноклеточных лимфом даже при I-II стадиях определены наиболее значимые неблагоприятные прогностические факторы; ими являются: возраст (> 60 лет), большие размеры опухолевых образований (> 10 см в диаметре, т.н. “bulky”), II стадия, повышение уровня ЛДГ (выше нормы), общее состояние ( > 1 степени по ECOG )[38]. Их отсутствие позволяет говорить о высокой 5-летней и 10-летней выживаемости (95% и 90% соответственно), а наличие 3-х или более неблагоприятных признаков сокращает 5-летнюю выживаемость до 50%, а 10-летнюю до 10%. Именно эти сведения подтвердили большое влияние на прогноз общего состояния и размеров опухолевых масс. Стало признанным понятие “bulky” (размеры опухолевых масс больше 10 см в диаметре) и обусловленное им негативное развитие болезни.
Изучение всех характеристик фолликулярной лимфомы позволило выделить 5 других неблагоприятных факторов, положенных в основу FLIPI: возраст (> 60 лет), уровень гемоглобина (< 12 г/л), уровень ЛДГ (выше нормы), III-IV стадия, количество пораженных нодальных зон (> 4). Прогностические группы формируются так, как это показано в табл. 5. Правильность выбранных факторов подтверждается данными 5-ти и 10-ти летней выживаемости [39].
С одной стороны, вновь обращает на себя внимание отрицательное значение объема опухолевой массы (количество пораженных нодальных зон более 4), а с другой стороны определение роли уровня гемоглобина. Даже при индолентной фолликулярной лимфоме снижение уровня гемоглобина ниже нормы привносит негативное влияние на прогноз.
Лишь в последние годы стали придавать прогностическое значение анемии. Moullet I. с соавторами осуществили изучение прогностического значения анемии у 1077 больных НХЛ [40]. Анемия была выявлена в 32% случаев, но ее частота варьировала в зависимости от морфологического варианта, составляя 17% при фолликулярной и 39% при диффузной В-крупноклеточной лимфоме (ДККЛ). Анемия чаще регистрировалась при поражении костного мозга (37% и 27%, р=0,0005), но только у половины больных (49%) отмечалось сочетание этих двух проявлений болезни. Негативное влияние анемии на прогноз было наглядно продемонстрировано авторами: медиана общей выживаемости при анемии была достоверно меньше (47 мес. по сравнению с 146 мес.), так же как и медиана времени до прогрессирования (15 мес. и 64 мес.)
B. Coiffier привлек внимание к тому факту, что при НХЛ анемия (Hb < 120 г/л) выявляется к моменту постановки диагноза у 40% больных, а к окончанию 3-4 курса химиотерапии её частота возрастает до 70%. Группа авторов под руководством C. Nicolaides подтвердила отрицательное влияние анемии на результаты лечения: частота полной ремиссии (ПР) снижалась на 20% (57,3% по сравнению с 77,6%, р=0,001), медиана общей выживаемости уменьшалась (25,4 мес. по сравнению с тем, что медиана у больных без анемии не достигнута, р=0,0021) [41].
Неоднозначность влияния общепринятых факторов прогноза на течение болезни диктовала необходимость выделения дополнительных прогностически значимых биологических характеристик опухоли. Установлено, что при фолликулярной лимфоме уровень экспрессии Bcl-2 убедительно сказывается на частоте 5-летних полных ремиссий (ПР) – гиперэкспрессия уменьшает ее более чем на 20% (45% по сравнению с 68% при отсутствии или низком уровне Bcl-2). Неблагоприятно сказывается на судьбе больных повышение (более 100 МЕ/мл) уровня ракового антигена – СА125, рецепторов интерлейкина – 10, ß-2 микроглобулина.
При первичной лимфоме ЦНС гиперэкспрессия Bcl-6 оказывает положительное влияние: общая выживаемость увеличивается в 7,5 раз (171 мес. по сравнению с 24 мес. при отсутствии экспрессии Bcl-6) [42].
Важна возможность определения фракции роста (пролиферативный пул), ибо у пациентов с малой долей фракции роста (до 20%) наблюдается достоверное увеличение длительности жизни по сравнению с теми, у кого она составила 70% и выше [41]. Это отмечают практически при всех вариантах НХЛ.
К настоящему времени накоплен большой объем информации о различного рода цитогенетических нарушениях, характерных для определения варианта болезни, однако, прогностическое значение каждого из них изучено недостаточно, за редкими исключениями: например t (9,14) при НХЛ низкой степени злокачественности означает хороший прогноз, а мутация гена р53 при MALT-омах – развитие трансформации их в НХЛ высокой степени злокачественности.
С другой стороны, объединение опухолей по прогнозу с учетом морфобиологических особенностей позволило разработать общие принципы терапии, различающиеся для НХЛ низкой и высокой степени злокачественности.
Продолжительность жизни больных при агрессивных и высокоагрессивных НХЛ находится в прямой зависимости от результатов лечения. Это обусловливает необходимость проведения активной интенсивной терапии при НХЛ высокой степени злокачественности сразу с момента установления диагноза с целью достижения максимального эффекта – полной ремиссии. При индолентных лимфомах менее выражена зависимость продолжительности жизни от эффективности лечения: 5-летняя выживаемость превышает 80% независимо от достижения полных или частичных ремиссий. Однако в настоящее время сложилось мнение о необходимости достижения ПР у большего числа больных фолликулярными лимфомами (ФЛ) на первом этапе лечения.
Распространённость опухолевого процесса является одной из основных характеристик болезни, оказывающих влияние на её течение. Начальные стадии (I-II) обладают более благоприятным прогнозом независимо от морфоиммунологического варианта НХЛ. Именно поэтому при I-II стадиях НХЛ апробированы и оценены попытки применения всех видов локальной терапии. В настоящее время ограничены показания к использованию хирургического метода: давно отказались от выполнения расширенной лимфаденэктомии; хирургическое лечение как компонент комбинированной терапии применяется только при первичных НХЛ желудочно-кишечного тракта.
Возможность развития ранних рецидивов с высоким риском поражения необлученных органов и тканей послужила обоснованием использования комбинированного химио-лучевого метода лечения начальных I-IIА стадий НХЛ. При этом оказалось, что комбинированная терапия высоко эффективна при любом морфоиммунологическом варианте НХЛ: частота ПР превышает 90%, 5-7 летняя безрецидивная выживаемость составляет 63%-82% [5, 6]. Результаты несколько лучше при I стадии и опухолях низкой степени злокачественности.
Мнение об адекватном ведении больных начальными стадиями НХЛ в последние годы изменилось. При сохранении представления о целесообразности использования сочетания лучевой и химиотерапии варианты химио-лучевого лечения стали определяться в соответствии с международным прогностическим индексом: при неблагоприятном прогнозе отдается предпочтение проведению лучевого компонента после завершения лекарственной терапии.
Интенсивность лекарственного компонента и режим химиотерапии зависит от стадии и морфоиммунологического варианта лимфомы.
Комбинированная химио-лучевая терапия III стадий не превосходит по результатам одну химиотерапию, а при IV стадиях мало эффективна, т.к. облучение отдельных доступных зон носит паллиативный характер. Основным методом лечения распространенных III-IV стадий НХЛ является химиотерапия, интенсивность которой зависит от степени злокачественности опухоли и клинических проявлений.
Учитывая биологические особенности НХЛ различных морфологических вариантов, при выработке лечебной тактики следует помнить, что при агрессивных НХЛ основной задачей является достижение полной ремиссии, ибо 5-летняя выживаемость в три раза меньше даже в тех случаях, когда удается достичь лишь частичной ремиссии (50% и 15% соответственно).
Различные варианты НХЛ в распространенных стадиях имеют особенности терапевтических подходов.
Индолентные НХЛ
Разнообразные варианты индолентных НХЛ представлены медленно прогрессирующими опухолями, обладающими своеобразными клиническими особенностями. Индолентными лимфомами считаются: В-клеточные- лимфоцитарная, фолликулярная (I-II тип), маргинальной зоны (селезенки, нодальные, экстранодальные – MALT), Т-клеточные – грибовидный микоз, ангиоиммунобластная; анапластическая крупноклеточная лимфома. Опухоли характеризуются благоприятным прогнозом, однако, различаются клинически и требуют различных терапевтических подходов.
Фолликулярная лимфома
Фолликулярная лимфома – это моноклональная опухоль из зрелых В-лимфоидных клеток, происходящих из фолликулярного центра лимфатических узлов.
Фолликулярная лимфома (ФЛ) – наиболее часто встречающийся вариант среди индолентных НХЛ и занимающий второе место среди всех НХЛ после диффузной В-крупноклеточной лимфомы. Составляя 30-40% от всех лимфоидных опухолей взрослых, ФЛ увеличивается во всем мире менее интенсивно, отчетливо уступая по темпу прироста заболеваемости диффузной В-крупноклеточной опухоли.
ФЛ развивается преимущественно у взрослых. Средний возраст заболевших 60 лет; встречаемость у лиц моложе 30 лет низка; обнаружение её у детей – редкость. Женщины заболевают несколько чаще: соотношение мужчины/женщины равно 1:1,7.
Несмотря на то, что основным клиническим проявлением является увеличение лимфатических узлов, заболевание имеет тенденцию к раннему гематогенному распространению с поражением экстранодальных зон – преимущественно костного мозга; печень вовлекается в процесс у 10% больных. Циркулирующие в крови опухолевые клетки могут быть идентифицированы даже в момент диагностики ранних стадий, что и объясняет последующую раннюю гематогенную диссеминацию.
Диагноз подтверждается при эксцизионной биопсии увеличенного лимфоузла.
Морфологически фолликулярная лимфома состоит или преимущественно из мелких В-лимфоидных клеток с извитым ядром (центроциты) или их сочетания с крупными клетками (центробласты). Опухоль чаще имеет склонность к узловому (нодальному) росту (75%), хотя отмечается и диффузный и смешанный характер её распространения. Клеточный компонент опухоли представлен также нормальными и реактивными Т-клетками, дендритическими клетками. Прогноз отчетливо ухудшается при увеличении в опухолевой ткани количества крупных клеток. Это легло в основу морфологического выделения трёх типов фолликулярной НХЛ: I тип – опухоль состоит преимущественно из мелких клеток (количество центробластов менее 5 в поле зрения); II тип – смешанное представительство мелких и крупных клеток (6-15 в поле зрения), III тип – преобладание в опухолевой ткани крупных клеток (>15 центробластов в поле зрения).
Иммунофенотипически опухолевые В-лимфоциты идентичны клеткам зародышевого центра и экспрессируют поверхностный иммуноглобулин М (часто в сочетании с низким уровнем Ig D и G или редко – с Ig А) и В-клеточные маркеры CD19, CD20, CD22 и CD10 при отсутствии CD5.
Фолликулярная лимфома парадоксально не похожа на другие злокачественные опухоли: при большинстве неоплазий интенсификация терапии способствует увеличению эффективности. При ФЛ регрессии опухолевых масс можно добиться весьма неинтенсивными режимами, но болезнь не теряет присущих ей биологических черт. По данным Стенфордского исследования, на протяжение последних 40 лет все попытки совершенствовать терапевтические программы не увенчались успехом и не разрешили две основные проблемы: достижение полных и продолжительных ремиссий и уменьшение склонности к рецидивированию [7].
В лечении ФЛ используются все виды терапии: лучевая, монохимиотерапия алкилатами, полихимиотерапия, иммунотерапия (альфа-интерферон, моноклональные антитела – МКА), однако до сих пор не определены оптимальные подходы. Выбор лечебной тактики основывается на клинических проявлениях болезни, массе опухоли и факторах прогноза.
Признанными показаниями к началу лечения является наличие общих симптомов (лихорадка, потеря веса, ночная потливость), болезненных увеличенных лимфоузлов, признаков прогрессирования заболевания и миелосупрессии, обусловленной опухолевой инфильтрацией костного мозга.
При медленно прогрессирующих опухолях в течение длительного времени может с успехом использоваться монохимиотерапия, преимущественно алкилирующими препаратами.
I тип фолликулярной НХЛ при наличии таких клинических проявлений, как большие размеры опухолевых масс, сдавление жизненно важных органов с нарушением их функции, тенденция к быстрому увеличению опухолевых образований, выраженная лимфоидная инфильтрация костного мозга (›50%) и II тип фолликулярной лимфомы, независимо от выраженности клинических проявлений, являются показанием к использованию полихимиотерапии в качестве I линии лечения. Наибольшее распространение получили схемы LVPP, COP, CVP; схемам СОР и CVP следует отдавать предпочтение при исходной тромбоцитопении.
Однако общая тенденция лечения лимфом низкой степени злокачественности в последнее время заключается в интенсификации I линии терапии. Это основано на возможности достижения у большего числа больных при неблагоприятном прогнозе полных и более продолжительных ремиссий. Первые полные ремиссии в среднем на 2 года превосходят последующие по длительности. Достижение первой полной ремиссии путем использования полихимиотерапии с антрациклинами обеспечивает 3-х летнюю медиану безрецидивной выживаемости; следует обратить особое внимание на то, что у 1/6 больных полная ремиссия может сохраняться более 10 лет. Поэтому наибольшее распространение получило применение схемы СНОР и её вариантов в качестве I линии терапии при наличии у больных неблагоприятных прогностических факторов. Перспективным признается использование флударабина, кладрибина, митоксантрона в сочетании с алкилатами.
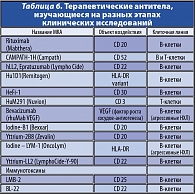
Особое значение приобретает использование моноклональных антител при ФЛ. С момента первых исследований П. Эрлиха в области иммунологии (1900 г.) до разработки технологии получения МКА (Kohler G.J., Milstein C., 1975) прошло более семи десятилетий, и только в 1984 году после идентификации Nadler L.M. CD 20 (1980) появилась реальная возможность антиидеотипической терапии МКА В-клеточных НХЛ. Последующее развитие этого направления позволяет в настоящее время констатировать наличие МКА, объектом воздействия которых являются многие характерные для НХЛ кластеры дифференцировки (табл. 6). Первыми анти-CD 20 МКА стали ритуксимаб (торговое название – Мабтера), которые были зарегистрированы в США в конце 1997 г. как первые МКА для лечения рака.
Изучены терапевтические свойства Мабтеры более детально при ФЛ, однако появляется всё больше сведений о целесообразности её использования и при других В-клеточных лимфопролиферациях.
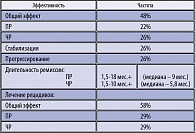
Исходными показаниями к использованию Мабтеры при фолликулярной лимфоме были следующие: монотерапия рефрактерных опухолей и рецидива болезни при неблагоприятном прогнозе (большие опухолевые массы, развитие рецидива после аллогенной трансплантации костного мозга): эффективность 48% (ПР-4%, ЧР – 44%), медиана безрецидивного периода – почти год (11,8 мес.) (результаты исследования III фазы) [8].
Davis (1999 г.) подтвердил целесообразность и безопасность повторного использования Мабтеры при развитии рецидива заболевания после ранее проведенной успешной терапии МКА – почти у половины больных (44%) вновь удается добиться успеха (ПР – 11%, ЧР – 33%, медиана ПР – 4,8 мес.) [9, 10]. Интересно, что 3 больных в этом исследовании сохранили чувствительность к Мабтере при повторном (втором и третьем) использовании при последующих рецидивах без увеличения побочных эффектов.
В настоящее время обоснованно мнение о целесообразности использования Мабтеры в сочетании с полихимиотерапией в I линии терапии III-IV стадий ФЛ. Мабтера вводится в первый день каждого лечебного цикла в дозе 375 мг/м2. Выразительны результаты применения схемы R-CHOP (добавление ритуксимаба – Мабтеры к стандартному режиму CHOP): после 6 циклов ПР достигнуты у всех больных (100%), длительность времени до прогрессирования 82 мес. (медиана), лечение безопасно, у пожилых больных нет увеличения случаев инфекционных осложнений [11].
Сочетание Мабтеры с флударабином также весьма эффективно. Добавление Мабтеры в первый день трехдневного курса флударабина (25 мг/м2 в/в ежедневно) обеспечило 90% общую эффективность с высоким показателем ПР-80% и длительность ремиссии более 15 мес. [12].
Убедительны результаты сравнительного рандомизированного исследования CVP и R-CVP (ритуксимаб+CVP) у больных старше 18 лет при III-IV стадиях и I-III морфологических типах ФЛ [13]. Даже предварительные данные показали, что использование 8 циклов CVP или R-CVP у эффективно леченных больных (при условии достижения после 4-х циклов частичной или полной ремиссии) обусловило при добавлении к схеме CVP ритуксимаба высоко достоверное увеличение общей эффективности (57,2% и 80,9% соответственно, p<0,0001) и частоты ПР (10,0% и 40,7% соответственно, p<0,0001). Время до неудачи терапии составило 26 мес. при R-CVP и 7 мес. при CVP (p<0,0001).
Итоги, подведенные на период наблюдения, равный 30 мес., оказались ещё более выразительными: при использовании схемы R-CVP частота ПР в 4 раза больше (49% по сравнению с 12%), время до прогрессирования в 2 раза продолжительнее (32 мес. по сравнению с 15 мес.), длительность ответа в 2,5 раза увеличилась (35 мес. по сравнению с 14 мес.). Особенно ценно, что эти различия высоко достоверны не только при благоприятном, но и при плохом прогнозе (время до прогрессирования увеличилось с 12 мес. до 26 мес.) [33].
Все авторы подчеркивают постепенное нарастание эффекта и после прекращения использования Мабтеры.
Таким образом, современные данные позволяют с уверенностью утверждать, что в I линии терапии фолликулярной лимфомы схемы с Мабтерой становятся новым стандартом:
1) R-CVP более эффективен, чем CVP у больных любого возраста и положительно влияет на общую выживаемость и время до прогрессирования;
2) R-CHOP имеет преимущества перед CHOP по времени до прогрессирования и, возможно, общей выживаемости.
Сложность достижения первой ПР и её сохранения на протяжении относительно продолжительного периода времени является основной терапевтической проблемой при фолликулярной лимфоме.
Наибольший опыт в мире накоплен по использованию альфа-интерферона в поддерживающей терапии.
Результаты его применения достоверно лучше при использовании на фоне ПР, доза альфа – IFN в поддерживающем режиме не должна быть меньше 9 млн МЕ в неделю при трехкратном введении (результаты ухудшаются в 2 раза при снижении этой суммарной недельной дозы), длительность лечения должна быть не менее 18 мес. Соблюдение этих принципов улучшает 5-летнюю выживаемость на 20% (70% против 50% без поддерживающей терапии альфа-IFN). Продемонстрирована и хорошая переносимость поддерживающей терапии: лечение продолжают в течение первых 6 мес. – 87 % больных, 12 месяцев – 80%, 18 месяцев – 78% пациентов [14].
Новые возможности в поддержании ремиссии открываются при использовании Мабтеры. Изучаются различные варианты поддерживающей терапии: применение дозы 375 мг/м2 препарата каждые 2 месяца (4 раза/год в течение 2-х лет) привели к увеличению бессобытийной выживаемости с 13,6 мес. до 22, 4 мес. (p<0,05) [15].
Изучается также эффективность поддерживающего использования Мабтеры в виде 4-х еженедельных инфузий каждые 6 месяцев в течение 2-х лет. Предварительные данные показали, что использование этого поддерживающего режима после достижения полной и частичной ремиссии будет бесспорно перспективным. Мабтера в монорежиме (4 введения у 60 больных) привела к успеху у 47% пациентов (7% полных ремиссий); повторная оценка эффективности по завершению первого этапа поддерживающей терапии (через 6 месяцев) продемонстрировала значительное увеличение результатов: общая эффективность повысилась до 65%, а частота ПР – до 27% [16].
Возможности повторного лечения фолликулярной лимфомы неодинаковы: лечение I рецидива уступает по эффективности терапии первичных больных (длительность ремиссии в три раза меньше, а выживаемость в 2 раза короче): после индукционной терапии лейкераном или CVP результативность терапии I рецидива на 20% выше, чем последующих; а длительность ремиссии в 2 раза больше [17].
Обсуждается целесообразность использования пуриновых производных в качестве терапии II линии (в частности, наибольший опыт накоплен в отношении Флудары).
Применение Мабтеры при рецидиве и рефрактерном варианте ФЛ апробировано и в нашей стране. Российский многоцентровой опыт монотерапии Мабтерой представлен использованием её у 67 больных (результаты РОНЦ им. Н.Н. Блохина РАМН, Москва, НИИ им. Н.Н. Петрова, С.Петербург, РНЦ МЗ РФ, Москва) [18].
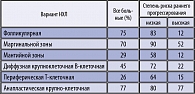
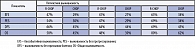
Терапия была осуществлена интенсивно предлеченным больным разного возраста: от 21 года до 72 лет (средний возраст – 53,5г.). Длительность заболевания колебалась от 8 мес. до 11 лет, и за этот период больные неоднократно получали различные варианты химиотерапии. В соответствии с МПИ 88% больных было отнесено в группу низкого и низкого/промежуточного риска. Монотерапия Мабтерой оказалась эффективной почти у половины больных (48%) с достижением ПР в 22% случаев (таблица 7).
Следует подчеркнуть, что пожилые больные (> 60 лет) также оказались чувствительны к монотерапии Мабтерой. Использование ее у 35 пациентов при развитии рецидива болезни или констатации рефрактерной формы оказалось эффективным без увеличения токсичности (таблица 8).
Таким образом, убедительные мировые и отечественные данные позволяют считать, что адекватной I линией терапии диссеминированной фолликулярной лимфомы (I-III типа) является лекарственная терапия по схеме R-COP (ритуксимаб+COP). Наличие неблагоприятных факторов и, в частности, больших опухолевых масс диктует необходимость использования высоко эффективного режима – R-CHOP (ритуксимаб+CHOP). Обосновано применение ритуксимаба в качестве монотерапии при развитии рецидива фолликулярной лимфомы в любом возрасте.
Агрессивные и высокоагрессивные в-клеточные НХЛ
Клиническими особенностями агрессивных и высокоагрессивных НХЛ является неблагоприятный прогноз, склонность к быстрому росту опухолевых образований и раннему прогрессированию, с одной стороны, и высокая чувствительность к химиотерапии, с другой.
Диффузная В-крупноклеточная лимфома
Диффузная В-крупноклеточная лимфома (ДККЛ) – наиболее часто встречающийся вариант НХЛ высокой степени злокачественности у взрослых, разнообразный по морфологическим характеристикам, клиническим проявлениям и чувствительности к терапии [19]. Это частично объясняется тем, что диффузная крупноклеточная лимфома может возникать первично (de novo) или быть следствием трансформации зрелоклеточных индолентных НХЛ (в частности, фолликулярной, MALT-oм и др.).
Заболеваемость ДККЛ неуклонно растет. Именно за счет развития ДККЛ отмечается быстрый рост числа НХЛ в США.
ДККЛ составляет 30-40% НХЛ у взрослых в странах Европы. В развивающихся странах она составляет основную часть НХЛ. Этиология окончательно неясна. Но много случаев развития ДККЛ у лиц с различной несостоятельностью иммунитета (ВИЧ-инфекция, ревматоидный артрит) и работников агропромышленного комплекса (контакт с химикатами, пестицидами).
Средний возраст больных – 64 года, однако разброс большой, т.к. этот вариант НХЛ развивается и у детей [20, 21].
ДККЛ встречается практически одинаково часто у лиц обоего пола. Клинические проявления соответствуют опухоли с неблагоприятным прогнозом: В-симптомы отмечаются у 33%, также у 1/3 пациентов опухолевые массы имеют исходно большие размеры (> 10 см), общее состояние в большинстве случаев уже в момент диагностики средней тяжести (по школе Карновского < 70% только в 24%), более чем у половины больных повышен уровень ЛДГ (53%). Но при этом поражение костного мозга выявляется нечасто (только у 16%), а вовлечение в процесс желудочно-кишечного тракта отмечается в 18% случаев. Опухоль имеет склонность к раннему поражению экстранодальных зон: даже при начальных стадиях есть экстранодальные очаги: IE стадия – 25%, IIE – 29%. Экстранодальные локализации опухолей весьма разнообразны: ЦНС, кожа, яички, кости, мягкие ткани, слюнные железы, женские половые органы, легкие, почки, кольцо Пирогова-Вальдейера, селезенка.
Почти у 50% больных заболевание выявляется в начальных стадиях (I-II стадии), причем, преимущественно это бывает при первичном экстранодальном поражении. У другой половины пациентов лимфома изначально генерализована (III-IV стадии), нередко с развитием экстранодальных очагов. Независимо от исходной распространенности у большинства пациентов (65%) присутствует одновременно несколько неблагоприятных факторов прогноза: МПИ 2/3 – 46%, МПИ 4/5 – 19%.
Диффузная крупноклеточная лимфома является тем вариантом НХЛ, который с большой точностью (87%) может быть установлен морфологическим и иммунологическим методом. Диффузный рост опухоли изменяет нормальную архитектонику лимфоузла или ткани экстранодального расположения опухоли. В лимфатических узлах опухолевые инфильтраты могут располагаться интерфолликулярно или, реже, синусоидально, замещая полностью или частично нормальную ткань. Часто инфильтрируются расположенные рядом мягкие ткани. Опухоль состоит из крупных лимфоидных клеток. Выделяется несколько морфологических вариантов: центробластный, иммунобластный, богатый Т-клетками/гистиоцитами, анапластический, из которых центробластный встречается наиболее часто. Опухолевые клетки имеют фенотипические признаки центробластов зародышевого центра фолликула лимфоузла или иммунобластов с экспрессией пан-В-клеточных антигенов (CD19, CD20, CD22 и CD79a с разным уровнем их присутствия). Поверхностные и/или цитоплазматические иммуноглобулины (IgM>IgG>IgA) выявляются в 50-75% случаев. Цитоплазматический иммуноглобулин чаще бывает при плазматической дифференцировке опухолевых клеток.
Наиболее постоянная цитогенетическая аномалия (30%) – транслокация (14;18), которая приводит к слиянию гена Bcl-2 на 18-й хромосоме с генами тяжелой цепи иммуноглобулинов на 14-й хромосоме. В результате появляется гиперэкспрессия белка Bcl-2, который блокирует апоптоз. Другая постоянная транслокация (3;14) (q27; q32) сопровождается повышенной активностью онкогена Bcl-6. Реаранжировка гена myc не присуща ДККЛ [22].
Основываясь на данных об общей и свободной от неудач выживаемости больных ДККЛ, можно констатировать, что около 40% больных могут быть излечены. Однако успех лечения и, следовательно, судьба больных зависит от наличия прогностических факторов.
В настоящее время сформировалась лечебная стратегия при ДККЛ. Установлено, что использование только лучевой терапии при I-II стадии не является адекватным; рекомендуется использование комбинированной химио-лучевой терапии с преимущественным проведением лучевого этапа после 6 курсов химиотерапии (при этом подчеркивается нецелесообразность сокращения количества курсов химиотерапии до лучевой терапии независимо от времени наступления эффекта).
При распространенном процессе (III-IV стадии) полихимиотерапия с включением антрациклинов является основой лечения, количество лечебных циклов – 6-8 с последующим закреплением достигнутого полного эффекта двумя дополнительными аналогичными циклами.
Первой линией терапии диссеминированных НХЛ высокой степени злокачественности является схема СНОР (циклофосфамид, доксорубицин, винкристин, преднизолон), признанная ранее “золотым стандартом”: при общей эффективности выше 80% частота полных ремиссий равна 50-55%. Наиболее чувствительна к ней именно диффузная крупноклеточная лимфома (частота полной ремиссии – 58-62%). Анализ отдаленных результатов (сроки наблюдения 14 лет и более) показывает, что 32% первичных больных могут быть излечены. Однако установлено снижение частоты полных ремиссий и 5-летней выживаемости более чем на 30% при наличии у больных в момент начала лечения 3 и более неблагоприятных факторов прогноза (табл. 9)[23].
Неудовлетворенность от результатов использования стандартной схемы CHOP и сведения о том, что интенсификация режима (добавление этопозида или сокращение интервала между циклами) может повысить ее эффективность, легли в основу сравнительных исследований. Анализ достаточного клинического материала убедительно продемонстрировал позитивное влияние как добавления к стандартной схеме этопозида (схема CHOEP), так и сокращение интервала между циклами (схемы CHOP-14 и CHOEP-14) у больных в возрасте от 18 до 60 лет. Добавление этопозида (схема CHOEP) обусловливает достоверное увеличение частоты наступления полных ремиссий (почти на 10% по сравнению с CHOP) и 5-летней бессобытийной выживаемости (на 12% по сравнению с CHOP) [24]. Уменьшение длительности интервала положительно сказывается на продолжительности общей выживаемости.
Для пациентов старше 60 лет наиболее результативной оказалась схема CHOP-14, ибо CHOP-21 достоверно уступает по эффективности (табл. 10), а любой вариант схемы CHOEP (CHOEP-14 и CHOEP-21) чрезвычайно токсичен.
Так как возраст является независимым неблагоприятным фактором прогноза, одним из важнейших показаний в настоящее время стало применение ритуксимаба в сочетании со схемой CHOP в качестве 1-й линии лечения пожилых больных с диффузной крупноклеточной В-клеточной лимфомой. В многоцентровом рандомизированном исследовании группы GELA было выполнено сравнение эффективности и токсичности схем CHOP и R-CHOP в лечении ранее не леченных пожилых больных с диффузной крупноклеточной В-клеточной лимфомой. Полученные результаты выглядят весьма обнадеживающе: в группе больных, получивших лечение по схеме R-CHOP, частота наступления полных ремиссий увеличилась с 60% до 76%, 2-х летняя общая выживаемость с 57% до 70%, бессобытийная выживаемость с 38% до 57% по сравнению с пациентами, получившими лечение по программе CHOP. При этом не зафиксировано увеличения числа побочных эффектов. Эти сведения были позднее подтверждены результатами 4-летнего наблюдения: 4-х летняя общая выживаемость на 12% превышает таковую при использовании схемы CHOP-21 (47% и 59% соответственно), а 4-х летняя бессобытийная выживаемость больше на 22% (29% и 51% соответственно) [25]. Эти данные наглядно подтверждены при 5-летнем сроке наблюдения [34] (табл. 1). Весьма значимо, что улучшение достоверно при любом прогнозе, т.е. схема R-CHOP может с успехом использоваться у пожилых в любой клинической ситуации.
R-CHOP признан стандартом I линии лечения больных старше 60 лет.
Возможность улучшения результатов лечения доказана в настоящее время при применении R-CHOP при ДККЛ с низким риском раннего прогрессирования и у больных моложе 60 лет. Опубликованные в 2004 году данные исследования MInT (MabTera International Trial) убедительно это демонстрируют [26]. В исследование были включены больные в возрасте 18-60 лет при наличии CD20+опухоли, МПИ=0,1, II-IV стадий и I стадии в случае присутствия больших опухолевых масс (“bulky”). Терапевтическая программа включала 6 циклов CHOP-21 или R-CHOP-21 с последующей лучевой терапией на экстранодальные зоны поражения и опухолевые очаги больших размеров (30-40 Гр). Использование R-CHOP увеличило частоту полных ремиссий на 20% (85% по сравнению с 65% при применении CHOP, p>0,0005), значительно сократило частоту случаев прогрессирования (5% и 16%, соответственно, p<0,00176), на 10% увеличило 2-летнюю выживаемость (95% и 85%, соответственно, p=0,0026) и время до прогрессирования (81% и 58%, p <0,000005).
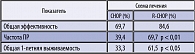
Нами также подтверждена возможность усиления эффекта при использовании схемы R-CHOP у больных ДККЛ. В РОНЦ им. Н.Н. Блохина РАМН выполнено сравнительное исследование эффективности лечения с применением CHOP-21 и R-CHOP-21 у больных ДККЛ любого возраста (от 16 до 87 лет) с неблагоприятным прогнозом (более 60% пациентов были отнесены к высокой степени риска, МПИ=3-5) [27]. Результативность использования R-CHOP была достоверно выше: общая эффективность превышала результативность CHOP на 14.9%, ПР зафиксированы на 33.7% чаще, улучшились данные 1-летней выживаемости ( таблица 12)
Полученные данные подтверждены начатым в России многоцентровым исследованием: 28 июня 2004г. состоялось стартовое рабочее совещание по изучению схемы R-CHOP в лечении диффузной крупноклеточной В-клеточной лимфомы при участии ГНЦ РАМН и РОНЦ РАМН. За истекший год в исследование было включено 47 больных, на июнь 2005г оценен 41 случай ДККЛ. Подавляющее большинство этих пациентов (78%) имели генерализованные (III-IV) стадии заболевания, около половины больных (49%) относились к группам неблагоприятного прогноза по МПИ. Общая эффективность составила 80%, причем в большинстве случаев (71%) была достигнута полная ремиссия. Более чем в половине случаев (69%) эффект реализовался в течение первых 4 курсов R-CHOP. Прогрессирование во время лечения зафиксировано лишь у 10% больных. При медиане наблюдения равной 11 мес, медианы общей, бессобытийной и безрецидивной выживаемости не были достигнуты. Рецидивы лимфомы были выявлены у 15% пациентов, а появление “события”, под которым подразумевалось прогрессирование, рецидив заболевания, начало нового альтернативного лечения и смерть, не связанная с НХЛ, зафиксировано лишь в 30% случаев.
Таким образом, существующие на сегодня данные мирового опыта и воспроизведение его в отечественной практике позволяет считать, что схема R-CHOP является новым стандартом лечения диффузной В-крупноклеточной лимфомы у больных любого возраста.
Лимфома зоны мантии
Этот вариант НХЛ был впервые выделен в REAL-классификации. Ранее использовались различные термины: в Кильской классификации она называлась “центроцитарная лимфома”, чтобы отличить её от лимфомы из клеток фолликулярного центра; в рабочей формулировке не было точного определения, и поэтому у части больных морфологи ставили диагноз “диффузная мелкоклеточная лимфома с расщепленными ядрами” (в 50-60% случаев), а в других случаях – “фолликулярная мелкоклеточная лимфома с расщепленными ядрами” (в 33% случаев). Лимфома зоны мантии считается вариантом НХЛ с плохим прогнозом.
В связи с недавним выделением мантийноклеточной лимфомы (МКЛ) трудно точно говорить о частоте встречаемости; считается, что она оставляет 6% от всех НХЛ.
Средний возраст – 63 года, заболевание возникает преимущественно у мужчин. Клинически наиболее часто выявляется генерализованная лимфаденопатия, гепатоспленомегалия, поражение экстронодальных областей и костного мозга. У большинства больных диагностируется в III-IV стадии (80%) [28, 29]. Экстранодальные области поражаются редко (в этом случае чаще вовлекается желудочно-кишечный тракт и кольцо Вальдейера). Локализованные стадии (I и II стадия без больших опухолевых масс) наблюдаются редко – 15% больных. Опухолевые клетки НХЛ зоны мантии имеют фенотип зрелых В-лимфоцитов, экспрессируют CD19, CD20, CD22, CD24, HLA-DR в сочетании с экспрессией иммуноглобулинов М (нередко с коэкспрессией Ig D) на поверхности клеток [30, 3, 31]. НХЛ зоны мантии схожи иммунофенотипически с лимфоцитарной НХЛ и ХЛЛ, однако их различает отсутствие CD10 и CD23 при НХЛ зоны мантии. Наиболее закономерной хромосомной аномалией является t(11;14) (q13;q32). Реаранжировка гена Bcl-1 встречается в 30-50%.
Опухоль изначально имеет нодулярный характер роста, который сменяется диффузным при прогрессировании заболевания. Выживаемость варьирует в широких пределах (медиана 30-56 мес.) и наиболее продолжительна при нодулярном варианте. Биологические особенности и терапевтические подходы в настоящее время интенсивно изучаются.
Это обусловлено тем, что при лимфоме зоны мантии не удаётся прогнозировать течение болезни, а прогноз, в целом, крайне неблагоприятный. Использование стандартных подходов (монотерапия хлорамбуцилом, схемы COP, CVP) не дают обнадеживающих результатов. Несколько более эффективно применение флударабина или режимов FC или FMC. Более эффективными признаны комбинации с антрациклинами (CHOP и его варианты). Использование ритуксимаба в режиме монотерапии менее эффективно, чем при ФЛ.
Добавление ритуксимаба (Мабтера) к схеме CHOP в I линии терапии лимфом зоны мантии продемонстрировало возможность значительного улучшения результатов. Представленные в 2004 г. сравнительные данные рандомизированного исследования E-COG-1496 заслуженно привлекают к себе внимание. Проведение 8 циклов R-CHOP (ритуксимаб+CHOP) оказалось значительно и достоверно более результативным: общая эффективность увеличилась (94% по сравнению с 75% в группе больных, получавших CHOP), почти в 5 раз чаще констатированы ПР (34% и 7% соответственно, р=0,00024), продолжительнее оказалось время до неудач лечения (22 мес. и 14 мес., р=0,0131) [32]. Это первые убедительные сведения о прогрессе в терапии лимфом зоны мантии.
Все вышесказанное убедительно демонстрирует обоснованность и необходимость внедрения Мабтеры в широкую практику лечения неходжкинских лимфом.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.