Неоадъювантная терапия резектабельной меланомы кожи в России: опыт трех онкологических центров
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Объединенный анализ заслепленных индивидуальных данных пациентов был выполнен в январе 2024 г. Критериями включения данных в анализ были наличие информации о заболевании и его распространенности, проведенном курсе НСТ, патоморфологическом ответе и исходах лечения.
Результаты. Получены данные от трех исследовательских центров о 77 пациентах, которые начали получать терапию в период с октября 2020 г. по июль 2023 г. У 59 (76,6%) проводилась НСТ пролголимабом, у 13 (16,9%) – пембролизумабом и у пяти (6,5%) – ипилимумабом 3 мг/кг / ниволумабом 1 мг/кг. Среднее количество циклов составило 3,6 (95% доверительный интервал (ДИ) 3,2–4,0), средняя длительность НСТ – 45,5 дня (95% ДИ 39,3–51,6). Патоморфологический ответ на лечение в соответствии с критериями INMC оценен у 61 пациента: у 25 (41,0%) – полный ответ, у шести (9,8%) – почти полный ответ, у семи (11,5%) – частичный ответ и у 23 (37,7%) – отсутствие ответа или прогрессирование заболевания. При медиане периода наблюдения 10,2 месяца (95% ДИ 7,1–13,2) медиана выживаемости без рецидива у пациентов с полным, почти полным и частичным патоморфологическим ответом на лечение не была достигнута, в то время как в группе пациентов без патоморфологического ответа составила 14,4 месяца (95% ДИ 4,3–24,6; p = 0,014). Последующая адъювантная терапия проводилась 46 (59,7%) пациентам. При этом проведение адъювантной терапии статистически значимо влияло на выживаемость только у больных с неполным патоморфологическим ответом.
Выводы. Результаты нашего исследования подтверждают значительный потенциал НСТ в лечении резектабельной меланомы кожи IIIB–D стадии. Требуются проспективные хорошо организованные исследования для решения вопроса о деэскалации хирургии и адъювантной терапии.
Материал и методы. Объединенный анализ заслепленных индивидуальных данных пациентов был выполнен в январе 2024 г. Критериями включения данных в анализ были наличие информации о заболевании и его распространенности, проведенном курсе НСТ, патоморфологическом ответе и исходах лечения.
Результаты. Получены данные от трех исследовательских центров о 77 пациентах, которые начали получать терапию в период с октября 2020 г. по июль 2023 г. У 59 (76,6%) проводилась НСТ пролголимабом, у 13 (16,9%) – пембролизумабом и у пяти (6,5%) – ипилимумабом 3 мг/кг / ниволумабом 1 мг/кг. Среднее количество циклов составило 3,6 (95% доверительный интервал (ДИ) 3,2–4,0), средняя длительность НСТ – 45,5 дня (95% ДИ 39,3–51,6). Патоморфологический ответ на лечение в соответствии с критериями INMC оценен у 61 пациента: у 25 (41,0%) – полный ответ, у шести (9,8%) – почти полный ответ, у семи (11,5%) – частичный ответ и у 23 (37,7%) – отсутствие ответа или прогрессирование заболевания. При медиане периода наблюдения 10,2 месяца (95% ДИ 7,1–13,2) медиана выживаемости без рецидива у пациентов с полным, почти полным и частичным патоморфологическим ответом на лечение не была достигнута, в то время как в группе пациентов без патоморфологического ответа составила 14,4 месяца (95% ДИ 4,3–24,6; p = 0,014). Последующая адъювантная терапия проводилась 46 (59,7%) пациентам. При этом проведение адъювантной терапии статистически значимо влияло на выживаемость только у больных с неполным патоморфологическим ответом.
Выводы. Результаты нашего исследования подтверждают значительный потенциал НСТ в лечении резектабельной меланомы кожи IIIB–D стадии. Требуются проспективные хорошо организованные исследования для решения вопроса о деэскалации хирургии и адъювантной терапии.







Введение
В настоящее время накоплено немало данных клинических исследований различной степени зрелости, чтобы иметь достаточную уверенность в пользе неоадъювантной системной иммунотерапии (НСТ) при резектабельной меланоме кожи IIIB-D стадии (или ее эквиваленте) [1]. Иначе говоря, пациентам с клинически определяемыми метастазами в регионарных лимфатических узлах с точки зрения долгосрочных результатов полезнее начинать лечение с иммунотерапии блокаторами рецептора PD1 (далее aPD1) или комбинацией aPD1 с блокаторами рецептора CTLA4 (aCTLA4).
Пока нет совершенной ясности, лучше ли использовать комбинацию aPD1 + aCTLA4 или монотерапию aPD1 [2–5], сколько введений перед операцией следует выполнить (одно, два или более) [6, 7], имеет ли смысл рассматривать неоадъювантную таргетную терапию (или комбинацию BRAFi + MEKi + aPD1) [8, 9], на какой срок возможно отложить операцию (4–6 недель или более), какой объем операции следует выполнять (удалять весь лимфоколлектор или ограничиться только так называемым индексным лимфоузлом, который предварительно размечается при помощи специальной метки) [10], следует ли далее проводить адъювантную терапию и при ее планировании учитывать патоморфологический ответ на неоадъювантный курс, как оценить этот самый патоморфологический ответ [11, 12] и т.д. Более того, в профессиональном сообществе все еще не развеяны полностью сомнения и о самом преимуществе неоадъювантного подхода в сравнении со сложившейся за десятилетия практикой «регионарной лимфаденэктомии с последующим годовым курсом адъювантной терапии» [13].
Тем не менее, несмотря на огромное количество вопросов, в России проведено небольшое пилотное исследование по неоадъювантной внутриопухолевой моноиммунотерапии блокаторами PD1, которое продемонстрировало потенциальные возможности такого подхода [14].
В 2022 г. получены данные рандомизированного исследования II фазы о преимуществе неоадъювантной системной моноиммунотерапии aPD1 перед стандартным подходом [5]. Данные исследования легли в основу пересмотра российских клинических рекомендаций в 2023 г., тем не менее неоадъювантная терапия не слишком популярна среди практикующих врачей и остается уделом отдельных центров или же проводится в рамках клинических исследований (NCT05751928).
В настоящей работе мы хотим привести еще один аргумент в пользу применения неоадъювантной терапии, который, как мы полагаем, придаст больше уверенности сомневающимся онкологам при выборе тактики лечения пациентам с эквивалентом III стадии заболевания.
Материал и методы
Представленная работа объединяет в себе данные, полученные в результате анализа сложившейся практики трех различных центров в России (Национального медицинского исследовательского центра (НМИЦ) онкологии им. Н.Н. Блохина, НМИЦ онкологии им. Н.Н. Петрова, Московской городской онкологической больницы (МГОБ) № 62).
Пациенты получали лечение монотерапией или комбинацией aPD1 + aCTLA4 в рамках наблюдательных исследований (NCT06299878) или рутинной клинической практики. Объединенный анализ заслепленных индивидуальных данных пациентов выполнен в январе 2024 г. Критерии включения данных из медицинских карт пациентов в анализ: информация о диагнозе заболевания (метастазы меланомы кожи или метастазы меланомы без выявленного первичного очага в регионарных лимфоузлах), распространенности заболевания и намерении подвергнуть такого пациента хирургическому лечению, проведенном неоадъювантном курсе системной терапии (препарате, дозе, сроках введения), результатах терапии, способе хирургического вмешательства и патоморфологическом ответе, проводимой адъювантной терапии и исходах лечения (наличии или отсутствии прогрессирования заболевания, а также жизненном статусе при периоде прослеженности не менее 6 месяцев). Для оценки патоморфологического ответа рекомендовано использовать критерии Международного консорциума по неоадъювантной терапии меланомы [12].
Разработана соответствующая электронная регистрационная форма, которую предлагалось заполнить врачам – участникам данной работы. Какой-либо интервенции в ход лечения или наблюдения за пациентами в рамках данной работы не подразумевалось. Способ поиска и идентификации подходящих записей в медицинских картах специальным образом не ограничивался. Подразумевалось, что участники исследования проводят сплошной поиск по коду заболевания и виду лечения.
Результаты
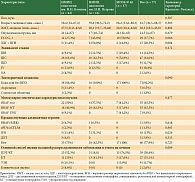
Всего для настоящего анализа получены данные от трех исследовательских центров о 77 пациентах, которые начали получать терапию в период с 01.10.2020 г. по 07.07.2023 г. Исходные характеристики пациентов представлены в табл. 1.
Исходные характеристики приблизительно одинаково распределены между центрами. Отмечалась тенденция к более частой доле пациентов с повышенным уровнем лактатдегидрогеназы (ЛДГ) в НМИЦ онкологии им. Н.Н. Петрова, также отмечались отсутствие пациентов, которые бы получали адъювантную терапию по поводу локальной меланомы кожи в МГОБ № 62 и существенно более частое использование позитронно-эмиссионной и компьютерной томографии для оценки распространенности заболевания в московских центрах по сравнению с компьютерной томографией (табл. 1).
Экспрессия PDL определена в первичной опухоли у трех из 77 пациентов, у двух пациентов она была менее 1%, а у одного пациента – более 10%, при этом метод определения не обозначен.
Всем пациентам проводилась неоадъювантная системная иммунотерапия, режимы и препараты приведены в табл. 2.
В НМИЦ онкологии им. Н.Н. Блохина большая часть пациентов были участниками наблюдательного исследования MelPRO-0322 (NCT06299878), в котором в качестве неоадъювантной терапии применялась монотерапия aPD1 пролголимабом (43 из 44 пациентов). В НМИЦ онкологии им. Н.Н. Петрова все 16 пациентов также получили монотерапию пролголимабом в монорежиме в рамках внутренней научной программы, а в МГОБ № 62 большая часть пациентов получили монотерапию пембролизумабом (76,5%), меньшая часть – комбинированную иммунотерапию aPD1 + aCTLA4 (23,5%).
Медиана количества введений НСТ во всех медицинских центрах составила 3,6 (95% доверительный интервал (ДИ) 3,2–4,0), при этом в НМИЦ онкологии им. Н.Н. Блохина предпочтение отдавали более коротким по времени курсам НСТ (табл. 3).
Радиологический ответ на лечение был оценен у 77 пациентов из 77 во всех трех центрах (табл. 4).
Хирургическое лечение было проведено 71 пациенту из 77 после завершения курса НСТ, у шести операция не выполнена. Основные причины – прогрессирование заболевания (в том числе выявление отдаленных метастазов), два пациента отказались от хирургического вмешательства на фоне явного клинического улучшения, один пациент отказался от операции на фоне стабилизации заболевания.
Патоморфологический ответ на лечение в соответствии с критериями INMC оценен у 61 пациента и еще у 10 в процессе переоценки в соответствии с данными критериями. Данные по патоморфологическому ответу представлены в табл. 5. С учетом того что в центрах применялись несколько отличающиеся режимы неоадъювантной терапии, мы приводим здесь патоморфологический ответ в зависимости от использованного режима.
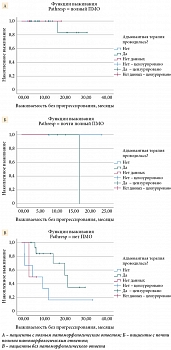
Патоморфологический ответ на лечение был предиктором выживаемости без прогрессирования (ВБП) у пациентов, подвергнутых хирургическому вмешательству. При медиане периода наблюдения 10,2 месяца (95% ДИ 7,1–13,2) медиана выживаемости без рецидива (прогрессирования) у пациентов с полным, почти полным и частичным патоморфологическим ответом на лечение не была достигнута, в то время как в группе пациентов без патоморфологического ответа составила
14,4 месяца (95% ДИ 4,3–24,6), p = 0,014 (логранговый критерий, рис. 1).
В многофакторном регрессионном анализе Кокса среди прочих факторов (пол, индекс массы тела, эквивалент стадии заболевания, уровень ЛДГ, наличие мутации BRAF, ECOG, количество проведенных циклов НСТ, локализация регионарных метастазов, сумма наибольших диаметров, тип первичной меланомы, предыдущее лечение, радиологический ответ на лечение, последующая адъювантная терапия) именно патоморфологический ответ на лечение сохранял влияние на безрецидивную выживаемость.
С учетом небольшого периода наблюдения данные по общей выживаемости (ОВ) все еще остаются незрелыми: медиана ОВ не достигнута ни в одной из групп (p = 0,431, логранговый критерий, рис. 2).
Последующая адъювантная терапия проводилась 46 (59,7%) пациентам, 25 (32,5%) пациентам не проводилась, данные об адъювантной терапии для шести (7,8%) пациентов отсутствуют. Мы приводим варианты адъювантной терапии для пациентов с известным патоморфозом опухоли после завершения НСТ (табл. 6). Более 30% больных не получили в последующем адъювантную терапию, причины, по которым адъювантная терапия не проводилась, не сообщаются.
Анализ ВБП у пациентов в зависимости от варианта адъювантной терапии и глубины патоморфологического ответа продемонстрировал тенденцию к вкладу продолжения адъювантного лечения у пациентов только без патоморфологического ответа на терапию: медианы выживаемости без рецидива достигнуты только в группе пациентов без патоморфологического ответа, при этом проведение адъювантной терапии улучшало этот показатель даже на коротком периоде наблюдения (р = 0,006 Mantel – Cox) (рис. 3).
Обсуждение
Полученные нами результаты реальной клинической практики применения неоадъювантной иммунотерапии в России демонстрируют несколько важных, на наш взгляд, особенностей.
Неоадъювантная системная терапия становится все более важной частью комплексного подхода к лечению резектабельной меланомы кожи. В России, наряду с другими странами, данный метод активно развивается и внедряется в клиническую практику, что позволяет улучшить прогноз и качество жизни пациентов. К началу 2024 г. в нашей стране накоплен опыт применения НСТ в трех ведущих онкологических центрах, который уже можно проанализировать в контексте отсроченных результатов. Поскольку данная работа, посвященная реальной практике, и критерии назначения неоадъювантной терапии, равно как и режимы ее применения, не были оговорены заранее, тем удивительнее кажется схожесть принятых подходов. В подавляющем большинстве случаев пациенты получали монотерапию блокатором PD1 (пролголимабом или пембролизумабом), и только пять пациентов (6,5%) получили терапию в комбинированном режиме (ипилимумаб + ниволумаб).
Между тем внимание подавляющего большинства международных продолжающихся исследований приковано именно к комбинированным режимам [2, 4, 7, 12, 15]. Нам, вероятно, еще предстоит установить, какой из данных подходов будет эффективнее и безопаснее для пациента, но, к сожалению, в ближайшей перспективе сделать это будет весьма непросто, поскольку на горизонте опять не просматривается прямых сравнений монотерапии aPD1 и комбинации aPD1 + aCTLA4.
В нашей работе объем хирургического вмешательства почти всегда сводился к стандартной лимфаденэктомии или метастазэктомии для пациентов с эквивалентом IVM1a стадии заболевания. Надо отметить, что понятие «эквивалент стадии» с большим трудом входит в жизнь практикующих онкологов, которые не могут легко соотнести текущую распространенность заболевания пациента с соответствующей группировкой по стадиям AJCC/UICC из-за устойчивой привычки сохранять стадию в первозданном виде с того момента, как пациент впервые узнал о диагнозе. Отчасти и поэтому распространение неоадъювантного подхода, несмотря на его упоминание в клинических рекомендациях Ассоциации Меланома.ПРО/АОР/RUSSCO, не встречает должного энтузиазма в среде онкологов. Ведь первичных пациентов с метастазами в регионарных лимфоузлах кратно меньше, чем тех, у кого такие метастазы появятся спустя несколько месяцев или лет после выявления первичной меланомы кожи и кто будет по-прежнему классифицирован как пациент с 0–II стадией заболевания.
Вопрос о возможности деэскалации хирургии, ее сведения только к удалению так называемого индексного лимфоузла у пациентов, «хорошо» ответивших на неоадъювантную иммунотерапию, также исследуется в нескольких активных протоколах, в том числе в нашей стране (NCT05751928) [10, 11]. И пока они не завершатся мы, вероятно, будем продолжать удалять весь лимфатический коллектор с пораженным лимфоузлом примерно так же, как это делали наши учителя на протяжении десятилетий. Если такие исследования окажутся позитивными, мы с удовольствием отправим на дальнюю полку истории травматичных лимфаденэктомий.
Не менее важной задачей проводимых исследований следует также считать изучение возможности деэскалации адъювантной терапии хотя бы для части пациентов. Безусловно, современная адъювантная терапия меланомы кожи может показаться практически нетоксичной в сравнении с ранее применяемыми высокодозными режимами интерферона или, в еще более старые времена, полихимиотерапии. Тем не менее годовой курс любого лекарства может доставлять массу неприятностей пациенту, а также истощать ресурсы общественного здравоохранения. Проведенные исследования [1, 3, 4, 11, 12, 15], равно как и наши скромные наблюдения, демонстрируют, что у пациентов с глубоким (полным или почти полным) патоморфологическим ответом продолжение адъювантной терапии может не добавлять какого-либо снижения риска прогрессирования заболевания. Тем не менее к этому выводу следует относиться очень осторожно, особенно с учетом не слишком большого периода наблюдения и нерандомизированного характера таких исследований.
Неоадъювантные исследования становятся также отличной платформой для изучения фундаментальных процессов взаимодействия опухоли и иммунной системы организма-хозяина. Накопление сведений и создание биобанков для биообразцов пациентов, получающих неоадъювантную иммунотерапию, должно стать непременным атрибутом такого рода работы, что также выполняется как минимум в одном из центров в рамках исследования биомаркеров для неоадъювантной иммунотерапии (NCT06299878).
Определенную сложность сегодня по-прежнему представляет система оценки патоморфологического ответа на НСТ. Унификация оценок происходит весьма постепенно, но мы полагаем, что предложенная международным консорциумом по неоадъювантной терапии меланомы система оценки станет доминирующей для этой ситуации также и в нашей стране [11], поскольку демонстрирует хорошую корреляцию с клиническими исходами.
Кооперация, которую нам удалось продемонстрировать на уровне трех крупных онкологических учреждений в стране, позволяет с оптимизмом смотреть в ближайшее будущее, в котором, вероятно, поднятые сегодня вопросы обретут твердые и выверенные ответы.
Заключение
Анализ данных, полученных от трех исследовательских центров в России о применении НСТ у пациентов с резектабельной меланомой кожи стадии IIIB–D, позволяет сделать ряд важных выводов, подчеркивающих значимость данного подхода в онкологической практике.
- Внедрение неоадъювантной иммунотерапии, включая препараты пролголимаб, пембролизумаб и комбинацию (ипилимумаб + ниволумаб), продемонстрировало обнадеживающие результаты в получении патоморфологического ответа у пациентов. Отмечается, что полный или почти полный патоморфологический ответ на лечение коррелировал с улучшением безрецидивной выживаемости.
- Данные показывают, что патоморфологический ответ является важным предиктором долгосрочных результатов, в частности безрецидивной выживаемости. Это подчеркивает необходимость интеграции оценки патоморфологического ответа в клиническую практику для прогнозирования исходов лечения.
- Анализ ВБП показывает, что продолжение адъювантной терапии, особенно у пациентов без патоморфологического ответа на неоадъювантное лечение, может улучшать долгосрочные результаты. Это указывает на важность комплексного подхода к лечению меланомы, включающего как неоадъювантную, так и адъювантную терапию, для достижения максимального эффекта.
- Несмотря на позитивные результаты, существует необходимость в проведении дополнительных исследований для определения оптимальных режимов неоадъювантной иммунотерапии, количества циклов лечения, а также для уточнения критериев отбора пациентов, которые могли бы в наибольшей степени выиграть от такого подхода.
Результаты исследований в России подтверждают значительный потенциал неоадъювантной системной иммунотерапии в лечении резектабельной меланомы кожи стадии IIIB–D. Это открывает новые перспективы для улучшения исходов лечения и качества жизни пациентов с этой тяжелой формой заболевания.
Благодарность
Авторы выражают благодарность пациентам и их родственникам, которые терпеливо принимали участие в исследованиях, а также сотрудникам отделения патологической анатомии, которые любезно согласились пересмотреть свои весьма устойчивые воззрения на мир и внедрить систему оценки патоморфоза опухоли при использовании иммуноонкологических препаратов.
Конфликт интересов
И.В. Самойленко – лекции для компаний BIOCAD, Р-Фарм, Novartis, Roche, Pierre-Fabre, Swixx. А.О. Кузьменко – грант для научной работы от компании «Леовит». Л.В. Демидов – лекции для компаний BIOCAD, Novartis, Swixx. А.Н. Юрченков – лекции для компаний BIOCAD, Novartis, Roche, Swixx. Д.Л. Строяковский – лекции для компаний BIOCAD, Novartis, Roche, Swixx. А.В. Новик, К.Ю. Капуста не заявили конфликта интересов.
I.V. Samoylenko, PhD, A.O. Kuzmenko, S.A. Protsenko, PhD, A.V. Novik, PhD, K.V. Kapusta, A.N. Yurchenkov, D.L. Stroyakovsky, PhD, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
N.N. Petrov National Medical Research Center of Oncology
Moscow City Oncological Hospital No. 62
Contact person: Igor V. Samoylenko, i.samoylenko@ronc.ru
Introduction. Neoadjuvant therapy of skin melanoma is a relatively new and dynamically developing area in the treatment of this malignant tumor. This article represents the results of an analysis of the clinical outcomes of patients receiving neoadjuvant systemic immunotherapy (NST) in 3 research centers in Russia.
Material and methods. A combined analysis of the blinded individual patient data was performed in January 2024. The criteria for including data in the analysis were the availability of information about the disease and its prevalence, the course of NST, the pathomorphological response and treatment outcomes.
Results. Data were obtained from three research centers on 77 patients who started receiving therapy in the period from Oct. 2020 to Jul. 2023. NST with prolgolimab was performed in 59 (76.6%) pts, pembrolizumab in 13 (16.9%) pts and ipilimumab 3 mg/kg + nivolumab 1 mg/kg in 5 (6.5%) pts. The average number of cycles was 3.6 (95%CI 3.2–4.0), the average duration of HCT was 45.5 days (95% CI 39.3–51.6). The pathomorphological response to treatment in accordance with INMC criteria was assessed in 61 patients: 25 (41.0%) had a complete response, 6 (9.8%) had an almost complete response, 7 (11.5%) had a partial response and 23 (37.7%) had no response or disease progression. With a median follow-up period of 10.2 months (95% CI from 7.1 to 13.2 months) median relapse-free survival in patients with complete, near-to- complete and partial pathomorphological response to treatment was not achieved, while in the group of non-responders was 14.4 months (95% CI 4.3 to 24.6 months), p = 0.014. Subsequent adjuvant therapy was performed in 46 (59.7%) patients, while adjuvant therapy had a statistically significant effect on survival only in patients with non-response.
Conclusions. The results of our study confirm the significant potential of NST in the treatment of resectable stage IIIB-D skin melanoma. Prospective well-organized studies are required to address the issue of de-escalation of surgery and adjuvant therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.