Неоадъювантная иммунотерапия при резектабельной меланоме кожи III стадии – новый стандарт лечения
- Аннотация
- Статья
- Ссылки
- English
Введение
За последние годы стандартом лечения меланомы III стадии стало проведение комбинированного лечения: хирургия с последующим проведением адъювантной лекарственной терапии, что нашло свое отражение в действующих клинических рекомендациях [1, 2].
Ингибиторы контрольных точек иммунного ответа ниволумаб и пембролизумаб (anti-PD-1) продемонстрировали увеличение пятилетней безрецидивной выживаемости (БРВ) в рандомизированных клинических исследованиях III фазы: по сравнению с препаратом ипилимумаб (anti-CTLA-4) в исследовании CheckMate-238 (50% для ниволумаба и 39% для ипилимумаба, отношение рисков (ОР) = 0,72; 95%-ный доверительный интервал (ДИ) 0,60–0,86) [3] или в сравнении с плацебо в исследовании KEYNOTE-054 (55% для пембролизумаба и 38% для плацебо, ОР = 0,61; 95% ДИ 0,51–0,72) [4]. В исследовании COMBI-AD у пациентов с мутацией в гене BRAF терапия ингибитором BRAF (iBRAF) дабрафенибом в сочетании с ингибитором MEK (iMEK) траметинибом показала преимущество по сравнению с плацебо (пятилетняя безрецидивная выживаемость составила 52% для комбинированной таргетной терапии дабрафенибом и траметинибом и 36% для плацебо, ОР = 0,51; 95% ДИ 0,42–0,61) [5].
Вопрос влияния адъювантной терапии на общую выживаемость (ОВ) пациентов остается открытым. Наибольший срок оценки долгосрочных результатов адъювантной терапии опубликован для двух исследований: COMBI-AD и KEYNOTE-054 [6, 7]. В исследовании COMBI-AD общая выживаемость через восемь лет в группе дабрафениба и траметиниба для всех пациентов составила 71% и 65% в группе плацебо (ОР = 0,80; 95% ДИ 0,62–1,01; p = 0,06). Хотя данные статистически не достоверны, но есть явный тренд на увеличение ОВ. Отдельно в подгруппе пациентов с подтипом мутации BRAF V600E заметно более значимое влияние на ОВ (ОР = 0,75; 95% ДИ 0,58–0,96). В то время как в исследовании KEYNOTE-054 с пембролизумабом, где в случае прогрессирования заболевания было предусмотрено переключение из группы плацебо на лечение пембролизумабом, данные по ОВ до сих пор не представлены при семилетнем периоде наблюдения. Как описывают сами исследователи, по причине все еще недостаточного количества событий для оценки ОВ. Таким образом, ни один из вышеперечисленных вариантов адъювантной терапии, несмотря на увеличение безрецидивной выживаемости и длительный период наблюдения, не продемонстрировал существенного улучшения ОВ.
Учитывая отсутствие убедительных данных об увеличении ОВ, а также большой пул пациентов, у которых к пяти годам наблюдения развивается прогрессирование заболевания после завершения адъювантной терапии (48% пациентов в группе комбинированной таргетной терапии дабрафенибом и траметинибом, 50% в группе ниволумаба и 45% в группе пембролизумаба), существующие подходы к лечению пациентов с резектабельной меланомой III стадии или ее эквивалентом нуждались в улучшении результатов.
И следующим направлением исследований у данной категории пациентов стала смена парадигмы лечения в сторону неоадъювантного или периоперационного режима.
Цель настоящего обзора – представить результаты исследований, посвященных неоадъювантной или периоперационной терапии у пациентов с резектабельной меланомой III стадии или ее эквивалентом.
Таргетная терапия
Исследование II фазы NeoCombi по применению таргетной терапии дабрафенибом и траметинибом в неоадъювантном режиме у пациентов с мутацией в гене BRAF V600E/K показало высокие результаты достижения патоморфологического ответа, включая полные патоморфологические ответы (пПМО/pCR), но в дальнейшем, при пятилетнем периоде наблюдения, не было отмечено увеличения безрецидивной выживаемости ни в одной из подгрупп, включая пациентов с pCR. Полученные результаты были аналогичны показателям, достигнутым при использовании лишь адъювантной таргетной терапии после хирургического лечения [8].
Иммунотерапия
Следующей областью исследовательского интереса стало изучение ингибиторов контрольных точек иммунного ответа (ИКТИ) в неоадъювантном и периоперационном режиме.
Обоснование неоадъювантной иммунотерапии проистекает из концепции, согласно которой применение иммунотерапии при наличии первичной опухоли или метастатического поражения регионарных лимфоузлов приведет к более мощному противоопухолевому иммунному ответу по сравнению с адъювантной терапией ввиду большего количества опухолевых антигенов. Следующий немаловажный фактор в сторону выбора неоадъювантной терапии – возможность как клинической оценки эффективности лечения, так и оценки патоморфологического ответа на терапию после проведения хирургического лечения. Клиническая оценка после завершения неоадъювантной терапии включает в себя инструментальные методы обследования (компьютерная томография (КТ) или позитронно-эмиссионная и компьютерная томография (ПЭТ/КТ)), основной целью которых является исключение реализации отдаленного метастазирования. В случае системного прогрессирования на фоне неоадъювантной терапии выполнение лимфодиссекции не оправдано.
Для оценки патоморфологического ответа важную роль играет команда патоморфологов, которая, опираясь на рекомендации международного консорциума по неоадъювантной терапии меланомы (INMC), проводит стандартизованную количественную оценку жизнеспособной опухолевой ткани для формирования заключения о степени патоморфологического ответа. И градация ответов морфологов на сегодняшний день выглядит следующим образом: полный ответ (pCR) – отсутствие остаточной инвазивной опухоли после оценки полностью удаленного образца; почти полный ответ (nearpCR) – > 0%, но ≤ 10% жизнеспособной опухоли; частичный ответ (pPR) – > 10% до ≤ 50% жизнеспособной опухоли; отсутствие патоморфологического ответа (pNR) – > 50% остаточной жизнеспособной опухоли. Также пациенты с полным ответом (pCR) и почти полным ответом (pnearCR) были объединены в одну группу – большой морфологический ответ (MPR). Эти пациенты имеют наилучшие результаты выживаемости. Нам здесь важно понимание, что в зависимости от патоморфологического ответа будет строиться вся дальнейшая тактика лечения. При достижении MPR появляются возможности, с одной стороны, потенциально снизить интенсивность дальнейшего лечения – в виде уменьшения адъювантной терапии и уменьшения объема оперативного вмешательства; с другой стороны, при отсутствии патоморфологического ответа изменить адъювантный этап лечения, например, у пациентов с наличием мутации в гене BRAF.
Рассмотрим неоадъювантный/периоперационный режим лечения anti-PD-1 препаратом –пембролизумабом. Исследование SWOG S1801 было рандомизированным исследованием II фазы, в котором сравнивали адъювантный и неоадъювантный режимы пембролизумаба среди пациентов с меланомой клинической III стадии или олигометастатической резектабельной меланомой IV стадии. Пациентам, получавшим адъювантную терапию, сначала было выполнено оперативное лечение, а затем проведено 18 введений пембролизумаба в дозе 200 мг каждые три недели, в то время как пациенты на неоадъювантной терапии получили три дозы предоперационного пембролизумаба с последующей операцией и 15 курсов адъювантной терапии пембролизумабом. Через два года бессобытийная выживаемость составила 72% (95% ДИ 64–80; р = 0,004) в группе неоадъювантной терапии и 49% (95% ДИ 41–59; р = 0,004) в группе адъювантной терапии пембролизумабом.
Переносимость неоадъювантной иммунотерапии пембролизумабом по сравнению с адъювантной терапией была сопоставима: частота нежелательных явлений (НЯ) 3-й степени и выше составила 12% и 14% соответственно.
На основании данного исследования периоперационный режим иммунотерапии пембролизумабом (три введения до операции и 15 введений после) изменил парадигму лечения меланомы III стадии и был внесен в клинические рекомендации [1-2], несмотря на вышедшую в дальнейшем публикацию Olivier T., Prasad V. о необходимости подтверждения этих результатов в исследовании III фазы ввиду особенностей дизайна и дисбаланса во времени до оценки эффективности и лечения, что могло повлиять на число цензурирований и полученный результат [9].
Однако спустя год, в июне 2024 г., на конгрессе ASCO были доложены результаты исследования III фазы NADINA [10]. В данном исследовании пациенты получали либо два курса неоадъювантной терапии ипилимумабом (в фиксированной дозе 80 мг) в комбинации с ниволумабом (в дозе 240 мг) каждые три недели с последующей лимфодиссекцией, либо хирургическое лечение на старте с последующим проведением адъювантной терапии. Особенностью этого исследования явилась возможность выбора последующей терапии в зависимости от патоморфологического ответа. При достижении полного патоморфологического ответа (отсутствии жизнеспособных опухолевых клеток) и почти полного патоморфологического ответа (< 10% жизнеспособных опухолевых клеток) терапия завершалась, и пациенты переводились под динамическое наблюдение. При отсутствии патоморфологического ответа опухоли или достижении частичного ответа (> 10% жизнеспособных клеток) пациенты, при наличии мутации в гене BRAF V600E/К, получали либо адъювантную терапию дабрафенибом (в дозе 150 мг два раза в день) в комбинации с траметинибом (в дозе 2 мг один раз в день) в течение 46 недель, либо дополнительно 11 циклов (46 недель) адъювантной терапии ниволумабом (в дозе 480 мг) каждые четыре недели.
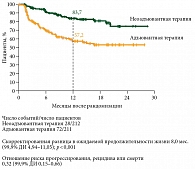
Бессобытийная выживаемость (БСВ) через 12 месяцев была значительно выше в группе неоадъювантной терапии по сравнению с группой адъювантной терапии и составила 83,7% (99,9% ДИ 73,8–94,8) и 57,2% (99,9% ДИ 45,1–72,7) соответственно. Различие в ожидаемой продолжительности жизни составило восемь месяцев (99,9% ДИ 4,94–11,05; р < 0,001; ОР = 0,32 и 99,0% ДИ 0,15–0,66) (рис. 1). В группе неоадъювантной терапии у 59% пациентов был достигнут MPR, у 8% – частичный ответ, у 26,4% не было зарегистрировано патоморфологического ответа и у 2,4% – прогрессирование. У 4,2% хирургическое лечение не было проведено. Ожидаемая ВБР в 12 месяцев составила 95,1% в группе пациентов с MPR. Для сравнения: в группе пациентов с частичным ответом ВБР составила 76,1% и без патоморфологического ответа – 57%.
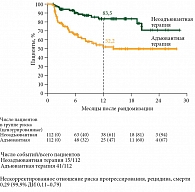
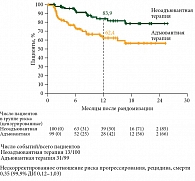
Преимущества неоадъювантной иммунотерапии были отмечены как у пациентов c наличием мутации в гене BRAF (рис. 2), так и у пациентов без мутации в гене BRAF (рис. 3).
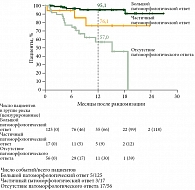
Как было показано выше, патоморфологический ответ при проведении неоадъювантной терапии оказался ключевым прогностическим фактором. MPR был достигнут у 59% пациентов (47,2% – pCR и 11,8% – pnearCR). БРВ через 12 месяцев составила 95,1% (99,9% ДИ 87,4–99,9) среди пациентов, у которых был достигнут MPR, 76,1% (99,9% ДИ 44,4–99,9) у пациентов с pPR и 57,0% (99,9% ДИ 33,3–97,6) у пациентов с pNR (рис. 4).
Известно, что переносимость комбинированной иммунотерапии характеризуется более высокой частотой развития нежелательных явлений (НЯ). Так, в исследовании NADINA у 29,7% были зарегистрированы НЯ 3-й степени и более в группе неоадъювантной иммунотерапиии и 14,7% в группе адъювантной терапии; у одного пациента наступил летальный исход в группе адъювантной терапии (пульмонит). Частота НЯ, связанных с хирургическим лечением, была сопоставима между группами – 14,6% и 14,4% соответственно.
Таким образом, всего два цикла комбинированной неоадъювантной иммунотерапии ипилимумабом с ниволумабом с последующим проведением оперативного лечения и адъювантной терапией, основанной на патоморфологическом ответе, привели к более длительной бессобытийной выживаемости и возможности выхода на плато в связи с механизмом действия ИКТИ (ингибиторов контрольных точек иммунного ответа), что требует дальнейшего подтверждения при более длительном периоде наблюдения.
Это исследование позволяет нам индивидуализировать подход к лечению пациентов из группы высокого риска с резектабельной меланомой кожи III cтадии (или метастатического поражения регионарных лимфоузлов без выявленного первичного очага) или ее эквивалентом. В случае отсутствия MPR и наличия мутации в гене BRAF, у нас сохраняется опция адъювантной таргетной терапии iBRAF (дабрафениб) + iMEK (траметиниб), что повышает шансы на излечение пациентов. Данные этого клинического исследования III фазы послужили основой для включения режима неоадъювантной комбинированной иммунотерапии в существующие практические рекомендации RUSSCO.
Заключение
Неоадъювантная/периоперационная иммунотерапия является новым стандартом лечения для резектабельной меланомы III стадии, который улучшает бессобытийную выживаемость по сравнению с адъювантным режимом лечения и дает надежду на улучшение отдаленных результатов лечения и ОВ. Неоадъювантный подход позволяет сократить объем лечения при достижении MPR, а также позволяет индивидуализировать терапию в адъювантном режиме при отсутствии патоморфологического ответа.
Выбор между монотерапией анти-PD-1 и комбинированной иммунотерапией на сегодняшний день сложен. Комбинированная иммунотерапия приводит к более высоким показателям патоморфологического ответа, но увеличивает риск развития серьезных НЯ. Возможно, пациентам в молодом работоспособном возрасте с короткими интервалами между прогрессированием от первичной меланомы до регионарного метастазирования, с более значимым поражением регионарных лимфатических узлов комбинированная иммунотерапия будет давать больший шанс на достижение ответа и улучшение результатов лечения. В то время как монотерапия анти-PD-1 может быть подходящей опцией для большинства пациентов.
Несмотря на преимущества неоадъювантного подхода (раннее воздействие на опухоль, возможность индивидуализации в зависимости от ответа и др.), требуются дополнительные исследования по поиску биомаркеров и более четкому отбору пациентов для существующих режимов лечения (монотерапия анти-PD-1 или комбинированная иммунотерапия анти-PD-1 + анти-CTLA-4) с целью более значимого улучшения исходов лечения у этой категории пациентов высокого риска.
A.N. Yurchenkov1, D.L. Stroyakovsky, PhD1, K.V. Orlova, PhD2
Moscow City Oncology Hospital No 62
N.N. Blokhin National Medical Research Center of Oncology, Moscow
Contact person: Alexander N. Yurchenkov, dr.yurchenkov@gmail.com
Modern antitumor drug therapy has significantly improved the treatment outcomes of patients with metastatic and/or inoperable melanoma. The success in metastatic melanoma has led to scientific interest in studying the efficacy and safety of these drug therapy options in the earlier stages of the disease. Randomized clinical trials have led to the approval of adjuvant anti-PD1 immunotherapy and targeted therapy for stage III resectable melanoma. Later, modern drug therapy options were also studied as neoadjuvant therapy. Promising early research results led to randomized trials, the results of which formed the basis for changes in current clinical guidelines for patients with resectable stage III melanoma or its equivalent and will be discussed in this article.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.