Нестероидная гастропатия: современные методы профилактики и лечения
- Аннотация
- Статья
- Ссылки
В общем виде изменения при приеме подобных медикаментов могут быть определены как химический гастрит (по Сиднейской классификации), но морфологические изменения СО, изъязвления и эрозии, определяемые при световой микроскопии биопсийного материала, нельзя строго охарактеризовать как химические. Воспалительные изменения СО желудка выявляются практически в 100% наблюдений у пациентов, принимающих медикаменты с ульцерогенным действием, и отличаются только степенью выраженности и частотой развития эрозивно-язвенных дефектов слизистой оболочки.
Наиболее широко используемой группой медикаментов, оказывающих повреждающее действие на СО верхних отделов ЖКТ, являются нестероидные противовоспалительные препараты (НПВП). Возникновение термина «НПВП-гастропатии» связано с выявлением изменений структуры слизистой оболочки желудка, вызванных приемом НПВП [1].
Вторым значимым фактором, который обязаны учитывать специалисты, использующие в лечебной практике НПВП, является высокая частота жизнеугрожающих осложнений, развивающихся на фоне эрозивно-язвенных поражений СО, в первую очередь кровотечений.
Актуальность проблемы профилактики и лечения НПВП-гастропатий не вызывает сомнения. Группа нестероидных противовоспалительных препаратов чрезвычайно широко востребована в ревматологической, кардиологической клинике, для лечения боли и неспецифических воспалительных процессов. В последнее десятилетие активно обсуждается назначение НПВП для снижения риска развития рака у пациентов с предраковыми процессами колоректальной области, как генетически детерминированными, так и возникшими на фоне заболеваний этой области. Из года в год расширяются показания к назначению, увеличивается число медикаментов из группы НПВП, блокирующих «воспалительный» фермент – циклическую оксигеназу 2-го типа (ЦОГ-2).
Таким образом, предупреждение и правильная терапия гастроэнтерологических побочных эффектов и осложнений, связанных с приемом НПВП, имеют большую практическую значимость для специалистов различного профиля.
Механизмы развития НПВП-гастропатии
Ингибирование продукции фермента циклооксигеназы (простагландинсинтетазы). ЦОГ представляет собой фермент, катализирующий синтез в организме биологически активных субстанций – простаноидов, к числу наиболее важных из них относятся простагландины, тромбоксан и простациклин. Группа простаноидов выполняет функции медиаторов боли, реализации тканевого воспаления, регуляции адекватной отшнуровки тромбоцитов. Для желудочно-кишечного тракта наибольшее значение имеет функциональная активность одного из изоферментов ЦОГ, циклической оксигеназы 1-го типа (ЦОГ-1), физиологической, в норме постоянно присутствующей в тканях живого организма и обеспечивающей регуляцию описанных выше функций. Изоформа ЦОГ-2 не определяется в нормальных тканях. Экспрессия ЦОГ-2 индуцируется медиаторами воспаления (липополисахаридами, интерлейкином-1, фактором некроза опухолей альфа) из клеточных субстанций организма (макрофагов, моноцитов, эндотелиальных клеток сосудов и т.д.) и обусловливает все клинические проявления воспалительных процессов – болезненность, повышение температуры тела, отечность, нарушение функции органа [6].
Прямой токсический эффект. По молекулярной структуре большинство НПВП являются слабыми кислотами. При пероральном приеме в желудочном содержимом они легко ионизируются, диффундируют в клетки СО желудка и при достижении определенной концентрации в эпителиоцитах оказывают прямое повреждающее действие на внутриклеточные органеллы и разрушают эпителиоциты.
Системный токсический эффект. НПВП независимо от формы применения (пероральная, инъекционная, ректальная, местная) попадают в системный кровоток и ингибируют продукцию муцинов, ухудшают микроциркуляцию в СО, снижая ее трофические и репаративные свойства и тем самым уменьшая пролиферацию эпителиоцитов СО желудка, а следовательно, уменьшая защитные факторы слизистой оболочки [11, 12].
Ведущее значение в развитии НПВП-гастропатий отводится ингибированию ЦОГ-1 за счет уменьшения синтеза защитных (цитопротективных) простагландинов PGE1 и PGE2, регулирующих синтез муцинов, регионарный кровоток и секрецию бикарбонатов. «Родоначальником» НПВП по праву считают ацетилсалициловую кислоту (АСК). О популярности и востребованности этого препарата лучше всего свидетельствуют цифры: в 70-е годы XX века в Великобритании ежегодно потреблялось почти 2 тысячи тонн АСК (в среднем по 2 таблетки в неделю на каждого жителя). Еще в начале 1990-х в отечественных и западных руководствах по ревматологии АСК рекомендовалась как препарат первой линии для проведения обезболивающей и противовоспалительной терапии при суставной патологии в начальной суточной дозе 3–4 г/сут [12, 13, 14].
Отношение к препаратам АСК, обусловленное ростом числа побочных эффектов, отражает знаменитое высказывание Д. Лоуренса и П. Бенитта: «…если бы в настоящее время пришлось вводить ацетилсалициловую кислоту, маловероятно, что кто-либо из ответственных лиц набрался смелости разрешить ее продажу населению».
По мнению А.Е. Каратеева [3], «…в руках опытного специалиста-терапевта НПВП являются надежным и удобным инструментом, позволяющим добиться быстрого облегчения страданий пациента и улучшения качества его жизни. Однако как и любой инструмент, эти препараты действенны и безопасны лишь в том случае, если их применяют правильно. Напротив, неумелое использование НПВП без учета их фармакологических свойств и индивидуальных особенностей пациента нередко оборачивается не только разочарованием в их эффективности, но и развитием опасных, угрожающих жизни осложнений». Именно поэтому тактика правильного назначения, выбора дозы и определения длительности приема, контроль не только прямого эффекта, но и возможных побочных реакций и осложнений НПВП, а при их развитии – своевременное и адекватное лечение – залог успеха в работе с пациентом.
Профилактика НПВП-гастропатии
Профилактике отрицательного действия НПВП на СО ЖКТ в настоящее время отводится ведущее место в терапии заболеваний, при которых необходимо назначение нестероидной противовоспалительной терапии [4].
Наиболее трудновыполнимыми мероприятиями, которые при этом обеспечивают хороший результат в снижении числа побочных действий, являются отказ от использования НПВП, минимизация суточной дозы препарата с сохранением адекватного противовоспалительного и противоболевого эффекта, а также замена НПВП на медикамент другой группы, с отсутствием повреждающего действия на СО ЖКТ. К сожалению, подобные меры возможно использовать далеко не во всех клинических случаях [1].
Действенной мерой профилактики осложнений служит выбор более безопасного по отношению к слизистым оболочкам верхних отделов ЖКТ НПВП.
Так, при приеме препаратов, в равной степени блокирующих ЦОГ-1 и ЦОГ-2 (неселективных НПВП), таких как пироксикам и индометацин, гастропатии развиваются достоверно чаще, чем при использовании препаратов селективного действия, в большей степени блокирующих «воспалительную» ЦОГ-2 и в меньшей степени «физиологичную» ЦОГ-1, таких как вольтарен и ибупрофен, мелоксикам.
Увеличение дозы селективных НПВП, к сожалению, делает риск НПВП-гастропатий равным таковому при применении неселективной группы препаратов. Так, по данным метаанализа D. Henry и соавт. [8], наименьший риск осложнений (желудочно-кишечного кровотечения и перфорации) выявлен при применении ибупрофена в низких дозах, большие дозы ибупрофена были ассоциированы с таким же риском осложнений, как и при приеме неселективных НПВП. В метаанализе S.C. Lewis и соавт. [10] наименьший риск желудочно-кишечного кровотечения был получен для ибупрофена (отношение шансов (ОШ) 1,7; 95% доверительный интервал 1,1–2,5), для диклофенака ОШ составило 4,9 (3,3–7,1), для индометацина – 6,0 (3,6–10,0), для напроксена – 9,1 (6,0–13,7), для пироксикама – 13,1 (7,9–21,8) и для кетопрофена – 34,9 (12,7–96,5).
Существует также ряд дополнительных факторов, увеличивающих риск развития НПВП-гастропатий и более значимых осложнений (эрозий и язв желудка, кровотечений). К ним относятся:
- возраст старше 65 лет;
- язвенная болезнь в анамнезе;
- большие дозы и/или одновременный прием нескольких НПВП;
- одновременный прием антикоагулянтов;
- сопутствующая терапия глюкокортикостероидами;
- продолжительность терапии НПВП;
- наличие заболевания, требующего длительного приема НПВП;
- женский пол;
- курение;
- прием алкоголя;
- наличие хеликобактерной инфекции.
Максимальная опасность развития кровотечения вне зависимости от принимаемого НПВП возникает на первой неделе приема (ОШ 11,7; 6,5–21,0), снижается при продолжении приема НПВП (5,6; 4,6–7,0) и становится минимальной через неделю после отмены (3,2; 2,1–5,1).
Применение цитопротективных препаратов, усиливающих защитные свойства слизистой оболочки ЖКТ от повреждения НПВП, малоэффективно как для купирования проявлений диспепсии, так и для уменьшения числа побочных действий НПВП у пациентов из групп риска, поэтому в настоящее время необходимость назначения цитопротекторов (мисопростол и др.) при использовании НПВП признается далеко не всеми исследователями и на практике применяется редко.
Вопросы медикаментозной профилактики побочных эффектов и осложнений при приеме НПВП обсуждаются на международных форумах специалистов. На сегодняшний день наиболее действенным методом признан одновременный прием НПВП и цитопротекторов или, что эффективнее, средств, снижающих кислотопродуцирующую активность желудка (антисекреторных препаратов).
Применение эффективных препаратов, уменьшающих продукцию кислых ионов и, соответственно, снижающих степень кислотной агрессии, прежде всего ингибиторов протонной помпы (ИПП), позволяет существенно снизить риск кровотечений в ЖКТ, развития и рецидивов язв верхних отделов ЖКТ, а также уменьшает выраженность диспепсии. При этом, по мнению А.Е. Каратеева [3], комбинация селективного НПВП и ИПП является более безопасной, нежели комбинация неселективного НПВП и ИПП. Это подтверждают результаты аналогичных по дизайну 6-месячных рандомизированных контролируемых исследований VENUS и PLUTO (n = 1378). Согласно полученным результатам, у больных, получавших ИПП в дозах 20 и 40 мг, на фоне приема неселективных НПВП отмечалось появление язв у 7 и 5% больных соответственно, в то время как у получавших селективные НПВП – лишь у 1 и 4% (p < 0,05) [5, 15].
Подтверждение необходимости одновременного с НПВП профилактического назначения ингибиторов кислотопродукции найдено и в результатах II фазы исследований OMNIUM и ASTRONAUT. Омепразол в суточной дозе 20 мг оказался более эффективным для вторичной профилактики эрозивно-язвенных поражений верхних отделов ЖКТ, чем мизопростол 400 мг и ранитидин 300 мг [16]. Критериями эффективности служили: отсутствие язвы, менее 5 эрозий гастродуоденальной слизистой оболочки, умеренно выраженная диспепсия. В качестве возможных методов первичной профилактики следует назвать назначение ИПП или мизопростола, а также проведение эрадикации H. pylori. Постулат о том, что эрадикация H. pylori, если она проводится до начала курса НПВП, снижает частоту язвообразования, включен в положения Третьего маастрихтского консенсуса.
Лечение эрозивно-язвенных поражений, вызванных приемом НПВС
Первый из наиболее значимых международных консенсусов, посвященный применению НПВП на основе данных доказательной медицины, состоялся на острове Сардиния в 2001 г. Одно из положений в опубликованных материалах консенсуса, удовлетворяющее высокому уровню доказательности, говорит о том, что с точки зрения эффективности и переносимости терапии ИПП являются препаратами выбора для заживления язвы, вызванной НПВП, особенно язвы желудка.
Этот вывод основан на результатах нескольких клинических исследований, в первую очередь OMNIUM (сравнение эффективности омепразола и мизопростола в лечении язв, вызванных НПВС [8]) и ASTRONAUT (сравнение эффективности омепразола и ранитидина [16]). Эти исследования проведены по одинаковому дизайну в две фазы: лечебная – с определением эффективности на 4-й, 8-й и 16-й неделе, и фаза вторичной профилактики (6 мес.). В исследования включали пациентов, постоянно принимающих НПВП (с ревматоидным артритом или остеоартрозом), при эндоскопически подтвержденных язве желудка, дуоденальной язве и/или эрозиях (не менее 10 эрозий гастродуоденальной слизистой оболочки).
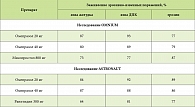
Результаты эффективности омепразола в заживлении эрозивно-язвенных поражений желудка и двенадцатиперстной кишки (ДПК), вызванных НПВП, по сравнению с мисопростолом представлены в таблице 1.
Установлено, что омепразол (в дозе 20 мг) достоверно более эффективен для рубцевания язв желудка, чем мизопростол (р = 0,004). Наибольшее преимущество он показал при рубцевании дуоденальных язв (р < 0,001). Интересно отметить, что при заживлении гастродуоденальных эрозий более выраженное действие оказывал синтетический аналог простагландина мизопростол
(р = 0,01). Вместе с тем при его применении у 11% больных была выявлена диарея, 8,9% пациентов жаловались на абдоминальную боль, 16,9% преждевременно завершили прием препарата. Омепразол в дозах 20 мг и 40 мг оказался более эффективным по сравнению с ранитидином в заживлении всех указанных поражений.
В приведенных исследованиях использован первый из современных препаратов группы антисекреторных средств – ингибиторов протонной помпы – омепразол. На сегодняшний день в распоряжении врачей имеются и другие представители этого класса ингибиторов кислотопродукции (лансопразол, пантопразол, эзомепразол, рабепразол). Действие указанной группы препаратов основано на механизме блокирования трансмембранного переноса протонов, осуществляемого специфическим ферментом – Н+/К+-зависимой АТФ-азой, или «протонной помпой». Надежное ингибирование поступления ионов водорода в просвет желудка обеспечивает двойной эффект: создаются условия для адекватной репарации СО за счет снижения агрессивных свойств желудочного содержимого, а изменение рН желудочного сока до рН 5–6 уменьшает активацию пепсиногена в пепсин до 20–30% от исходных величин, что снижает протеолитические свойства желудочного сока, а значит, уменьшает риск аутолиза кровяного сгустка (тромба), что позволяет уменьшить риск рецидива кровотечения за счет лизиса тромба, сформировавшегося в кровоточащем сосуде.
Особенность всех ИПП заключается в том, что активная форма этих соединений – сульфенамид, который является катионом, – не проходит через клеточные мембраны, остается внутри канальцев и не оказывает побочных эффектов. Скорость активации и эффективность применения ИПП зависят от рН среды и значения константы диссоциации (рКa) для каждого препарата. Оптимальным для всех ИПП является уровень рН от 1,0 до 2,0.
ИПП – самые мощные на сегодняшний день блокаторы желудочной секреции. Они угнетают выработку кислоты почти на 100%, причем ввиду почти полной необратимости фиксации с ферментом эффект сохраняется в течение нескольких дней, а восстановление продукции кислоты происходит через 4–5 суток, в связи с чем для них нехарактерен феномен рикошета.
ИПП, особенно препараты последних поколений, селективно связываются с двумя молекулами цистеина протонного канала и оказывают более сильное воздействие на Н+/К+-АТФ-азу, почти не влияя на цитохром Р450 и не взаимодействуя с другими лекарственными средствами, что позволяет использовать их в различных терапевтических комбинациях.
Применение современных ИПП редко сопровождается побочными эффектами. Вместе с тем при длительном их применении развивается умеренная гипергастринемия с некоторым увеличением количества энтерохромаффиноподобных (ECL) клеток, что обусловлено реакцией G-клеток СО желудка и двенадцатиперстной кишки в ответ на повышение рН в антральном отделе желудка.
Клинические особенности НПВП-гастропатий: клиническая картина с минимальным количеством жалоб, чаще диспепсического характера, невыраженность или полное отсутствие сигнального болевого синдрома за счет анальгетического действия НПВП; наличие медикаментозной нагрузки, связанной с лечением основного заболевания (НПВП или НПВП в комбинации с препаратами других групп), заставляют врача более тщательно выбирать как профилактические, так и лечебные средства при возникновении диспепсии или эрозивно-язвенных поражений ЖКТ. С учетом исследований последних лет всем этим требованиям отвечают ингибиторы протонной помпы. Учитывая высокую эффективность ИПП при кислотозависимых заболеваниях, врачу необходимо остановить свой выбор на одном из видов ингибиторов Н+/К+-АТФ-азы. Решающим фактором выбора является не скорость блокирования трансмембранного переноса ионов водорода и раннее купирование болевого синдрома (как правило, он не выражен или отсутствует), а постепенное и длительное по времени и интенсивное по выраженности ингибирование кислотопродукции.
Из присутствующих на рынке ингибиторов протонной помпы перечисленными качествами обладает пантопразол (Контролок), биодоступность которого составляет 77%, связывание с белками плазмы – 98%, а максимальная концентрация препарата в плазме достигается через 2–4 ч после приема. Прием пищи, а также путь введения препарата (пероральный или внутривенный) не оказывают влияния на его фармакокинетику. По сравнению с другими ИПП Контролок слабо влияет на активность системы цитохрома P450, что отчетливо снижает его влияние на метаболическую элиминацию одновременно принимаемых препаратов по сравнению с омепразолом или лансопразолом. При лечении эрозивно-язвенных поражений на фоне приема НПВП пантопразол рекомендуется использовать в дозе 40 мг/сут, причем более эффективное подавление желудочной секреции происходит при приеме препарата утром. Применение пантопразола показано также с целью длительной поддерживающей профилактики язвенных поражений верхних отделов желудочно-кишечного тракта. По данным H. Heinze и соавт. [7], использование пантопразола для лечения больных язвенной болезнью в течение 10 и более лет не сопровождалось рецидивами заболевания и существенными побочными эффектами, что полностью соответствует требованиям, предъявляемым к препарату для профилактики и лечения НПВП-гастропатий.
При длительном приеме Контролока происходит увеличение концентрации гастрина в крови. По данным одних авторов, через год после лечения содержание гастрина увеличивается в среднем в 3 раза [2], по данным других – в 2 раза, плато достигается к 9-му месяцу приема препарата. Содержание ECL-клеток в течение года лечения увеличивается незначительно – с 0,19 до 0,24%. Эти данные позволяют предполагать, что препарат пантопразола Контролок столь же безопасен, как и другие ИПП.
При этом Контролок, в отличие от омепразола и эзомепразола, не аккумулируется в организме после приема повторных доз. Линейная фармакокинетика обеспечивает эффективность препарата на протяжении всего курса лечения, начиная с первого дня его приема. Показатели фармакокинетики (AUC – 5,35 мг/ч/л, максимальная концентрация в плазме крови – 5,26 мг/л, период полувыведения – 1,11 ч) после внутривенного введения Контролока в дозе 30 мг/сут в течение 5 дней оказались сравнимыми с полученными после его однократного внутривенного введения [9].
Таким образом, можно утверждать, что препарат пантопразола Контролок в суточной дозе 40 мг является безопасным и высокоэффективным препаратом выбора для профилактики и терапии гастропатий и эрозивно-язвенных изменений, вызванных приемом нестероидных противовоспалительных средств, в том числе у пожилых пациентов с сопутствующими заболеваниями, требующими медикаментозного лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.