Нестероидные противовоспалительные препараты: вопросы безопасности
- Аннотация
- Статья
- Ссылки
- English
В большинстве случаев НПВП обладают сопоставимой эффективностью, поэтому профиль безопасности и переносимость становятся важнейшими характеристиками при выборе терапии.
В статье рассмотрен механизм действия НПВП и его роль в развитии нежелательных лекарственных реакций. Приведены результаты наиболее крупных клинических исследований и метаанализов, посвященных безопасности препаратов данной группы.
В большинстве случаев НПВП обладают сопоставимой эффективностью, поэтому профиль безопасности и переносимость становятся важнейшими характеристиками при выборе терапии.
В статье рассмотрен механизм действия НПВП и его роль в развитии нежелательных лекарственных реакций. Приведены результаты наиболее крупных клинических исследований и метаанализов, посвященных безопасности препаратов данной группы.


Введение
На сегодняшний день нестероидные противовоспалительные препараты (НПВП) широко применяются в клинической практике вследствие их анальгетического и противовоспалительного эффектов. Так, на долю НПВП приходится 8% всех назначений [1]. Наиболее часто препараты данной группы используются у пациентов старше 65 лет [1].
Механизм действия НПВП направлен на ингибирование различных изоформ циклооксигеназы (ЦОГ) – ЦОГ-1 и ЦОГ-2 [2]. ЦОГ-1 является конституциональным ферментом. Она постоянно присутствует в тканях и регулирует синтез участвующих в локальном гомеостазе простаноидов, таких как простагландины (ПГЕ2, ПГF2α, ПГD2, 15d-ПГJ2), простациклин (ПГI2) и тромбоксан А2 [3]. Именно с ингибированием ЦОГ-1 связывают значительную часть нежелательных лекарственных реакций, характерных для НПВП.
В отношении ЦОГ-2 длительное время считалось, что это индуцибельный фермент, который появляется лишь в ответ на воспаление. Однако не так давно обнаружена конституциональная ЦОГ-2. Она присутствует в организме в незначительных количествах и играет важную роль в развитии, а также функционировании головного мозга, тимуса, почек и желудочно-кишечного тракта [4].
Как было отмечено ранее, ЦОГ-2 участвует в развитии и поддержании воспалительных процессов [5]. Под действием ЦОГ-2 происходит активное образование ПГЕ2 и ряда других простаноидов, являющихся основными медиаторами воспаления. Избыточное образование ПГЕ2 сопровождается рядом патологических реакций: отеком, покраснением и гипералгезией [3].
Известно, что ПГЕ2 синтезируется из ПГН2 с помощью микросомальной ПГЕ2-синтетазы 1, цитозольной ПГЕ2-синтетазы и микросомальной ПГЕ2-синтетазы 2 [3, 6]. Цитозольная ПГЕ2-синтетаза работает согласованно с ЦОГ-1 и под воздействием данного фермента, а не ЦОГ-2, превращает ПГН2 в ПГЕ2, то есть регулирует выработку ПГЕ2 в норме [3]. Напротив, микросомальная ПГЕ2-синтетаза 1 является индуцибельной. Она работает согласованно с ЦОГ-2, но не ЦОГ-1, и преобразует ПГН2 в ПГЕ2 при наличии воспаления. Таким образом, именно микросомальная ПГЕ2-синтетаза 1 является одним из ключевых ферментов, регулирующих синтез такого значимого медиатора воспаления, как ПГЕ2 [3].
Активность микросомальной ПГЕ2-синтетазы 1 возрастает под действием провоспалительных цитокинов, например интерлейкина 1β и фактора некроза опухоли α.
В исследованиях последних лет показано, что представители группы оксикамов (например, мелоксикам) способны ингибировать микросомальную ПГЕ2-синтетазу 1 и за счет этого уменьшать выработку ПГЕ2 при воспалении.
Следовательно, оксикамы обладают как минимум двумя механизмами действия. Первый механизм, характерный и для других НПВП, обусловлен воздействием на ЦОГ, второй – ингибированием микросомальной ПГЕ2-синтетазы 1, что препятствует избыточному образованию ПГЕ2 [6].
Желудочно-кишечный тракт
Как все лекарственные средства, НПВП могут вызывать развитие нежелательных лекарственных реакций. Наиболее часто на фоне их применения регистрируются побочные явления со стороны желудочно-кишечного тракта (ЖКТ) [7]. Так, около 33% принимающих НПВП отмечают дискомфорт в эпигастрии, вздутие живота, тошноту после еды и отрыжку.
Однако данные симптомы не всегда свидетельствуют о повреждении слизистой оболочки желудка и двенадцатиперстной кишки. Так, во время фиброгастродуоденоскопии у 70% длительно получавших НПВП обнаруживали изменение слизистой оболочки желудка (эрозии, язвы и субэпителиальные кровоизлияния). У 10% из них наблюдались симптомы диспепсии [1].
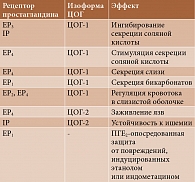
Применение НПВП является второй по значимости после Helicobacter pylori причиной развития язв верхних отделов ЖКТ [1]. Описаны два основных механизма негативного влияния препаратов на слизистую оболочку желудка: местное и системное. Некоторые НПВП являются кислотами и при попадании в желудок могут повреждать эпителий. Системное воздействие реализуется за счет ингибирования синтеза простагландинов через угнетение ЦОГ [8]. Как известно, простагландины играют значимую роль в защите слизистой оболочки желудка от воздействия соляной кислоты, при этом наиболее важными являются ПГЕ2 и ПГI2, образование которых регулируется ЦОГ-1 и ЦОГ-2. Установлено, что эти простагландины влияют на выработку соляной кислоты в желудке, секрецию бикарбонатов и слизи (табл. 1) [8].
Следует отметить, что ЦОГ-2 наряду с ЦОГ-1 участвует в поддержании нормальной функции желудка. Посредством регулирования выработки ПГЕ2, взаимодействующего с EP4, она способствует заживлению язвенных дефектов. Применение суперселективных ингибиторов ЦОГ-2 может увеличить срок заживления язв [8].
К факторам риска НПВП-индуцированного поражения желудка относят возраст 65 лет и старше, язвы желудка и двенадцатиперстной кишки в анамнезе, инфицирование H. pylori, тяжелую сопутствующую патологию, прием высоких доз и длительную терапию НПВП, а также одновременное применение глюкокортикостероидов, антиагрегантов, антикоагулянтов, антидепрессантов из группы селективных ингибиторов обратного захвата серотонина [9, 10].
Большинство исследований свидетельствуют также о более высоком риске поражения верхних отделов ЖКТ при назначении неселективных ингибиторов ЦОГ. Например, показано, что применение неселективных ингибиторов ЦОГ-2 по сравнению с отсутствием терапии НПВП значительно повышало риск развития серьезных осложнений со стороны верхних отделов ЖКТ – скорректированный относительный риск (ОР) 3,7 при 95%-ном доверительном интервале (ДИ) 3,1–4,3. Относительный риск таковых при использовании селективных ингибиторов ЦОГ-2 составил 2,6 (95% ДИ 1,9–3,6) [11].
Высокий риск развития серьезных осложнений отмечался также при назначении селективного ингибитора ЦОГ-2 эторикоксиба (ОР 12,0). Далее следовали напроксен (ОР 8,1) и индометацин (7,2). Наиболее безопасными признаны ибупрофен (ОР 2,0), рофекоксиб (2,3) и мелоксикам (ОР 2,7) (рисунок) [11].
Повышенный риск серьезных повреждений верхних отделов ЖКТ на фоне терапии эторикоксибом можно объяснить нарушением процесса заживления язв желудка за счет изменения выработки ПГЕ2, обусловленного ЦОГ-2.
Влияние на ЖКТ умеренно селективных ингибиторов ЦОГ-2 (набуметона, этодолака и мелоксикама) и коксибов (целекоксиба, эторикоксиба, парекоксиба и лумиракоксиба) оценивалось в сетевом метаанализе [12]. В него были включены результаты 36 исследований с общим числом участников 112 351. Возраст больных – от 36 до 72 лет (медиана – 61,4 года). Длительность наблюдения варьировалась от 4 до 156 недель (медиана – 12 недель). Вероятность развития осложненной язвы желудка в группе коксибов составила 0,15% (95% ДИ 0,05–0,34), в группе умеренно селективных ингибиторов ЦОГ-2 – 0,13% (95% ДИ 0,04–0,32). Разница оказалась статистически недостоверной. Вероятность возникновения симптоматической язвы желудка в группе коксибов и умеренно селективных ингибиторов – 0,18% (95% ДИ 0,01–0,74) и 0,21% (95% ДИ 0,04–0,62). Разница опять не была статистически достоверной. Статистически значимых различий между двумя группами НПВП не зафиксировано и в отношении язв желудка, выявленных при проведении гастроскопии [12]. Частота нежелательных явлений в обеих группах была сопоставимой (табл. 2) [12].
Нестероидные противовоспалительные препараты могут поражать и слизистую оболочку кишечника. При проведении видеокапсульной эндоскопии изменения в тонкой кишке (эрозии, язвы и субэпителиальные кровоизлияния) обнаружены у 70% принимавших препараты данной группы [13].
Следует отметить, что селективные ингибиторы ЦОГ-2 реже вызывали повреждение тонкой кишки. Однако при совместном их применении с ингибиторами протонной помпы (ИПП) наблюдалось изменение кишечной микробиоты, что в конечном итоге приводило к большей частоте случаев повреждения кишечника и анемии, чем при изолированном назначении [13].
Одновременное применение НПВП и ИПП также увеличивало риск развития микроскопического колита, проявляющегося в виде водянистой диареи [14].
В крупномасштабном исследовании «случай – контроль» установлено, что текущий прием НПВП ассоциировался с возрастанием риска развития микроскопического колита по сравнению с отсутствием терапии НПВП [14]. Так, скорректированное отношение шансов составило 1,86 (95% ДИ 1,39–2,49). Совместный прием НПВП и ИПП повышал указанный риск в пять раз [14].
Сердечно-сосудистая система
Для профилактики инфаркта миокарда, инсульта и сердечно-сосудистой смерти повсеместно используют ацетилсалициловую кислоту [15]. В отличие от ацетилсалициловой кислоты, которая в низких дозах способствует уменьшению частоты ишемических осложнений со стороны сердечно-сосудистой системы, многие НПВП могут оказывать на нее негативное влияние, приводя к дестабилизации артериального давления и тромбоэмболическим осложнениям [7].
Указанные эффекты обусловлены влиянием НПВП на функцию тромбоцитов и эндотелия.
Важную роль в регуляции агрегации тромбоцитов играет соотношение «простациклин/тромбоксан А2». Если первый является естественным антиагрегантом, второй, напротив, стимулирует агрегацию тромбоцитов.
При назначении селективных ингибиторов ЦОГ-2 синтез простациклина снижается, тромбоксана А2 остается на том же уровне (процесс контролируется ЦОГ-1). Это приводит к активации и усиленной агрегации тромбоцитов [7].
В связи со сказанным особый интерес могут представлять результаты крупномасштабного ретроспективного обсервационного когортного исследования, целью которого было выявить связь между применением НПВП и риском возникновения острого инфаркта миокарда у пациентов с остеоартритом и хронической болью в нижней части спины [16]. Для этого были проанализированы данные более 180 тыс. пациентов. Общая частота развития события составила 10,27 на 10 тыс. пациенто-лет (95% ДИ 9,20–11,34). В ходе исследования также была установлена зависимость указанного риска от длительности приема НПВП. У получавших НПВП более пяти лет риск острого инфаркта миокарда повышался в два раза по сравнению с пациентами, применявшими их менее года, – 21,66 против 9,68 на 10 тыс. пациенто-лет.
Риск развития осложнений со стороны сердечно-сосудистой системы также связан с селективностью НПВП в отношении изоформ ЦОГ.
Так, в систематическом обзоре и метаанализе 42 обсервационных исследований установлено, что такие селективные ингибиторы ЦОГ-2, как этодолак и эторикоксиб, в большей степени повышали риск развития инфаркта миокарда – ОР 1,55 и 1,97 соответственно [17]. Напроксен, целекоксиб, ибупрофен и мелоксикам практически не увеличивали риск развития тромботических осложнений со стороны сердечно-сосудистой системы.
Препараты рассматриваемой группы ассоциируются с развитием или ухудшением течения хронической сердечной недостаточности.
Согласно результатам крупномасштабного метаанализа, назначение селективных ингибиторов ЦОГ-2 и высоких доз традиционных НПВП, таких как диклофенак, ибупрофен и напроксен, в 1,9–2,5 раза повышало вероятность госпитализации по причине ухудшения течения хронической сердечной недостаточности по сравнению с использованием плацебо [18].
В крупном исследовании «случай – контроль» показано, что использование НПВП в течение 14 дней увеличивало риск госпитализации по причине прогрессирования хронической сердечной недостаточности на 19% [19]. Наиболее высоким он был на фоне лечения кеторолаком – 1,83. При применении этодолака, целекоксиба, мелоксикама и ацеклофенака данный показатель практически не возрастал [19].
Негативное влияние НПВП на течение хронической сердечной недостаточности обусловлено повышением периферического сосудистого сопротивления за счет вазоконстрикции, задержкой Na и воды, что приводит к увеличению объема циркулирующей крови и повышению артериального давления [7].
Почки
Нефротоксичность – одна из распространенных нежелательных реакций при использовании НПВП [20]. Она может проявляться в виде преренальной азотемии, гипоренинового гипоальдостеронизма, задержкой Na в организме, гипертензией, острым интерстициальным нефритом и нефротическим синдромом [15].
Основной причиной нарушения функции почек считается влияние НПВП на синтез ряда простагландинов. Одним из ключевых признан ПГЕ2. Взаимодействуя с ЕР1, он угнетает реабсорбцию Na+ и воды в собирательном протоке, то есть оказывает натрийуретический эффект. ЕР3 участвует в задержке всасывания воды и NaCl в почках, а ЕР4 регулирует гемодинамику в почечных клубочках [21]. Простациклин расширяет артериолы почек. Тромбоксан А2 обладает выраженным сосудосуживающим эффектом в отношении капилляров клубочка, что приводит к уменьшению скорости клубочковой фильтрации. Таким образом, снижение выработки ПГЕ2 и ПГI2, вызванное НПВП, будет сопровождаться недостаточным притоком крови к почкам, задержкой Na и воды.
Важным фактором острого повреждения почек на фоне терапии НПВП признано нарушение функции почек в анамнезе.
Так, в отсутствие исходного нарушения функции почек риск острого повреждения на фоне НПВП составлял 6 случаев на 1000 пациенто-дней, при наличии такового – 22 случая [20].
В ряде исследований установлено, что как селективные, так и неселективные НПВП способны вызывать острое нарушение функции почек [22–24].
Применение неселективных НПВП рассматривается в качестве одной из причин развития хронической почечной недостаточности [15].
Результаты двух эпидемиологических исследований свидетельствуют, что на фоне лечения НПВП относительный риск развития хронической почечной недостаточности составлял 2–8 [25, 26].
В крупномасштабном ретроспективном исследовании по оценке влияния различных НПВП на развитие острого нарушения функции почек, которое определялось как прирост уровня креатинина свыше 50%, более чем у 350 тыс. пациентов применение НПВП сопровождалось увеличением риска указанного события по сравнению с отсутствием использования препаратов данной группы (скорректированный ОР 1,82 (95% ДИ 1,68–1,98)) [27]. Риск поражения почек значительно варьировался у разных НПВП. При этом токсичность препарата возрастала с уменьшением его селективности в отношении ЦОГ-2. Например, рофекоксиб (ОР 0,95), целекоксиб (ОР 0,96) и мелоксикам (ОР 1,13) практически не оказывали отрицательного влияния на функцию почек. В то же время индометацин (ОР 1,94), кеторолак (ОР 2,07), ибупрофен (ОР 2,25) и высокие дозы ацетилсалициловой кислоты (ОР 3,64) значимо повышали риск нарушения функции почек [27].
Следовательно, пациентам с высоким риском нарушения функции почек следует избегать назначения как неселективных НПВП в высоких дозах, так и суперселективных ингибиторов ЦОГ-2, которые могут вызывать нарушение функции почек.
Заключение
На сегодняшний день в клинической практике применяется большое количество НПВП, которые различаются как по эффективности, так и по спектру нежелательных лекарственных реакций.
Профиль безопасности НПВП во многом определяется их селективностью в отношении изоформ ЦОГ. Например, неселективные НПВП обладают гастротоксическими эффектами, могут ухудшать работу почек. Высокоселективные ингибиторы ЦОГ-2, прежде всего коксибы, чаще вызывают тромботические осложнения – инфаркт и инсульт.
Данные многочисленных клинических исследований и метаанализов свидетельствуют, что НПВП со средним индексом селективности в отношении ЦОГ-2, например мелоксикам, в значительной степени лишены нежелательных лекарственных реакций, присущих как неселективным, так и суперселективным НПВП.
Следует отметить, что в Российской Федерации помимо оригинального мелоксикама (Мовалис®, компания «Берингер Ингельхайм») зарегистрирован целый ряд генериков, которые могут отличаться от него эффективностью, переносимостью и профилем безопасности [28]. В связи с этим интерес могут представлять исследования, в которых сравнивалась эффективность оригинальных препаратов и генериков. Например, в рандомизированном исследовании Е.В. Яковлева и соавт. оценивалась эффективность оригинального препарата мелоксикама (Мовалис®, компания «Берингер Ингельхайм») и воспроизведенного (Амелотекс®, ЗАО «ФармФирма „Сотекс“») у пациентов с болью в нижней части спины [28]. Терапия оригинальным препаратом (Мовалис®) оказалась более эффективной, чем воспроизведенным (Амелотекс®), по таким показателям, как сроки уменьшения интенсивности болевого синдрома, общая продолжительность временной нетрудоспособности. Средний срок уменьшения интенсивности боли – 5,00 ± 1,40 против 7,37 ± 1,68 дня, среднее значение трудопотерь – 6,43 ± 1,40 против 8,61 ± 1,59 дня [28]. Наряду с этим назначение препарата Мовалис® сопровождалось более существенным улучшением состояния, определяемого по Шкале общего клинического впечатления, во всех возрастных группах.
Таким образом, результаты исследования не подтвердили терапевтическую эквивалентность генерика Амелотекс® оригинальному препарату Мовалис®.
С учетом большого количества генериков мелоксикама на отечественном фармацевтическом рынке требуется дальнейшее проведение сравнительных исследований оригинального препарата с воспроизведенными для установления их терапевтической эквивалентности.
Ye.V. Dovgan, PhD
Smolensk Regional Clinical Hospital
Contact person: Yevgeny V. Dovgan, dovganrus@mail.ru
Nonsteroidal anti-inflammatory drugs (NSAIDs) are widely used for the treatment of a number of diseases.
In the most cases, NSAIDs have comparable clinical efficacy, so the safety profile and tolerability become the most important characteristics for the selection of the therapy.
Paid special attention to the mechanism of their action and its role in the development of undesirable drug reactions. Presented the results of the largest clinical studies and meta-analyses devoted to the safety of NSAIDs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.