Об ошибках метаанализов сердечно-сосудистых эффектов омега-3 ПНЖК. Часть 2. Интеллектуальный анализ данных и метаанализ клинически однородных исследований
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Метрический и топологический анализ больших данных.
Результаты. С помощью современных методов анализа данных показано, что авторы публикации CD003177 о клинической неэффективности омега-3 ПНЖК включили в проведенные ими метаанализы исследования, которые в высшей степени неоднородны с клинической точки зрения. Проведенный нами метаанализ 19 клинически однородных исследований (n = 64 771) продемонстрировал достоверное снижение смертности от всех причин на 5% на каждые 1 г/сут эйкозапентаеновой и докозагексаеновой кислот (относительный риск 0,95; 95%-ный доверительный интервал 0,91–1,01; p = 0,0542). Преимущества настоящего метаанализа перед публикацией CD003177 очевидны: более точный учет клинических особенностей когорт пациентов, включенных в метаанализ; учет фундаментальных основ фармакологии омега-3 ПНЖК; использование современных методов интеллектуального анализа данных, позволивших выделить выборку клинически однородных исследований как кластер в соответствующем метрическом пространстве.
Заключение. Показано, что метаанализ CD003177 основан на чисто пропагандистских приемах и неадекватном использовании аналитического инструментария, а не какой-либо физической реальности. Метаанализ 19 клинически однородных исследований подтверждает эффективность омега-3 ПНЖК для сердечно-сосудистой профилактики.
Работа проведена при поддержке грантов РФФИ 18-07-01022, 18-07-00944, 19-07-00356, 17-07-00935, 18-07-00929
Материал и методы. Метрический и топологический анализ больших данных.
Результаты. С помощью современных методов анализа данных показано, что авторы публикации CD003177 о клинической неэффективности омега-3 ПНЖК включили в проведенные ими метаанализы исследования, которые в высшей степени неоднородны с клинической точки зрения. Проведенный нами метаанализ 19 клинически однородных исследований (n = 64 771) продемонстрировал достоверное снижение смертности от всех причин на 5% на каждые 1 г/сут эйкозапентаеновой и докозагексаеновой кислот (относительный риск 0,95; 95%-ный доверительный интервал 0,91–1,01; p = 0,0542). Преимущества настоящего метаанализа перед публикацией CD003177 очевидны: более точный учет клинических особенностей когорт пациентов, включенных в метаанализ; учет фундаментальных основ фармакологии омега-3 ПНЖК; использование современных методов интеллектуального анализа данных, позволивших выделить выборку клинически однородных исследований как кластер в соответствующем метрическом пространстве.
Заключение. Показано, что метаанализ CD003177 основан на чисто пропагандистских приемах и неадекватном использовании аналитического инструментария, а не какой-либо физической реальности. Метаанализ 19 клинически однородных исследований подтверждает эффективность омега-3 ПНЖК для сердечно-сосудистой профилактики.
Работа проведена при поддержке грантов РФФИ 18-07-01022, 18-07-00944, 19-07-00356, 17-07-00935, 18-07-00929



Введение
В первой части статьи мы показали, что доказательная медицина нуждается в клинически и фармакологически грамотных специалистах, а также специалистах по интеллектуальному анализу данных (data mining), в том числе больших данных (big data) [1]. На примере детального разбора кохрейновской публикации CD003177 [2] продемонстрировано, что пренебрежение современными постгеномными технологиями и методами анализа больших данных при проведении метаанализов может усугубляться крайне низким уровнем профессионализма некоторых авторов метаанализов. Действительно, когда в метаанализ по кардиологическим исходам включаются исследования, посвященные вопросам дегенерации макулы или заболеваемости раком, постоянно путаются фармакология (refined eicosapentaenoic acid (EPA), docosahexaenoic acid (DHA) or alpha-linolenic acids, or concentrated fish or algal oils, were also accepted) и кулинария (foodstuffs or supplements must have been: oily fish including mackerel, dogfish, salmon, herring, trout, tuna, sturgeon, stablefish, anchovy, sprat, coho, capelin, sardines, swordfish, sild, pilchard, brisling,menhaden, bloater,whitebait, crab and conger eel) [2] и, к сожалению, используются формулировки, скрывающие научные факты, существенно снижается престиж метаанализов по типу кохрейновских [3], особенно в эпоху больших данных (big data).
В первой части статьи мы описали множество нарушений клинико-фармакологического характера, допущенных при выполнении кохрейновского метаанализа CD003177. Помимо путаницы, связанной с тотальным непониманием его авторами основ фармакологии омега-3 ПНЖК, имеется очевидное нарушение – отсутствие адекватных оценок клинической однородности исследуемых когорт пациентов.
В этой части статьи рассмотрим, как современные методы анализа данных позволяют преодолевать «кризис доказательности». Поскольку ни авторы кохрейновского метаанализа CD003177, ни собственно журнал Cochrane Database of Systematic Reviews не предоставили никаких данных в машинно-читаемом формате (например, таблицы Excel, базы данных SQL), нам пришлось последовательно применить несколько методов интеллектуального анализа данных, чтобы извлечь интересующую нас информацию непосредственно из публикации CD003177 и провести последующие анализы. Ниже представлены результаты проведенных нами анализов исхода «смертность от всех причин», наглядно иллюстрирующие совместимость методов интеллектуального анализа данных и реального клинического опыта и полную несовместимость «доказательной характеристики» исследований с какой-либо реальностью.
Оценка клинической однородности/неоднородности исследований методами интеллектуального анализа данных – принципиальное условие получения адекватных результатов метаанализов
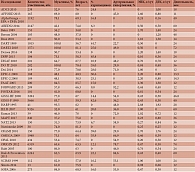
В результате применения разработанных нами ранее алгоритмов анализа научных текстов на основе комбинаторной теории разрешимости [4–6] нам удалось извлечь из публикации CD003177 описание всех исследований в форме таблицы. В таблицу, извлеченную нами из текста публикации CD003177, вошло 79 исследований. Информация о каждом из них представлена в виде вектора из 27 параметров: название исследования, число пациентов в группе омега-3 и контрольной группе, наличие патологий (ишемическая болезнь сердца (ИБС), сахарный диабет (СД) 2-го типа, артериальная гипертензия (АГ), аритмии, не сердечно-сосудистая патология), процент мужчин, средний возраст, стандартное отклонение возраста, процент курильщиков, доступность описаний приема препаратов (ингибиторы ангиотензинпревращающего фермента (иАПФ)/антирениновые препараты, диуретики, антиаритмические препараты, антикоагулянты/антиагреганты, блокаторы кальциевых каналов, статины, бета-блокаторы), дозы эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК), длительность исследования, использование стандартизированных форм омега-3 полиненасыщенных жирных кислот (ПНЖК) (например, этиловые эфиры), регион мира (Европа, Азия, Северная Америка). Фрагмент экстрагированных данных приведен в табл. 1.
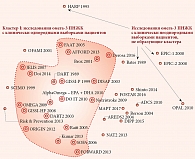
Для выделения подгрупп (кластеров) однородных исследований из всех перечисленных в табл. 1 мы использовали метод анализа метрических сгущений и метрических карт. Это один из наиболее аккуратных и чувствительных методов кластеризации [7], разработанный для высокоточного анализа больших данных [8]. Для применения метода метрических сгущений необходимо определить соответствующую функцию расстояния между парой исследований, которая удовлетворяет неравенству треугольника и другим аксиомам метрики [9]. На основании 27-компонентных векторных описаний исследований, перечисленных в табл. 1, мы вычисляли соответствующие расстояния между парами всех исследований с использованием различных метрик (Lp-метрика, «инженерная полуметрика», метрика Колмогорова – Смирнова [10]) и в сформированных таким образом матрицах расстояний искали сгущения (кластеры) исследований. При использовании всех трех метрик был выделен единственный кластер исследований, то есть подмножество клинически близких или однородных исследований, представленный на метрической карте (рис. 1).
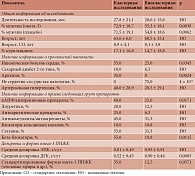
Таким образом, с помощью методов интеллектуального анализа данных нами был выявлен кластер клинически близких (однородных) исследований (рис. 1): AFFORD 2013, AlphaOmega – EPA + DHA 2010, Brox 2001, DART 1989, DART2 2003, Derosa 2016, DISAF 2003, DO IT 2010, Doi 2014, FAAT 2005, FORWARD 2013, GISSI-HF 2008, GISSI-P 1999, JELIS 2007, Kumar 2013, Nutristroke 2009, OMEGA 2009, ORIGIN 2012, Raitt 2005, SOFA 2006 (исследования указаны в алфавитном порядке). Между исследованиями в кластере (клинически более однородными) и остальными исследованиями (внекластерными) существуют многочисленные отличия в характеристиках когорт пациентов (табл. 2).
Кластерные и внекластерные исследования не отличались по длительности (28 ± 22 месяца), среднему возрасту участников (61,5 ± 15 лет) и стандартному отклонению среднего возраста (8,5 ± 4 года), указанному проценту курильщиков, встречаемости СД 2-го типа, АГ, наличию в описании исследований информации о приеме препаратов, таких как диуретики, антиаритмики, блокаторы кальциевых каналов, статины, антикоагулянты/антиагреганты. Участников кластерных исследований было несколько больше (суммарно 64 771), чем внекластерных (суммарно 22 274), хотя данные различия недостоверны (p = 0,099). В то же время исследования в кластере клинически однородных исследований характеризовались достоверно большим процентом мужчин (72,9 ± 18,7%) (внекластерные – 55,3 ± 18,1%; p = 0,0038), большей встречаемостью ИБС (диагноз указан в 55% кластерных исследований и 25% внекластерных; p = 0,0345), аритмии (35%) (внекластерные – 0%; p = 0,0024) и практически полным отсутствием когорт без сердечно-сосудистых патологий (0%) (внекластерные – 75%; p = 4 ×10-6). Исследования в кластере отличались более детальной информацией о приеме пациентами иАПФ/антирениновых препаратов (60%) (внекластерные – 25%; p = 0,0171) и бета-блокаторов (55%) (внекластерные – 18,8%; p = 0,0115). Во внекластерных исследованиях информация о приеме этих препаратов встречалась реже.
Поскольку когорты в кластере характеризовались отчетливым профилем сердечно-сосудистой патологии, им чаще назначались именно стандартизированные формы омега-3 ПНЖК (например, этиловые эфиры) – 35% (внекластерные – 12,5%; p = 0,0571), а не так называемый рыбий жир. Интересно, что в кластерных исследованиях отмечались достоверно более низкая дозировка ДГК (0,52 ± 0,45 г/сут), чем во внекластерных (0,90 ± 0,46 г/сут; p = 0,0085), и меньшая суммарная доза ЭПК + ДГК (1,33 ± 0,49 г/сут). Внекластерные исследования характеризовались большей средней дозой и гораздо большим разбросом дозировок ДГК + ЭПК (1,85 ± 1,0 г/сут; p = 0,011). Все эти отличия между кластерными и внекластерными исследованиями косвенно подтверждают правильность проведенной кластеризации, которая позволила отделить более клинически однородные исследования от клинически более гетерогенных, внекластерных исследований.
Рассмотрим, как авторы кохрейновской публикации CD003177 характеризуют исследования из выделенного нами кластера клинически однородных. Анализ наиболее информативных ключевых слов показал, что в описаниях кластерных исследований достоверно чаще встречаются слова «ИБС», «многопрофильный стационар», «стратификация», «инфаркт миокарда» (ИМ), «антикоагулянты», «эфиры ПНЖК», «иАПФ» и др. (табл. 3). Эти различия соответствуют описанным ранее особенностям кластерных исследований: преобладание пациентов с ИБС и назначение стандартизированных форм омега-3 ПНЖК. В то же время в описаниях кластерных исследований чаще встречаются слова «оценка исследования» (в 41,4 раза чаще, чем в описаниях внекластерных исследований) и «низкое (качество)» (в шесть раз чаще). Эти различия могут указывать на предвзятое отношение авторов кохрейновской публикации CD003177 к исследованиям с лучшей клинической характеризацией когорт пациентов. В описаниях кластерных исследований практически полностью отсутствуют термины «капсулы» и «лекарства» (medications), что также подтверждает некое особое отношение (special relation) авторов публикации CD003177 к описанию клинически более грамотных исследований.
Таким образом, нами был сформирован перечень из 19 клинически однородных исследований, в которых:
- когорты пациентов были наиболее схожими между собой;
- преобладали пациенты с ИБС;
- достоверно чаще назначались стандартизированные формы омега-3 ПНЖК (а не «рыбий жир»).
Проведенный нами метаанализ 19 клинически однородных исследований (n = 64 771) включал объединенную группу участников, принимавших омега-3 ПНЖК (n = 32 407), и объединенную группу плацебо (n = 32 364). Метаанализ 19 исследований показал достоверное снижение смертности от всех причин на 5% на каждые 1 г/сут ЭПК + ДГК (относительный риск (ОР) 0,95, 95%-ный доверительный интервал (ДИ) 0,91–1,01; p = 0,0542) (рис. 2). Преимущества нашего метаанализа перед публикацией CD003177 [2] очевидны:
- более точная клиническая характеризация когорт, включенных в метаанализ;
- учет важных особенностей фармакологии омега-3 ПНЖК;
- использование современных методов интеллектуального анализа данных, позволившее автоматически найти выборку клинически однородных исследований как кластер в соответствующем метрическом пространстве.
Рассмотрим еще одну процедуру метрического анализа данных, которая наглядно иллюстрирует устойчивость полученных нами результатов. Описанная ниже процедура аналогична «делеционному подходу», используемому при анализе генетических ассоциаций [11].
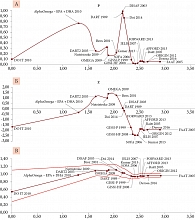
Сначала определим центр кластера как точку с минимальной суммой расстояний до всех остальных точек [8, 9]. В соответствии с этим определением, таким центром является исследование DO IT 2010. Затем упорядочим все исследования в кластере по возрастанию расстояния Колмогорова – Смирнова от центра кластера. Большее расстояние от центра соответствует большему отличию исследования от всех остальных исследований в кластере. После этого проведем серию метаанализов: сначала первые два «наиболее центральных» исследования, затем первые три, первые четыре и т.д. Для каждого из метаанализов в этой серии вычислим соответствующие статистические показатели. Очевидно, цель такой методики проведения серии метаанализов – оценить эффекты постепенного включения все более и более неоднородных исследований в метаанализ. Результаты проведенных вычислений представлены в табл. 4 и на рис. 3.
Результаты проведенной серии метаанализов «от центра к периферии кластера» указывают на достаточно высокую устойчивость полученных результатов. Наиболее наглядно это иллюстрируют кривые, соответствующие относительному риску и 95% ДИ (рис. 3В). Последовательное включение исследований в метаанализ сначала приводит к росту значений ОР. Затем, после последовательного включения исследований DART 1989, Doi 2014, GISSI-P и GISSI-HF, происходит стабилизация значений ОР и 95% ДИ. При включении в серию метаанализов клинически неоднородных (внекластерных) исследований наблюдается постепенное увеличение значений ОР и p, приводящее к потере статистической значимости результатов каждого последующего метаанализа.
Приведенные выше результаты метаанализа клинически однородных исследований омега-3 ПНЖК подтверждаются результатами недавно опубликованного крупномасштабного исследования REDUCE-IT (авторы метаанализа CD003177 даже не упомянули это исследование). Исследование REDUCE-IT является кластерным. В этом международном рандомизированном двойном слепом плацебоконтролируемом исследовании участвовали 8179 пациентов с сосудистой патологией и нарушениями липидного профиля (уровень триглицеридов – 1,52–5,63 ммоль/л при нормальном уровне липопротеинов низкой плотности – 1,06–2,59 ммоль/л), получавших статины. Пациенты были рандомизированы на группу этил-ЭПК 4 г/сут (n = 4089) и группу плацебо (n = 4090). Наблюдение продолжалось 4,9 года. Частота встречаемости ишемических событий (сердечно-сосудистая смертность, нефатальный ИМ/ишемический инсульт, реваскуляризация коронарных артерий, нестабильная стенокардия) составила 17,2% в группе этил-ЭПК и 22,0% в группе плацебо (отношение шансов 0,75; 95% ДИ 0,68–0,83; p < 0,001). Таким образом, стандартизированная фармакологическая форма омега-3 ПНЖК, этил-ЭПК, способствует снижению риска ишемических событий (включая сердечно-сосудистую смерть), причем несмотря на использование статинов [12]. Очевидно, кластерное исследование REDUCE-IT только усилит результаты метаанализа, представленные на рис. 2 и 3.
Заключение
На примере разбора кохрейновского метаанализа CD003177 мы показали, что помимо существенных пробелов в области кардиологии и фармакологии [13] современные нам адепты доказательности безнадежно отстают по части интеллектуального анализа данных (data mining), машинного обучения (machine learning), анализа больших данных (big data analysis) [14]. Можно предположить, что такого рода «исследователи» от доказательной медицины просто боятся использовать технологии искусственного интеллекта, ведь эти технологии позволяют мгновенно выявлять абнормальность данных, нарушение анализа данных, несостоятельность выводов (inconsistency), а иногда и подтасовку данных в «заказных» метаанализах.
Чтобы скрыть серьезное отставание в технологиях интеллектуального анализа данных, адепты доказательности прибегают к манипулятивным приемам в стиле желтой прессы и другим формам политиканства. Одним из таких приемов является полное игнорирование не только современных методов анализа данных (которые они не смогли освоить), но также азов клинической эпидемиологии, фармакологии и биохимии. Второй прием – выбор волюнтаристских (arbitrary) критериев качества и однородности клинических исследований, о чем подробно говорилось в первой части статьи.
Третий и основной прием – полное подавление любой научной дискуссии в данной области, искоренение инакомыслия и введение в буквальном смысле слова тоталитарного диктата волюнтаристски выбранных «критериев качества». С точки зрения специалиста по интеллектуальному анализу данных, самое поразительное в этой ситуации то, что непроверенные надуманные «критерии качества» повсеместно навязываются как «крайне необходимые стандарты» [15]. При этом навязывание обусловлено не привлекательностью стандартов, а большим административным ресурсом определенных индивидуумов. Фактически имеет место тоталитарный диктат. Будучи навязанными, эти методы используются для проведения метаанализов и принятия уже более конкретных рекомендаций по лечению миллионов пациентов.
В свете приведенных выше примеров вполне понятно, что догматическая приверженность чрезвычайно упрощенным, шаблонным моделям мышления (также известная как редукционизм) неизбежно сказывается не только на «доказательности» дорогостоящих исследований. Редукционизм также приводит к грубым ошибкам в фармакотерапевтическом и нутрициальном ведении пациентов. Возникает закономерный вопрос: почему такая уважаемая организация, как Всемирная организация здравоохранения, должна приносить миллионы людей в жертву молоху псевдодоказательности, принимая важные решения об использовании или неиспользовании препаратов омега-3 ПНЖК для сердечно-сосудистой профилактики на основании безграмотных метаанализов, публикуемых под торговой маркой кохрейновских?
Исследования, претендующие на доказательность, имеют единственное оправдание: свободный и неограниченный доступ каждого исследователя к данным об индивидуальных пациентах, включенных в исследования (конечно же с соблюдением всех норм по деперсонализации и сокрытию идентичности пациентов). Именно это и позволяет проводить адекватные метаанализы с данными индивидуальных пациентов (individual patient data meta-analysis). Если подобная информация не предоставлена мировому исследовательскому сообществу, то такое исследование вообще нельзя считать доказательным, поскольку отсутствие публичного доступа к данным позволяет скрывать многочисленные грубейшие ошибки анализа данных. Если свободного доступа к данным нет, адепты доказательной медицины мало чем отличаются от адептов тоталитарных сект.
Part 2. Intellectual Analysis and Meta-Analysis of Clinically Homogeneous Studies
I.Yu. Torshin, PhD, O.A. Gromova, DM, Prof., Zh.D. Kobalava, DM, Prof.
‘Informatics and Management’ Federal Research Center of RAS, Institute of Pharmacoinformatics
Center for Technologies of Big Data Storage and Analysis, M.V. Lomonosov Moscow State University
Faculty of Fundamental Medicine, M.V. Lomonosov Moscow State University
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
The aim – to consider the modern methods of intellectual analysis, allowing to eliminate errors of clinical, pharmacological and analytical nature, made during the implementation of Cochrane meta-analysis CD003177.
Material and methods. Metric and topological analysis of big data.
Results. Using modern methods of data analysis, it is shown that the authors of the publication CD003177 on the clinical inefficiency of omega-3 PUFA included in their meta-analyses studies, which are highly heterogeneous from a clinical point of view. Our meta-analysis of 19 clinically homogeneous studies (n = 64 771) showed a significant reduction in all-cause mortality by 5% for every 1 g/day of eicosapentaenoic and docosahexaenoic acids (relative risk 0.95; 95% confidence interval 0.91–1.01; p = 0.0542). The advantages of this meta-analysis over the publication of CD003177 are obvious: more accurate account of the clinical features of the patients’ cohorts included in the meta-analysis; taking into consideration the fundamentals of omega-3 PUFA pharmacology; the use of modern methods of intellectual analysis, which allowed to select a sample of clinically homogeneous studies as a cluster in the corresponding metric space.
Conclusion: it is shown that CD003177 meta-analysis is based on purely propaganda techniques and inadequate use of analytical tools, rather than any physical reality. Meta-analysis of 19 clinically homogeneous studies confirms the effectiveness of omega-3 PUFA for cardiovascular prevention.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.