Дополнительные биохимические предикторы развития сердечно-сосудистых осложнений у больных с риском по SCORE < 5%: данные десятилетнего наблюдения
- Аннотация
- Статья
- Ссылки
- English
Цель исследования: оценить вклад дополнительных биохимических маркеров в стратификацию пациентов с риском ССО по SCORE < 5% по данным десятилетнего наблюдения.
Материал и методы. 557 больных (100 мужчин и 457 женщин) с риском ССО по SCORE < 5% проходили обследование в 2009 г. в рамках Программы разработки новых методов и технологий профилактики, диагностики и лечения сердечно-сосудистых заболеваний, связанных с атеросклерозом, в лечебных учреждениях Западного административного округа г. Москвы. Пациентам выполнялось стандартное клиническое обследование, включавшее биохимический анализ крови. В 2019 г. проведен телефонный опрос для выявления ССО за прошедшее время: смерти от сердечно-сосудистых заболеваний (ССС), острого инфаркта миокарда (ОИМ), острых нарушений мозгового кровообращения (ОНМК), случаев реваскуляризации, госпитализации по сердечно-сосудистым причинам.
Результаты. За истекшие десять лет в изучаемой группе произошло девять (1,6%) ССС, десять ОИМ, 11 случаев развития нестабильной стенокардии, 28 реваскуляризаций, 21 ОНМК, 154 госпитализации по сердечно-сосудистым причинам. 116 (20,8%) пациентов перенесли те или иные ССО. У них исходно были достоверно выше уровни триглицеридов (ТГ), аспартатаминотрансферазы (АСТ), мочевой кислоты, мочевины, а также уровень систолического артериального давления (САД). Выявлена слабая, но достоверная корреляция между количеством ССО и уровнем ТГ (r = 0,105; p = 0,01), АСТ (r = 0,106; p = 0,03), мочевой кислоты (r = 0,130; p = 0,005), мочевины (r = 0,128; p = 0,04) в плазме крови, а также уровнем САД (r = 0,104; p = 0,01). По данным многофакторного регрессионного анализа, независимым предиктором развития ССО служили уровни САД, мочевой кислоты, мочевины, а также мужской пол. В логистической модели, включавшей пол, наличие артериальной гипертензии, уровни мочевины, мочевой кислоты, аланинаминотрансферазы/АСТ выше нормальных значений, риск развития ССО возрастал на фоне увеличения уровня мочевины (отношение шансов (ОШ) 8,4 (95%-ный доверительный интервал (ДИ) 1,12–10,1; p = 0,03) и мочевой кислоты (ОШ 3,4; 95% ДИ 2,1–33,3; p = 0,002).
Заключение. Такие биохимические показатели, как уровень мочевой кислоты и мочевины, могут рассматриваться в качестве дополнительных факторов риска развития ССО у больных низкого/умеренного риска, рассчитанного по стандартным шкалам.
Цель исследования: оценить вклад дополнительных биохимических маркеров в стратификацию пациентов с риском ССО по SCORE < 5% по данным десятилетнего наблюдения.
Материал и методы. 557 больных (100 мужчин и 457 женщин) с риском ССО по SCORE < 5% проходили обследование в 2009 г. в рамках Программы разработки новых методов и технологий профилактики, диагностики и лечения сердечно-сосудистых заболеваний, связанных с атеросклерозом, в лечебных учреждениях Западного административного округа г. Москвы. Пациентам выполнялось стандартное клиническое обследование, включавшее биохимический анализ крови. В 2019 г. проведен телефонный опрос для выявления ССО за прошедшее время: смерти от сердечно-сосудистых заболеваний (ССС), острого инфаркта миокарда (ОИМ), острых нарушений мозгового кровообращения (ОНМК), случаев реваскуляризации, госпитализации по сердечно-сосудистым причинам.
Результаты. За истекшие десять лет в изучаемой группе произошло девять (1,6%) ССС, десять ОИМ, 11 случаев развития нестабильной стенокардии, 28 реваскуляризаций, 21 ОНМК, 154 госпитализации по сердечно-сосудистым причинам. 116 (20,8%) пациентов перенесли те или иные ССО. У них исходно были достоверно выше уровни триглицеридов (ТГ), аспартатаминотрансферазы (АСТ), мочевой кислоты, мочевины, а также уровень систолического артериального давления (САД). Выявлена слабая, но достоверная корреляция между количеством ССО и уровнем ТГ (r = 0,105; p = 0,01), АСТ (r = 0,106; p = 0,03), мочевой кислоты (r = 0,130; p = 0,005), мочевины (r = 0,128; p = 0,04) в плазме крови, а также уровнем САД (r = 0,104; p = 0,01). По данным многофакторного регрессионного анализа, независимым предиктором развития ССО служили уровни САД, мочевой кислоты, мочевины, а также мужской пол. В логистической модели, включавшей пол, наличие артериальной гипертензии, уровни мочевины, мочевой кислоты, аланинаминотрансферазы/АСТ выше нормальных значений, риск развития ССО возрастал на фоне увеличения уровня мочевины (отношение шансов (ОШ) 8,4 (95%-ный доверительный интервал (ДИ) 1,12–10,1; p = 0,03) и мочевой кислоты (ОШ 3,4; 95% ДИ 2,1–33,3; p = 0,002).
Заключение. Такие биохимические показатели, как уровень мочевой кислоты и мочевины, могут рассматриваться в качестве дополнительных факторов риска развития ССО у больных низкого/умеренного риска, рассчитанного по стандартным шкалам.
Значимость классических факторов риска (ФР), таких как возраст, мужской пол, курение, наследственная предрасположенность, артериальная гипертензия (АГ), дислипидемия, сахарный диабет (СД), для прогнозирования сердечно-сосудистых осложнений (ССО) доказана и сомнений не вызывает. Однако нередко ССО впервые возникают у лиц с низким или умеренным риском их развития, рассчитанным на основании стандартных шкал, в том числе SCORE. Это делает актуальным вопрос о более точной стратификации риска у больных с риском ССО 0–4% (низким/умеренным) по шкале SCORE. В качестве дополнительных ФР рассматриваются уровни биохимических параметров, таких как мочевая кислота, мочевина, трансаминазы, триглицериды. Эти параметры определяются рутинно при биохимическом анализе крови, но в настоящее время не учитываются при прогнозировании ССО.
Цель исследования
Оценка вклада дополнительных биохимических маркеров в стратификацию пациентов с риском ССО по SCORE < 5% по данным длительного наблюдения.
Материал и методы
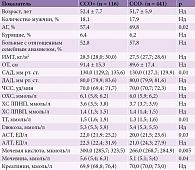
В исследование было включено 557 больных (100 мужчин и 457 женщин) с риском ССО по SCORE < 5%, проходивших обследование в Научно-исследовательском институте клинической кардиологии им. А.Л. Мясникова в 2009 г. в рамках Программы разработки новых методов и технологий профилактики, диагностики и лечения сердечно-сосудистых заболеваний (ССЗ), связанных с атеросклерозом, в лечебных учреждениях Западного административного округа г. Москвы. В программу включались пациенты 12 поликлиник этого округа, обратившиеся к участковому терапевту по любому поводу и подписавшие информированное согласие. Критериями исключения были сердечная, почечная, дыхательная и печеночная недостаточность, коллагенозы, онкологические, психические, острые инфекционные и воспалительные заболевания. Всем больным перед включением в программу проводили стратификацию риска по шкале SCORE. На момент включения в исследование возраст больных составил 51,9 ± 7,6 года. АГ страдали 333 (59,8%) пациента. Курящих насчитывалось 6%. Больным проводили стандартное клиническое обследование, включавшее осмотр, сбор анамнеза, измерение роста и веса с определением индекса массы тела (ИМТ), обхвата талии (ОТ), офисного артериального давления (АД) и частоты сердечных сокращений (ЧСС), биохимический анализ крови с определением липидного профиля, уровней креатинина, мочевины, мочевой кислоты, трансаминаз, глюкозы, билирубина, тредмил-тест с целью исключения ишемической болезни сердца (ИБС).
В 2019 г. нами проведен телефонный опрос для выявления ССО за прошедший период: смерть от любых причин, смерть от ССЗ (ССС), фатальный и нефатальный острый инфаркт миокарда (ОИМ), острые нарушения мозгового кровообращения (ОНМК), случаи реваскуляризации миокарда, госпитализации по сердечно-сосудистым причинам, а также комбинированная конечная точка (ССО = ССС + ОИМ + ОНМК + реваскуляризация + госпитализация по сердечно-сосудистым причинам).
Статистический анализ проведен с помощью пакета программ Statistica 8.0 для Windows. Непрерывные переменные, распределение которых отличалось от нормального, представлялись медианой и 95%-ным доверительным интервалом Mе (-95% ДИ; 95% ДИ). При сравнении значений с распределением признаков, отличным от нормального, использовали критерий Манна – Уитни. Различия считались статистически значимыми при вероятности абсолютно случайного их характера, не превышающей 5% (p < 0,05). Выполнен многофакторный линейный регрессионный и логистический анализ с построением регрессионных моделей.
Результаты
За истекшие десять лет в изучаемой группе зарегистрировано девять (1,6%) ССС, десять ОИМ, 11 случаев развития нестабильной стенокардии, 27 – транслюминальной баллонной ангиопластики коронарных артерий со стентированием, один случай аортокоронарного шунтирования, 21 ОНМК, 154 госпитализации по сердечно-сосудистым причинам. В целом, различные ССО наблюдались у 20,8% (n = 116) пациентов. Умерло от несердечных причин 1,6% пациентов, госпитализировано по несердечным причинам 11,6% больных.
Основные клинико-демографические характеристики больных, перенесших (ССО+) и не перенесших (ССО-) те или иные ССО, представлены в табл. 1.
У больных ССО+ исходно были достоверно выше уровни триглицеридов (ТГ), аспартатаминотрансферазы (АСТ), мочевой кислоты, мочевины, а также уровень систолического артериального давления (САД).
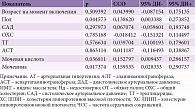
Выявлена слабая, но достоверная корреляция между количеством ССО и уровнями ТГ (r = 0,105; p = 0,01), АСТ (r = 0,106; p = 0,03), мочевой кислоты (r = 0,130; p = 0,005), мочевины (r = 0,128; p = 0,04) в плазме крови, а также уровнем САД (r = 0,104; p = 0,01). Следует отметить достаточно тесную корреляцию между уровнем мочевой кислоты и ИМТ (r = 0,330; p < 0,0001), массой тела (r = 0,401; p < 0,0001), ОТ (r = 0,389; p < 0,0001). По данным многофакторного регрессионного анализа, независимым предиктором развития ССО служили уровни мочевой кислоты, мочевины и мужской пол (табл. 2).
Концентрация мочевой кислоты, превышавшая норму (350 мкмоль/л у женщин и 420 мкмоль/л у мужчин), выявлена всего у 27 (4,8%) пациентов. Среди них ССО зафиксированы у 11,6%, что достоверно выше, чем среди пациентов с нормальным уровнем мочевой кислоты (4,3%; р = 0,01).
Уровень мочевины выше нормы (8,0 ммоль/л) отмечался в 11 (2%) случаях. Несмотря на незначительное число больных, доля ССО+ среди них была статистически значимо выше (12,2 vs 2,4%; p < 0,01). В частности, больных с большими осложнениями, напрямую связанными с атеросклерозом (ОНМК, острым коронарным синдромом, реваскуляризацией), насчитывалось в пять раз больше – 15,0 против 3,4% (р < 0,05).
Нормальные уровни аланинаминотрансферазы (АЛТ) и АСТ (32 ЕД/л) зафиксированы у 110 (19,7%) больных, уровни в два раза выше нормы – у 17 (3,1%). Доля ССО+ статистически не отличалась от таковой среди пациентов с нормальными уровнями АЛТ и АСТ.
В логистической модели, включавшей пол, наличие АГ, уровни мочевины, мочевой кислоты, АЛТ/АСТ выше нормальных значений, риск развития ССО ассоциировался с повышением уровней мочевины (отношение шансов (ОШ) 8,4; 95% ДИ 1,12–10,1; p = 0,03) и мочевой кислоты (ОШ 3,4; 95% ДИ 2,1–33,3; p = 0,002).
Достоверное влияние прочих включенных в модель факторов не установлено.
Обсуждение
В проведенном нами исследовании участвовали больные с низким/умеренным риском ССО. Этим обусловлено относительно небольшое количество конечных точек за десять лет наблюдения. Тем не менее те или иные осложнения за указанный период имели место почти у 1/5 пациентов. Причем фатальные осложнения отмечались у 1,6% пациентов, что соответствовало показателю, прогнозируемому по шкале SCORE, а CCО, напрямую связанные с атеросклерозом (ОНМК, острый коронарный синдром, реваскуляризация), впервые диагностированы у 9,6% пациентов. Малое количество конечных точек не позволило проанализировать предикторы развития каждого события, но удалось провести анализ по комбинированной конечной точке (ССО).
Когорта больных, включенных в исследование, была достаточно однородна по возрасту и показателям липидного профиля. Это объясняет отсутствие влияния этих классических ФР на прогноз. При первичном анализе с развитием ССО ассоциировались наличие АГ на момент включения, уровни АСТ, мочевой кислоты и мочевины в плазме крови (на АГ останавливаться не будем, поскольку она относится к классическим ФР).
Мы нашли ряд публикаций, демонстрирующих роль повышения трансаминаз, АЛТ и АСТ у больных неалкогольной жировой болезнью печени (НАЖБП) как независимого ФР развития атеросклероза. Повышение АЛТ сохраняло прогностическую значимость при введении поправки на пол, возраст, наличие метаболического синдрома и число его компонентов [1, 2]. Имеются данные, подтверждающие влияние НАЖБП на состояние сосудистой стенки. В исследовании с участием 61 молодого мужчины в возрасте 20–40 лет без ФР ССО с НАЖБП, подтвержденной биопсией, и 41 здорового добровольца скорость пульсовой волны, характеризующая артериальную жесткость, и толщина комплекса «интима – медиа» сонных артерий у больных НАЖБП были значимо выше, а потокзависимая дилатация ниже, чем в группе контроля [3]. Таким образом, НАЖБП ассоциируется с увеличением риска эндотелиальной дисфункции и атеросклероза у больных с низким сердечно-сосудистым риском независимо от наличия метаболического синдрома.
Механизм подобного явления до конца не изучен. Существует модель «двух толчков». При ожирении увеличивается поступление в печень свободных жирных кислот (СЖК), что приводит к развитию стеатоза печени (первый толчок). Высокие концентрации СЖК стимулируют липогенез в клетках печени. В результате формируется атерогенная дислипидемия. Снижаются связывание и деградация инсулина на уровне печени. Как следствие – торможение супрессивного действия инсулина на продукцию глюкозы печенью, гиперинсулинемия и инсулинорезистентность. В свою очередь инсулинорезистентность способствует развитию не только НАЖБП, но и атеросклероза: нарушается клеточный энергетический метаболизм, повреждаются периферические ткани, нарушаются поглощение и синтез жирных кислот, что приводит к их накоплению в печени, с одной стороны, и повреждению сосудистого эндотелия, с другой. В результате усиливаются процессы окисления СЖК и образование продуктов перекисного окисления липидов и активных форм кислорода с развитием окислительного стресса (второй толчок).
В развитии стеатогепатита клиническое и прогностическое значение имеет именно окислительный стресс. Непосредственными факторами, вызывающими воспаление, являются нарушение функций внутриклеточных структур (митохондрий), а факторами, вызывающими гибель гепатоцитов и развитие фиброза, – перекисное окисление липидов и секреция цитокинов [4, 5]. Стеатоз печени и окислительный стресс индуцируют синтез провоспалительных цитокинов, таких как интерлейкин 6, фактор некроза опухоли альфа, фетуин А, C-реактивный белок, что приводит к развитию хронического воспаления, которое в свою очередь является важным патогенетическим механизмом как атеросклероза, так и других ассоциированных с возрастом заболеваний. Однако в доступной литературе мы не обнаружили данных о влиянии НАЖБП на развитие ССО. Кроме того, у нас нет информации о наличии у наших пациентов этого заболевания, поскольку его диагностика не входила в задачи программы. Мы располагали данными только об уровнях трансаминаз. Повышение АСТ слабо коррелировало с числом ССО за десять лет, но не было независимым предиктором осложнений и теряло прогностическое значение при включении в модель других рассматриваемых показателей.
Уровень мочевой кислоты как один из предикторов сердечно-сосудистой заболеваемости и смертности изучался практически во всех крупных популяционных исследованиях [6–12]. Ассоциация между повышенным уровнем мочевой кислоты и ССЗ установлена почти 50 лет назад, хотя впервые такое предположение высказывалось на страницах Британского медицинского журнала еще в 1886 г. [13]. Участниками исследования (The Chicago Industry Heart Study), стартовавшего в начале 1960-х гг. и продолжавшегося 12 лет, стали 2400 рабочих [6]. Было показано, что мочевая кислота – независимый предиктор повышения сердечно-сосудистой заболеваемости и смертности, но только у женщин. Подобная тенденция наблюдалась и у мужчин, но включение в анализ других важных ФР сделало эту связь статистически незначимой.
Роль мочевой кислоты как независимого предиктора ССО у больных АГ продемонстрировало двенадцатилетнее исследование PIUMA [12]. Его участниками стали 1720 больных АГ. У пациентов с исходным уровнем мочевой кислоты более 396 мкмоль/л риск ССО, фатальных ССО и общей смертности был достоверно выше, чем у пациентов с исходным уровнем мочевой кислоты от 268 до 309 мкмоль/л. В то же время у больных АГ с исходным уровнем мочевой кислоты менее 268 мкмоль/л число ССО также было выше, чем у лиц с нормальным уровнем.
В исследовании SHEP показана линейная зависимость между числом ССО (за исключением ОНМК) и исходным уровнем мочевой кислоты у больных АГ [11]. Между тем снижение уровня мочевой кислоты на фоне приема лозартана улучшает прогноз больных АГ [15, 16]. В исследовании LIFE (2003 г.) регрессионный анализ показал, что снижение частоты ССО на фоне терапии с включением лозартана на 29% обусловлено именно гипоурекимическим эффектом препарата [16].
В 2007 г. P. Strazzullo и J.G. Puig обобщили результаты проспективных исследований взаимосвязи между уровнем мочевой кислоты и ССО [14]. По мнению ученых, для населения с относительно низким риском мочевая кислота достаточно слабый предиктор ССЗ. Однако ее уровень становится сильным независимым предиктором у субъектов с высоким или очень высоким риском. В нашем исследовании мочевая кислота стала независимым предиктором развития ССО у больных низкого/умеренного риска, на фоне гиперурикемии риск увеличивался почти в 3,5 раза. Является ли гиперурикемия маркером или причиной повышения сердечно-сосудистого риска, до сих пор не ясно. В качестве потенциальных патогенетических механизмов рассматриваются увеличение адгезии и агрегации тромбоцитов, окислительный стресс, нарушение эндотелиальной функции из-за ингибирования оксида азота под влиянием его избыточного содержания в крови [13].
Наиболее сильным предиктором развития ССО в нашем исследовании стала мочевина. Исходное повышение ее уровня более 8,0 ммоль/л увеличивало десятилетний риск ССО более чем в восемь раз. При этом надо учитывать, что пациенты с почечной недостаточностью не включались в исследование и максимальный уровень креатинина у участников программы достигал 129 мкмоль/л. Повышение уровня мочевины у лиц без хронической болезни почек обусловлено рядом причин: диетой с избыточным содержанием белка, гиповолемией, метаболическими нарушениями [17]. Описано ассоциированное с возрастом повышение уровня мочевины, которое, по мнению исследователей, связано, в частности, с активацией ренин-ангиотензин-альдостероновой системы (РААС) и симпатоадреналовой системы у пожилых людей [18].
В отдельных работах продемонстрирована роль мочевины как маркера метаболического статуса. Например, у больных НАЖБП повышен уровень мочевины, что вызвано развитием инсулинорезистентности и активацией РААС. Установлена корреляция между уровнями АСТ, АЛТ, ТГ, общего холестерина и мочевиной у больных НАЖБП без АГ и СД 2-го типа [19].
В настоящее время уровень мочевины рассматривается как дополнительный ФР ССО, однако подавляющее число работ, посвященных этому вопросу, проведено с участием пациентов с хронической почечной недостаточностью.
Согласно данным метаанализа, увеличение уровня мочевины на каждый 1 мг/дл ассоциируется с увеличением риска реваскуляризации (но не ОИМ) у больных ИБС [20].
Имеются данные о роли мочевины как неблагоприятного прогностического фактора при ОИМ [21] у пациентов с нормальной или немного сниженной скоростью клубочковой фильтрации.
Кроме того, показано, что риск развития СД 2-го типа возрастает при увеличении уровня мочевины на каждые 10 мг/дл (ОШ 1,15) независимо от скорости клубочковой фильтрации [22].
Таким образом, риск ССО повышается уже на ранних этапах почечной дисфункции, что скорее всего обусловлено изменениями в артериальной стенке.
В отечественном исследовании установлена независимая прямая связь между толщиной комплекса «интима – медиа» и уровнем мочевины у мужчин старше 45 лет и женщин старше 55 лет без хронической болезни почек и клинических проявлений атеросклероза. Уровень мочевины > 5,3 ммоль/л увеличивает вероятность утолщения комплекса «интима – медиа» в 2,16 раза [23].
В качестве механизмов, опосредующих воздействие мочевины на сосудистую стенку, рассматривают окислительный стресс, способствующий развитию эндотелиальной дисфункции, и повышение количества циркулирующих эндотелиальных частиц, фрагментов эндотелиальных клеток, что приводит к снижению синтеза оксида азота [24].
Кроме того, мочевина, даже при относительно невысоком уровне в сыворотке, рассматривается как причина прямого повреждающего воздействия на эндотелий [25].
Заключение
Биохимические показатели, такие как уровень мочевой кислоты и мочевины, могут рассматриваться в качестве дополнительных факторов риска развития ССО у больных низкого/умеренного риска, рассчитанного по стандартным шкалам. Вклад указанных факторов и возможность их использования для стратификации риска в реальной клинической практике требуют дальнейшего изучения в ходе масштабных эпидемиологических исследований.
M.D. Smirnova, PhD, T.V. Fofanova, PhD, O.N. Svirida, PhD, O.N. Blankova, PhD, I.V. Barinova, F.T. Ageyev, PhD, Prof.
National Medical Research Center of Cardiology, Moscow
Contact person: Mariya D. Smirnova, naliya1@yandex.ru
In order to improve the results of predicting cardiovascular complications (CVC), it is necessary to examine not only classical, but also additional risk factors, including those determined by routine biochemical blood analysis.
Purpose: to assess the contribution of the additional biochemical markers to the stratification of patients at risk of CVC according to SCORE < 5% according on ten-year follow-up data.
Material and methods. 557 patients (100 men) with a SCORE < 5% risk of CVC were examined in 2009 as part of the Program of Development of New Methods and Technologies for the Prevention, Diagnosis and Treatment of Cardiovascular Diseases Associated with Atherosclerosis in medical institutions of the Western Administrative District of Moscow. The patients underwent standard clinical examination, which included a biochemical blood test. In 2019 the telephone survey was conducted to identify CVC over the past time of death from cardiovascular diseases (CVD), acute myocardial infarction (AMI), acute cerebral circulatory disorders (ACCD), cases of revascularization, and hospitalization for cardiovascular reasons.
Results. Over the past ten years, the study group had nine (1.6%), CVD, ten AMI, 11 cases of unstable angina, 28 revascularizations, 21 ACCD, and 154 hospitalizations for cardiovascular reasons. 116 (20.8%) patients had some type of CVC (CVC+). Patients with CVC+ initially had significantly higher levels of triglycerides (TG), aspartate aminotrasferase (AST), uric acid, and urea, as well as systolic blood pressure (SBP). A weak but reliable correlation was found between the number of CVC and the level of TG (r = 0.105; p = 0.01), AST (r = 0.106; p = 0.03), uric acid (r = 0.130; p = 0.005), urea (r = 0.128; p = 0.04) in the blood plasma, as well as the level of SBP (r = 0.104; p = 0.01). According to multivariate regression analysis, the levels of SBP, uric acid, and urea, as well as male gender, were an independent predictor of CVC development. In a logistic model that included gender, hypertension, urea, uric acid, and alanine aminotransferase/AST levels above normal values, the risk of CVC development increases with increasing urea levels (odds ratio (OR) 8.4 (95% confidence interval (CI) 1.12–10.1; p = 0.03) and uric acid (OR 3.4; 95% CI 2.1–33.3; p = 0.002).
Conclusion. Biochemical parameters such as uric acid and urea levels can be considered as additional risk factors for developing CVD in patients with low/moderate risk, calculated on standard scales.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.