Опыт применения биологической терапии у пациентов с полипозным риносинуситом на этапе предоперационной подготовки
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить клиническую эффективность препарата дупилумаб в качестве предоперационной подготовки у пациентов с ХПРС при воспалении Т2-эндотипа.
Материал и методы. Обследовано 14 пациентов с ХПРС в возрасте от 18 лет с двусторонним полипозным процессом полости носа и/или околоносовых пазух и показаниями к проведению планового оперативного лечения по поводу полипозного риносинусита. Пациентам проведена предоперационная подготовка за 1,5–2 месяца перед планируемым оперативным лечением – подкожное введение двух инъекций дупилумаба 300 мг один раз в две недели и мометазона фуроата 400 мкг интраназально в сутки. Динамику состояния пациентов оценивали с помощью анкетирования по опроснику SNOT-22, компьютерной томографии околоносовых пазух, эндоскопии полости носа.
Результаты. Проведенная терапия позволила 35,7% пациентов избежать эндоскопической полисинусотомии. У 50% больных ХПРС значительно сократился объем хирургического вмешательства.
Заключение. Биологическая терапия в качестве предоперационной подготовки у пациентов с ХПРС высокоэффективна. Предложенная стратегия требует дальнейшего изучения.
Цель – оценить клиническую эффективность препарата дупилумаб в качестве предоперационной подготовки у пациентов с ХПРС при воспалении Т2-эндотипа.
Материал и методы. Обследовано 14 пациентов с ХПРС в возрасте от 18 лет с двусторонним полипозным процессом полости носа и/или околоносовых пазух и показаниями к проведению планового оперативного лечения по поводу полипозного риносинусита. Пациентам проведена предоперационная подготовка за 1,5–2 месяца перед планируемым оперативным лечением – подкожное введение двух инъекций дупилумаба 300 мг один раз в две недели и мометазона фуроата 400 мкг интраназально в сутки. Динамику состояния пациентов оценивали с помощью анкетирования по опроснику SNOT-22, компьютерной томографии околоносовых пазух, эндоскопии полости носа.
Результаты. Проведенная терапия позволила 35,7% пациентов избежать эндоскопической полисинусотомии. У 50% больных ХПРС значительно сократился объем хирургического вмешательства.
Заключение. Биологическая терапия в качестве предоперационной подготовки у пациентов с ХПРС высокоэффективна. Предложенная стратегия требует дальнейшего изучения.

Введение
В настоящее время проблема лечения хронического полипозного риносинусита (ХПРС) остается актуальной в оториноларингологии. Контроль ХПРС существенно затрудняют сложные патогенетические механизмы, а также сочетание с бронхиальной астмой (БА), аллергическим ринитом. Коморбидные состояния значительно утяжеляют характер течения полипозного процесса, сокращают продолжительность ремиссии как после консервативной терапии, так и в короткие сроки после хирургического лечения. Согласно данным зарубежных коллег, у 35–45% пациентов с ХПРС в течение шести месяцев после хирургического лечения возникает рецидив полипоза [1, 2]. Особые трудности при выборе тактики лечения возникают у больных, страдающих полипозным риносинуситом и получающих антитромботическую терапию по поводу сопутствующей соматической патологии. Выполнение оперативного лечения у данной категории пациентов сопряжено с высоким риском кровопотери и необходимостью применения гемоглобин- или водопоглощаемого лазерного излучения для достижения надежного гемостаза [3].
Немаловажно также, что каждое обострение полипозного процесса нередко приводит к ухудшению течения бронхолегочной патологии и требует привлечения пульмонологов и аллергологов в связи с дестабилизацией сопутствующих коморбидных состояний [4, 5].
Установлено, что определенную роль в процессе рецидивирования полипоза играет присутствие эозинофилов в тканях или секрете дыхательных путей у пациентов, перенесших функциональную эндоскопическую хирургию синуса (functional endoscopic sinus surgery, FESS) [6]. Частота рецидивов ХПРС в данном случае увеличивается до 48% в течение трех лет [7].
Сегодня в европейских рекомендациях, международных согласительных документах по лечению хронического риносинусита и ряде клинических исследований особое внимание уделяется изучению влияния механизма Т2-воспаления на течение полипозного процесса в полости носа и околоносовых пазухах, в том числе на фоне коморбидной БА, аллергического ринита, а также рассматривается современный дифференцированный подход к выбору тактики лечения указанных патологических состояний. Т2-воспаление выявляется примерно у 50–70% пациентов с тяжелой БА и 80–87% пациентов с ХПРС [8–12].
Отличительной особенностью Т2-воспаления является наличие эозинофильного воспаления дыхательных путей, связанного с активацией врожденной и адаптивной иммунной системы и секрецией основных Т2-цитокинов: интерлейкинов (ИЛ) 4, 5, 13, а также повышение уровня циркулирующего и/или локального иммуноглобулина (Ig) E. Секреция цитокинов осуществляется Th2-лимфоцитами, врожденными лимфоидными клетками 2-го типа, тучными клетками, базофилами и эозинофилами [13–15].
Т2-цитокины создают благоприятные условия для повреждения эпителиального барьера, ремоделирования слизистой оболочки полости носа и околоносовых пазух с последующим ростом и рецидивированием полипозного процесса [14, 16–20]. В результате формируется хронический воспалительный процесс, сопровождаемый развитием стойких и трудно контролируемых симптомов ХПРС, БА.
Для ХПРС, связанного с Т2-воспалением, характерны наиболее высокая частота рецидивов полипозного процесса, потребность в системных глюкокортикостероидах (ГКС), необходимость проведения повторных хирургических вмешательств в короткие сроки и, как следствие, существенное снижение качества жизни пациентов [2, 21].
Разработка и внедрение в клиническую практику моноклональных антител положили начало развитию нового этапа в лечении полипозного риносинусита, ассоциированного с Т2-воспалением.
Первым моноклональным антителом, одобренным в июле 2019 г. Управлением по контролю за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) для лечения ХПРС, стал препарат дупилумаб [22].
Дупилумаб – моноклональное человеческое антитело (IgG4), двойной ингибитор передачи сигнала ИЛ-4 и ИЛ-13, блокирующий передачу сигналов ИЛ-4 и ИЛ-13 за счет специфического связывания с IL-4Rα-субъединицей, общей для рецепторных комплексов ИЛ-4 и ИЛ-13. Этот препарат блокирует передачу сигналов ИЛ-4 через рецепторы 1-го типа (IL-4Rα/γc) и общую передачу сигналов ИЛ-4 и ИЛ-13 через рецепторы 2-го типа (IL-4Rα/IL-13Rα) [23].
Проведенные за последние пять лет международные рандомизированные плацебо-контролируемые клинические исследования SINUS-24, SINUS-52 III фазы показали высокую эффективность и безопасность дупилумаба при ХПРС. По результатам указанных исследований суммарно установлено снижение доли пациентов, которым требовалось неотложное курсовое лечение системными ГКС, на 74%. На 83% сократилась потребность в оперативном лечении на фоне применения дупилумаба по сравнению с плацебо [24, 25].
На основании полученных результатов биологическая терапия вошла в последние рекомендации EUFOREA-2019 и EPOS-2020. Однако обязательными условиями назначения моноклональных антител являются наличие тяжелого течения ХПРС и соблюдение определенных критериев, установленных отдельно для пациентов, ранее оперированных по поводу полипозного процесса в полости носа и околоносовых пазухах, и для коморбидных по сопутствующей Т2-патологии больных без отягощенного хирургического лечения [24, 25].
Последняя редакция отечественных клинических рекомендаций по ведению пациентов с ХПРС (2021) также содержит информацию о возможности применения биологической терапии при тяжелом полипозном процессе и по основным критериям совпадает с зарубежными протоколами.
Таким образом, применение биологической терапии при рецидивах тяжелого ХПРС, в том числе ассоциированного с другими Т2-индуцированными заболеваниями, является достойной альтернативой существующим методам контроля за течением ХПРС [26]. Тем не менее, по нашему мнению, требуется дальнейшее изучение возможности применения моноклональных антител у разных категорий больных полипозным риносинуситом, ассоциированным с Т2-воспалением.
Цель – изучить клиническую эффективность препарата дупилумаб в качестве предоперационной подготовки у пациентов с ХПРС при воспалении Т2-эндотипа.
Материал и методы
На базе Санкт-Петербургского научно-исследовательского института уха, горла, носа и речи в период с октября по декабрь 2021 г. выполнено обследование 14 пациентов с ХПРС в возрасте 40–57 лет. Соотношение мужчин и женщин составило 2,5:1.
Критерии включения в исследование: возраст старше 18 лет, наличие двустороннего полипозного процесса в полости носа и/или околоносовых пазухах и показаний к проведению планового оперативного лечения по поводу полипозного риносинусита. В исследование не включались беременные, пациенты с обострением гнойного процесса, установленными психическими расстройствами, наркотической зависимостью, муковисцидозом и заболеваниями, являющимися противопоказанием к назначению биологической терапии дупилумабом. Программа обследования до начала лечения включала сбор жалоб и уточнение данных анамнеза, общий оториноларингологический осмотр, консультацию аллерголога. Особое внимание уделялось наличию коморбидной патологии и ранее проводимому хирургическому лечению и/или курсам системных ГКС за последние два года. Тяжесть и контроль БА оценивали на основании рекомендаций GINA 2014, 2019 [27]. Контроль за течением полипозного риносинусита и тяжесть данного заболевания устанавливали исходя из рекомендаций EUFOREA [28].
Объективные методы исследования включали компьютерную томографию (КТ) околоносовых пазух, степень распространения полипозного процесса анализировалась по шкале Лунда – Маккея (Lund – Mackay) [29].
При эндоскопическом исследовании для оценки распространения полипов в полости носа использовали шкалу назальных симптомов (Nasal Polyp Score, NPS) [30]. После постановки диагноза и получения информированного согласия все обследуемые проходили предоперационную подготовку за 1,5–2 месяца перед планируемым оперативным лечением, которая предусматривала:
- проведение биологической терапии дупилумабом в виде подкожного введения 300 мг один раз в две недели в количестве двух инъекций;
- интраназально мометазона фуроат 400 мкг в сутки.
Динамику субъективного состояния пациентов оценивали с помощью анкетирования по опроснику SNOT-22, который позволяет определить качество жизни и результаты лечения пациентов с заболеванием носа и околоносовых пазух. Анализ полученных данных заключался в расчете общей суммы баллов (максимальное значение – 110) с последующим определением пяти основных симптомов и анализом их степени выраженности. Для объективного контроля за течением полипозного процесса всем обследуемым выполняли эндоскопическое исследование полости носа перед началом предоперационной подготовки, затем после первой инъекции дупилумаба и спустя 14 дней после второго введения препарата. Кроме того, пациентам непосредственно перед запланированным оперативным лечением повторно выполняли КТ околоносовых пазух. Аналитический и статистический компоненты работы, построение таблиц и графиков осуществляли с помощью персонального компьютера и лицензионного программного обеспечения Statistica v. 10, Microsoft Word 2010 и Microsoft Excel 2010. При оценке средних величин использовали медиану и интерквартильную широту. Сравнение связанных выборок осуществлялось с применением непараметрического критерия Вилкоксона. При проверке статистических гипотез критическим значением ошибки первого порядка устанавливалось значение альфа 0,05.
Результаты
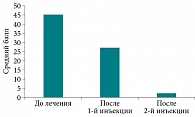
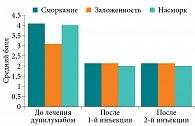
Согласно данным анамнеза, средняя продолжительность ХПРС от момента появления первых симптомов до настоящего обращения составила десять (4–12) лет. Тяжелый и неконтролируемый полипозный процесс, в соответствии с рекомендациями EUFOREA-2021, выявлен у девяти (64,2%) пациентов. Соотношение больных с впервые выявленным полипозным риносинуситом и пациентов с рецидивом ХПРС, несмотря на ранее проводимое хирургическое лечение, составило 1:1. Коморбидная патология в виде БА зарегистрирована у пяти (35,7%) больных. При этом у обследуемых зарегистрирована преимущественно БА среднетяжелого течения – четыре (80%) пациента с полным или частичным контролем. Неконтролируемое течение данного заболевания зарегистрировано у одного пациента. Сопутствующий аллергический ринит выявлен у 50% больных из общей выборки. На основании анкетирования по опроснику SNOT-22 установлен средний балл общей суммы до лечения – 45 с минимальным значением 32,5 и максимальным 56, что указывает на значительное снижение качества жизни у больных на фоне ХПРС (рис. 1). Среди основных симптомов, оказывающих наиболее негативное влияние на качество жизни обследуемых с ХПРС, зарегистрированы сморкание – средний балл 4 (3–4), заложенность – 3 (3–4), насморк – 4 (2,5–4) (рис. 2).
При передней риноскопии в шести случаях выявлена деформация перегородки носа, в пяти – гипертрофия нижних носовых раковин. При объективной оценке распространения полипозного процесса, по данным эндоскопического исследования полости носа и носоглотки, средний балл по NPS до лечения составил 6 (2–8), что говорит о значительном распространении полипов в полости носа. Анализ результатов КТ околоносовых пазух по шкале Лунда – Маккея также продемонстрировал высокую степень распространения полипозного процесса со средним значением 18 (10–22) баллов.
На фоне проведенной предоперационной подготовки установлено статистически значимое снижение интенсивности субъективных симптомов ХПРС уже после первой инъекции дупилумаба. Средний балл общей суммы по опроснику SNOT-22 составил 26,5 (19–47) (p = 0,03) (рис. 1). Пропорционально снижению суммарных показателей зарегистрировано выраженное купирование интенсивности основных симптомов (сморкание, заложенность, насморк) ХПРС (p = 0,07). Максимальное улучшение качества жизни пациентов по общему баллу опросника SNOT-22 зафиксировано после завершения предоперационной подготовки (p = 0,007) (рис. 1). При этом выраженная положительная динамика отмечалась в отношении снижения интенсивности всех основных симптомов (p = 0,04) (рис. 2). Выявлено уменьшение среднего балла заложенности носа по опроснику на 44% (3 балла до лечения против 2 баллов после курса предоперационной подготовки; p = 0,04), а также статистически достоверное сокращение на 50% насморка и потребности в сморкании (p = 0,07) после предоперационной подготовки.
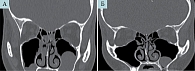
Данные субъективной оценки были сопоставимы с результатами объективного обследования. По результатам эндоскопии полости носа средний балл по NPS после курса лечения уменьшился на 41,7%: до лечения – 6 (2–8), после – 2,5 (0–4) (p = 0,005). Степень распространения полипозного процесса, по результатам КТ околоносовых пазух, после двух инъекций дупилумаба снизилась на 44,4%: до лечения – 18 (10–22), после – 8 (4–22) (p = 0,005) по шкале Лунда – Маккея (рис. 3).
Отсутствие положительной динамики по результатам субъективной и объективной оценок зарегистрировано только у одного (7,1%) больного, что потребовало последующего проведения хирургического лечения без коррекции ранее запланированного до терапии дупилумабом объема оперативного лечения. Четырем (28,6%) пациентам по результатам проведенной предоперационной подготовки выполнено хирургическое лечение в виде FESS. Однако указанным больным потребовалась коррекция объема ранее запланированного хирургического лечения в сторону сокращения последнего в связи с уменьшением распространения полипозного процесса в околоносовых пазухах. В ходе оперативного лечения у данных пациентов отмечались повышенная кровоточивость и затруднение визуализации операционного поля, что несколько увеличивало продолжительность проведения эндоскопического вмешательства.
Только коррекция внутриносовых структур в объеме септопластики и вазотомии проведена одному пациенту ввиду удовлетворительной пневматизации околоносовых пазух после предоперационной подготовки. Показания к проведению оперативного лечения отсутствовали у пяти (35,7%) больных. Им было рекомендовано продолжить использование интраназальных ГКС в качестве поддерживающей терапии до шести месяцев. Остальные три пациента в связи с выраженной положительной динамикой в купировании основных симптомов ХПРС отказались от хирургического лечения и продолжили применение мометазона фуроата (рис. 4).
Таким образом, предложенный курс предоперационной подготовки с использованием дупилумаба показал значительную эффективность в купировании основных симптомов ХПРС и позволил избежать хирургического лечения в каждом третьем случае в отсутствие аномалий развития внутриносовых структур. У каждого второго больного сократился объем распространения полипозного процесса.
Обсуждение
На современном этапе системная и топическая ГКС-терапия составляет основу существующих методов предоперационной подготовки пациентов с ХПРС [31]. При наличии коморбидной патологии в виде БА ряд авторов подчеркивают положительное влияние на состояние операционного поля и наилучшую визуализацию при эндоскопических вмешательствах у пациентов с полипозным риносинуситом при внутривенном введении низких доз дексаметазона непосредственно перед хирургическим вмешательством [32–34].
Существуют различные схемы назначения данных препаратов. Камнем преткновения при использовании даже коротких курсов системных ГКС является развитие потенциальных побочных эффектов, существенно сужающих спектр применения ГКС в рутинной практике. Появление в клинической практике новой группы препаратов – моноклональных антител и их успешное использование в клинических исследованиях, а также высокий профиль безопасности коренным образом изменили стратегию ведения пациентов с тяжелым ХПРС. Дупилумаб стал первым зарегистрированным лекарственным средством для лечения полипозного риносинусита в России. Однако сегодня показания к назначению данного препарата ограниченны. Результаты слепых рандомизированных двойных плацебо-контролируемых исследований SINUS-24 и SINUS-52, а также ряда других работ демонстрируют высокую эффективность препарата в сочетании с топическими ГКС в снижении потребности в повторных хирургических вмешательствах у пациентов с тяжелым и/или неконтролируемым ХПРС. При этом подкожные инъекции дупилумаба назначаются на срок не менее шести месяцев.
Наш опыт успешного применения короткого курса (две инъекции) моноклонального препарата дупилумаб в сочетании с мометазона фуроатом в качестве предоперационной подготовки, возможно, открывает новые возможности для назначения биологической терапии пациентам с полипозным риносинуситом. По нашему мнению, предложенная в данном наблюдении стратегия ведения пациентов с ХПРС в перспективе может стать новым комплексным подходом к реализации помощи пациентам с полипозным процессом различной степени тяжести и сопутствующей коморбидной патологией. Однако требуется дальнейшее изучение эффективности и безопасности предлагаемого курса предоперационной подготовки. Открытым также остается вопрос, связанный с ухудшением качества визуализации операционного поля из-за повышенной кровоточивости у пациентов, которым после предоперационной подготовки с использованием дупилумаба и топических ГКС выполняется эндоскопическая полисинусотомия.
Заключение
Применение короткого курса дупилумаба в качестве предоперационной подготовки у пациентов с ХПРС позволяет в 35,7% случаев избежать оперативного лечения. У 50% преимущественно с выраженным распространением полипозного процесса на фоне проведенной биологической терапии значительно сокращается объем хирургического вмешательства.
Вопросы применения биологической терапии в качестве предоперационной подготовки у пациентов с полипозным процессом различной степени тяжести и формирования более обширной выборки пациентов требуют более детального изучения. Тем не менее на данном этапе результаты применения короткого курса дупилумаба у пациентов с впервые выявленным полипозным процессом, соответствующим Т2-эндотипу воспаления, выглядят весьма обнадеживающими в контроле над полипозным процессом.
Авторы заявляют об отсутствии конфликта интересов.
Исследование не имело спонсорской поддержки.
M.A. Budkovaya, PhD, S.A. Rebrova, PhD
Saint-Petersburg Research Institute of Ear, Throat, Nose and Speech
Contact person: Marina A. Budkovaya, marina-laptijova@yandex.ru
Rationale. The use of biological therapy for the treatment of chronic polypous rhinosinusitis (CPRS) is a promising method for controlling the course of the polyposis process. However, at present, the use of this therapy is carried out according to limited indications, which creates the need for a more detailed study of the possibilities of using monoclonal antibodies in various categories of patients with polypous rhinosinusitis.
Рurpose – study of the clinical efficacy of the drug dupilumab as a preoperative preparation in patients with CPRS in the presence of T2-endotype inflammation.
Material and methods. We examined 14 patients with CPRS, aged 18 years and older, with a bilateral polypous process in the nasal cavity and/or paranasal sinuses and indications for planned surgical treatment for polypous rhinosinusitis. Patients underwent preoperative preparation 1.5–2 months before the planned surgical treatment: in the form of subcutaneous administration of the drug dupilumab 300 mg once every 2 weeks in the amount of 2 injections and mometasone furoate 400 mcg intranasally per day. The dynamics of the patients' condition was assessed using the SNOT-22 questionnaire, CT scan of the paranasal sinuses, endoscopy of the nasal cavity.
Results. The therapy allowed 35.7% of patients to avoid endoscopic polysinusotomy. In 50% of patients with CPRS, the volume of surgical intervention was significantly reduced.
Conclusion. The use of biological therapy as a preoperative preparation in patients with CPRS has shown high efficiency, and in the future the proposed strategy requires further study.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.