Опыт применения препарата Галавит в комплексном лечении хронического бактериального простатита
- Аннотация
- Статья
- Ссылки
- English
Цель – изучение эффективности применения препарата Галавит в комплексной терапии больных ХБП в сравнении со стандартным использованием нестероидных противовоспалительных средств (НПВС) для оптимизации лечения.
Материал и методы. Проведен ретроспективный анализ результатов обследования и лечения 130 пациентов с ХБП в возрасте 25–50 лет. Диагностический алгоритм включал: трехстаканную пробу мочи, определение уровня простатического специфического антигена, пальцевое ректальное исследование, исследование секрета простаты, урофлоуметрию, опросники IPSS, NIH-CPSI, МИЭФ-5. Все пациенты получали стандартную терапию в течение четырех недель: антибиотики, альфа-адреноблокаторы, простатопротекторы; пациентам основной группы (n = 89) назначали препарат Галавит, контрольной группы (n = 41) – нимесулид. Результаты оценивали на 30, 60, 90-й дни; дальнейшее наблюдение (до 12 месяцев) – для оценки рецидивов.
Результаты. Через три месяца в основной группе отмечалось более значимое снижение симптомов СХТБ/СНМП в сравнении с контрольной группой: суммарный индекс по IPSS снизился до 5 ± 1 баллов в сравнении с 11 ± 1 баллами (p < 0,01), снижение общего балла NIH-CРSI достигло 8 ± 2 в сравнении с 11 ± 2 (p < 0,01) баллами соответственно. Показатель интенсивности боли по шкале NIH-CРSI в основной группе был вдвое меньшим, чем в контрольной (средний балл 2 ± 1 в сравнении с 4 ± 1 баллами; p < 0,01). В основной группе достигнуто увеличение среднего значения Qmax с 9,8 до 23 мл/с к 30-му дню и сохранялось до конца периода наблюдения (до 16 мл/с в контрольной группе); средний объем остаточной мочи достоверно снизился до 8 см3 в основной группе против 28 см3 в контрольной группе. Положительная уродинамика отмечалась достоверно чаще в основной, чем в контрольной группе (р < 0,01). За период наблюдения до 12 месяцев отсутствие рецидивов отмечалось в основной группе у 84% пациентов и в контрольной – у 68%.
Заключение. Включение Галавита в комплексную терапию ХБП обеспечивает более выраженное уменьшение основных симптомов заболевания по сравнению со стандартной терапией с НПВС, что способствует оптимизации лечения и может быть рекомендовано пациентам с ХБП.
Цель – изучение эффективности применения препарата Галавит в комплексной терапии больных ХБП в сравнении со стандартным использованием нестероидных противовоспалительных средств (НПВС) для оптимизации лечения.
Материал и методы. Проведен ретроспективный анализ результатов обследования и лечения 130 пациентов с ХБП в возрасте 25–50 лет. Диагностический алгоритм включал: трехстаканную пробу мочи, определение уровня простатического специфического антигена, пальцевое ректальное исследование, исследование секрета простаты, урофлоуметрию, опросники IPSS, NIH-CPSI, МИЭФ-5. Все пациенты получали стандартную терапию в течение четырех недель: антибиотики, альфа-адреноблокаторы, простатопротекторы; пациентам основной группы (n = 89) назначали препарат Галавит, контрольной группы (n = 41) – нимесулид. Результаты оценивали на 30, 60, 90-й дни; дальнейшее наблюдение (до 12 месяцев) – для оценки рецидивов.
Результаты. Через три месяца в основной группе отмечалось более значимое снижение симптомов СХТБ/СНМП в сравнении с контрольной группой: суммарный индекс по IPSS снизился до 5 ± 1 баллов в сравнении с 11 ± 1 баллами (p < 0,01), снижение общего балла NIH-CРSI достигло 8 ± 2 в сравнении с 11 ± 2 (p < 0,01) баллами соответственно. Показатель интенсивности боли по шкале NIH-CРSI в основной группе был вдвое меньшим, чем в контрольной (средний балл 2 ± 1 в сравнении с 4 ± 1 баллами; p < 0,01). В основной группе достигнуто увеличение среднего значения Qmax с 9,8 до 23 мл/с к 30-му дню и сохранялось до конца периода наблюдения (до 16 мл/с в контрольной группе); средний объем остаточной мочи достоверно снизился до 8 см3 в основной группе против 28 см3 в контрольной группе. Положительная уродинамика отмечалась достоверно чаще в основной, чем в контрольной группе (р < 0,01). За период наблюдения до 12 месяцев отсутствие рецидивов отмечалось в основной группе у 84% пациентов и в контрольной – у 68%.
Заключение. Включение Галавита в комплексную терапию ХБП обеспечивает более выраженное уменьшение основных симптомов заболевания по сравнению со стандартной терапией с НПВС, что способствует оптимизации лечения и может быть рекомендовано пациентам с ХБП.



Введение
Хронический бактериальный простатит (ХБП) – наиболее распространенное в урологической практике заболевание, клинически диагностируемое на основании признаков воспаления и наличия инфекции в секрете предстательной железы. Сопровождается такими клиническими синдромами, как синдром хронической тазовой боли (СХТБ), синдром нижних мочевыводящих путей (СНМП) и копулятивной дисфункцией. Продолжительность заболевания зачастую более трех месяцев.
На сегодняшний день простатит считается одной из самых распространенных патологий среди мужчин моложе 50 лет [1–4]. В отечественной урологии в амбулаторном звене на долю хронического простатита приходится примерно 20% консультаций. Это заболевание остается самой частой формой персистирующей инфекции нижних мужских мочеполовых путей [4, 5]. Пусковым механизмом болезни считается бактериальная инфекция, в большинстве своем представленная условно-патогенными микроорганизмами: штаммы Enterobacteriaceae (Escherichia coli, Klebsiella spp., Enterobacter aerogenes), различные виды рода Serretia, иногда неферментирующие грамотрицательные палочки (Pseudomonas aeruginosa, P. putida) [6–8].
Несмотря на большой клинический опыт практикующих урологов, результаты фармакотерапии ХБП часто не удовлетворяют как докторов, так и пациентов. Это связано с проблемой антибиотикорезистентности микроорганизмов, вызывающих ХБП, ослабленным иммунным статусом пациентов вследствие хронического течения инфекции, что ведет к слабой динамике индикаторов излечения ХБП и частому рецидивированию заболевания. Поэтому лечение ХБП остается одной из актуальных и трудоемких проблем современной амбулаторной урологии [9].
Цель – изучение эффективности применения препарата Галавит в комплексной терапии больных ХБП в сравнении со стандартным использованием нестероидных противовоспалительных средств (НПВС) для оптимизации лечения.
Материал и методы
В 2012–2021 гг. количество мужчин с урологическими заболеваниями, получающих консультацию в Краевом клиническом специализированном уроандрологическом центре (ККСУЦ), в среднем составило 11,3 тыс. человек в год. Из них с диагнозом «хронический простатит» (код МКБ N41.1) – в среднем 1,2 тыс. человек в год (более 10%).
В основе исследования лежит ретроспективный анализ результатов обследования и лечения 130 пациентов с ХБП в возрасте 25–50 лет за период 2019–2021 гг. Показанием к фармакотерапии являлось наличие синдромокомплекса, включающего СХТБ, СНМП, синдром копулятивной дисфункции, а также данных лабораторно-инструментальных исследований, подтверждающих наличие ХБП. Обследование проводили согласно установленному в центре диагностическому алгоритму, который включал: трехстаканную пробу мочи, определение уровня простатического специфического антигена (исследование осуществляли на аппарате Chim Well 2910, США), урофлоуметрию (Delphis IP by Laborie), трансректальное ультразвуковое исследование (исследование выполняли на аппарате системы LOGIQ P5 в реальном масштабе времени мультичастотным датчиком), пальцевое ректальное исследование, исследование секрета простаты (посев на микрофлору, чувствительность к антибиотикам), результаты опросников «Международный индекс симптомов при заболеваниях простаты» (IPSS), «Шкала симптомов хронического простатита и синдрома тазовых болей у мужчин» (NIH-CPSI), «Международный индекс эректильной функции» (МИЭФ-5).
После установки диагноза ХБП в дневном стационаре ККСУЦ комплексную терапию получили 130 пациентов, не имеющих другой сопутствующей патологии простаты и урогенитальной системы. Все пациенты получали стандартную схему лечения в течение четырех недель: антибактериальные препараты (левофлоксацин 500 мг), альфа-адреноблокаторы (алфузозин 10 мг), простатопротектор (Витапрост форте (свечи)), противовоспалительные средства: 41 пациенту (контрольная группа) в составе комплексной терапии назначали нимесулид 100 мг (одна таблетка два раза в день в течение пяти дней); 89 пациентам (основная группа) назначали препарат Галавит 100 мг (один суппозиторий два раза в день ректально в течение двух дней, затем один суппозиторий в день, через день, № 8).
Галавит (ООО «Сэлвим», Россия) – иммуномодулятор с противовоспалительным действием. Механизм действия препарата связан с его способностью регулировать функционально-метаболическую активность клеток врожденного и адаптивного иммунитета (в том числе моноцитов, макрофагов, нейтрофилов, натуральных киллеров). Галавит нормализует фагоцитарную активность моноцитов/макрофагов, бактерицидную активность нейтрофилов и цитотоксическую активность NK-клеток. Обладая способностью восстанавливать пониженную активность клеток врожденного и адаптивного иммунитета, препарат повышает резистентность организма к инфекционным заболеваниям. Кроме того, Галавит нормализует антителообразование, повышает функциональную активность (аффинитет) антител [10]. Также важным преимуществом препарата Галавит является то, что препарат в виде суппозиториев не метаболизируется печенью и не имеет такого тяжелого побочного эффекта, как гепатотоксичность. Тяжелая гепатотоксичность – один из самых неблагоприятных побочных эффектов нимесулида [11]. Имеется сообщение о случае, в котором традиционные методы лечения фульминантной печеночной недостаточности, возникшей на фоне лечения нимесулидом, оказались неэффективными и единственным способом спасения пациента явилась трансплантация печени [12].
Динамику жалоб пациентов, данных опросников IPSS, NIH-CРSI (позволяет оценить боль: локализацию, интенсивность, частоту и продолжительность), МИЭФ-5 и показателей лабораторно-инструментальных исследований оценивали в течение трех месяцев. Контроль осуществлялся в первый визит к урологу, на 30, 60 и 90-й дни от начала терапии. Критериями оценки эффективности лечения были динамика баллов по опросникам, динамика болевого синдрома, динамика показателей урофлоуметрии (Qmax и Qave), остаточного объема мочи, лейкоцитов в моче и секрете простаты. В дальнейшем пациенты находились под динамическим наблюдением до 12 месяцев для оценки частоты рецидивов заболевания.
Статистический анализ результатов проводили с помощью пакета прикладных программ Statistica 7.0 (StatSoft Inc, США), t-критерия Стьюдента для связанных выборок, t-критерия Стьюдента для несвязанных выборок. Ранжирование выборки и составление распределений частот по проведенным измерениям позволяют установить существенные значения показателей диагностических измерений в проведенном исследовании. Ошибка репрезентативности распределения больных по группам – около 3,2%.
Результаты и обсуждение
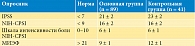
На этапе обследования и верификации диагноза ХБП больные были случайным образом разделены на две сопоставимые группы по показателям симптомов хронического простатита (табл. 1). Все пациенты, включенные в исследование, имели основной симптом – боль различной локализации: в промежности, в глубине таза, в наружных половых органах, проявляющуюся в виде тяжести и дискомфорта в промежности, с иррадиацией в половой член или уретру. По выраженности болевого синдрома в соответствии со шкалой интенсивности боли NIH-CРSI различий между группами исследования не было.
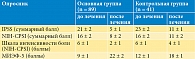
Результаты лечения через три месяца по группам представлены в табл. 2. Благодаря комплексной фармакотерапии в основной группе пациентов, получавших Галавит, отмечалось более значимое снижение симптомов хронического простатита и тазовой боли в сравнении с контрольной группой, принимавшей НПВС. Так, в основной группе суммарный индекс по шкале IPSS на 90-й день снизился до 5 ± 1 баллов в сравнении с 11 ± 1 баллами в контрольной группе (p < 0,01), а снижение общего балла по опроснику NIH-CРSI достигло 8 ± 2 в сравнении с 11 ± 2 баллами (p < 0,01) соответственно. Причем показатель интенсивности боли по шкале NIH-CРSI на 90-й день после проводимой терапии у пациентов основной группы был вдвое меньшим, чем в контрольной группе (средний балл 2 ± 1 против 4 ± 1 балла; p < 0,01). Это показывает достоверно лучший терапевтический эффект комплексной терапии ХБП с применением препарата Галавит в сравнении с лечением, включавшим нимесулид, в отношении купирования главных симптомов СХТБ и СНМП.
Анализ данных дополнительного опросника МИЭФ-5 в основной группе на фоне лечения Галавитом показал более выраженное повышение среднего балла до 22 ± 2 в сравнении с контрольной группой (18 ± 1 баллов), что свидетельствует о существенном улучшении эректильной функции после лечения с применением препарата Галавит (табл. 2).
Анализ результатов опросников в динамике по промежуточным точкам исследования показал, что уже на 30-й день средний балл по опроснику IPSS был достоверно меньше в основной группе (19 ± 2,4 балла в сравнении с 21 ± 1,5; p < 0,01); на 60-й и 90-й дни тенденция снижения среднего балла сохранялась, и разница между группами нарастала (рис. 1).
Показатели интенсивности боли по шкале опросника NIH-CРSI в исследуемых группах получили достоверное различие на 30-й день: средний балл снизился до 4 ± 1 против 6,5 ± 1 в контрольной группе (р < 0,01), и данное различие сохранялось на 60-й и 90-й дни (p < 0,01) (рис. 2), что может свидетельствовать о более выраженном противовоспалительном эффекте на фоне применения Галавита в сравнении с НПВС в комплексной терапии ХБП.
При анализе результатов опросника МИЭФ-5 выявлено, что на 30-й день увеличение среднего балла у пациентов основной группы происходило интенсивнее (15,4 ± 1,7 в сравнении с 12,0 ± 2,4 баллами в контрольной группе; p < 0,01). На 60-й день показатели среднего балла в обеих группах имели дальнейшее повышение вплоть до 90-го дня, но более выраженно в основной группе (рис. 3).
Таким образом, оценка динамики показателей опросников симптомов хронического простатита показала значимый положительный результат – уменьшение выраженности симптомов СХТБ и СНМП не только в период проведения фармакотерапии, но и в течение последующих двух месяцев, причем в основной группе после терапии с включением Галавита эффект был достоверно более выраженным в течение последующих двух месяцев в сравнении с контрольной группой после стандартной терапии с НПВС.
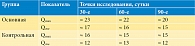
Полученная динамика симптомов ХБП по данным опросников подтверждается результатами объективных лабораторно-инструментальных исследований. Результаты оценки показателей уродинамики на фоне лечения пациентов ХБП в исследуемых группах выявили следующие различия. Так, в основной группе на фоне комплексной терапии достигнуто увеличение среднего значения максимальной объемной скорости мочеиспускания Qmax с 9,8 мл/с в начале терапии до 23 мл/с к 30-му дню, достигнув нормальных значений, с сохранением этих показателей до конца периода наблюдения. В контрольной группе увеличение показателя Qmax также отмечалось, но достигло 16 мл/с к 30-му дню и оставалось на уровне 15 мл/с до конца исследования (табл. 3). При этом положительная динамика и нормализация показателей Qmax отмечалась в основной группе достоверно чаще, чем в контрольной группе: на 30-й день – в 90% против 78%, на 90-й день – в 84% против 68% соответственно (р < 0,02).
Другой показатель уродинамики – средний объем остаточной мочи – достоверно снижался и к концу исследования составил в основной группе 8 см3 в сравнении с 28 см3 в контрольной группе, а нормализация показателя была достигнута у большей доли пациентов основной группы (92% в сравнении с 68%, р < 0,01).
По результатам лабораторных исследований на фоне комплексной фармакотерапии нормализация показателей анализа мочи отмечалась у 95% пациентов в обеих группах, а среднее количество лейкоцитов в моче составило 1–2 в п/зр в основной группе и 6–8 в п/зр в контрольной группе пациентов, отмечалась нормализация секрета простаты у 85% со снижением среднего количества лейкоцитов до 4–6 и 8–10 в п/зр соответственно по группам.
Достигнутый терапевтический эффект после проведения комплексной терапии с добавлением Галавита при лечении пациентов с ХБП показал клиническое преимущество не только по более выраженному уменьшению симптомов, но и предупреждению рецидивов заболевания. Так, в основной группе отсутствие рецидивов отмечалось у 84% пациентов, тогда как в контрольной группе – у 68% в период наблюдения от 6 до 12 месяцев после лечения.
Таким образом, исследование показало, что применение препарата Галавит в комплексной терапии хронического простатита позволяет добиться более выраженного и стойкого эффекта в кратчайшие сроки по сравнению с использованием стандартных НПВС.
Результаты нашего исследования согласуются с данными двух ранее проведенных исследований с включением в комплексную терапию ХБП иммуномодулятора с противовоспалительным действием Галавита [13, 14]. Так, в исследовании М.Н. Шаплыгина и соавт. в группе пациентов с ХБП, получавших Галавит, также отмечена более выраженная динамика симптомов по шкале IPSS и у большей доли пациентов достигалась нормализация суммарного балла, а также с большей частотой наблюдалось улучшение уродинамики (Qmax и Qave) по данным урофлоуметрии [13]. Кроме того, в иммунограммах пациентов происходила нормализация сниженных показателей клеточного звена иммунитета (субпопуляций лимфоцитов CD3, CD4, CD8), что является свидетельством иммуномодулирующего эффекта Галавита и обеспечивает патогенетическую основу комплексной терапии инфекционно-воспалительного процесса при ХБП. В исследовании О.Б. Жукова и соавт. у пациентов с ХБП и ИППП или вирусной этиологии на фоне терапии Галавитом отмечалось значимое снижение суммарного балла симптомов по опроснику NIH CPSI, в том числе болевого синдрома, а также улучшение эректильной функции по шкале МИЭФ-5 у 85% пациентов [14]. При трансабдоминальном ультразвуковом (УЗ) исследовании отмечалось уменьшение объема предстательной железы; в режиме соноэластографии и УЗ-контрастирования объем гиперэхогенных и эхоплотных очагов снижался и увеличивалось количество функционирующей и хорошо кровоснабжаемой паренхимы простаты. Такой эффект может быть результатом регенеративного действия Галавита, опосредованного стимуляцией выработки моноцитами/макрофагами в очаге воспаления ключевых ростовых факторов, регулирующих регенеративные процессы, ангиогенез, выработку коллагена [15]. Галавит является препаратом с комбинированным механизмом действия, проявляет иммуномодулирующее, противовоспалительное, антиоксидантное свойства, ускоряет и нормализует регенерацию тканей, что снижает вероятность образования рубцов и способствует сохранению функциональной паренхимы.
Заключение
Включение Галавита в комплексную терапию ХБП:
- обеспечивает более выраженное уменьшение основных симптомов заболевания, в том числе болевого синдрома, по сравнению со стандартной терапией с НПВС (нимесулид);
- способствует более значимому и стойкому улучшению показателей уродинамики благодаря противовоспалительному действию;
- приводит к более длительному терапевтическому эффекту, обеспечивает более стойкий период ремиссии и меньшую частоту рецидивов, чем терапия с НПВС (нимесулид).
Таким образом, вследствие оптимизации комплексной терапии ХБП с использованием Галавита улучшаются клинические результаты лечения, благодаря чему препарат Галавит может быть рекомендован пациентам с хроническим бактериальным простатитом.
I.A. Panchenko, PhD, R.I. Panchenko
Regional Clinical Specialized Uroandrology Center, Stavropol
Contact person: Rodion I. Panchenko, panch279@gmail.com
Chronic bacterial prostatitis (CВР) is the most common disease in urological practice, clinically diagnosed on the basis of signs of inflammation and the presence of infection in the secretion of the prostate gland. Accompanied by chronic pelvic pain syndrome (CPPS), lower urinary tract syndrome (LUTS) and copulative dysfunction. CВР remains the most common form of persistent infection of the lower male urinary tract, so treatment is an urgent and time-consuming problem in modern outpatient urology.
Objective. To study the effectiveness of Galavit in the complex therapy of CВР patients in comparison with the standard use of non-steroidal anti-inflammatory drugs (NSAIDs) to optimize treatment.
Material and methods. A retrospective analysis of the results of examination and treatment of 130 patients with CВР aged 25–50 years was carried out. The diagnostic algorithm included: a three-glass urine sample, PSA level, digital rectal examination, prostate secretion examination, uroflowmetry, IPSS, NIH-CPSI, IIEF-5 questionnaires. All patients received standard therapy for 4 weeks: antibiotics, alpha-blockers, prostate protectors; in the main group (n = 89) Galavit was prescribed, in the control group (n = 41) – nimesulide. The evaluation of the results was carried out on the 30th, 60th, 90th day; follow-up up to 12 months to evaluate relapses.
Results. After 3 months, the main group showed a more significant decrease in CPPS/LUTS symptoms compared to the control group: the total IPSS index decreased to 5 ± 1 points against 11 ± 1 points (p < 0.01), a decrease in the total NIH-CPSI reached 8 ± 2 vs. 11 ± 2 (p < 0.01), respectively. The pain intensity index according to the NIH-CPSI Scale in the main group was two times lower than in the control group (mean score 2 ± 1 vs. 4 ± 1 points; p < 0.01). In the main group, an increase in the average Qmax from 9.8 ml/sec to 23 ml/sec by the 30th day was achieved and persisted until the end of the observation period (up to 16 ml/sec in the control group); the average volume of residual urine significantly decreased to 8 cm3 in the main group against 28 cm3 in the control group. The frequency of positive urodynamics was noted significantly more often in the main group than in the control group (p < 0.01). The absence of relapses was noted in the main group in 84% of patients and in 68% in the control group during the observation period up to 12 months.
Conclusions. The inclusion of Galavit in the complex therapy of CВР provides a more pronounced reduction in the main symptoms of the disease compared to standard therapy with NSAIDs, which contributes to the optimization of treatment and can be recommended for patients with CВР.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.