Опыт внедрения TIRADS
- Аннотация
- Статья
- Ссылки
- English


Введение
Узловой зоб является наиболее распространенным и изученным эндокринным заболеванием, однако возникают все новые вопросы по ведению таких пациентов. В частности, отмечается неуклонный рост заболеваемости дифференцированным раком щитовидной железы (ДРЩЖ) как среди взрослых, так и среди детей [1]. Некоторые авторы связывают данную тенденцию с доступностью визуализирующих методов обследования (ультразвукового исследования (УЗИ), компьютерной томографии (КТ), магнитно-резонансной томографии) и соответственно улучшением диагностики. Как следствие, эпидемия узловых образований, а также повышение количества необоснованных оперативных вмешательств на щитовидной железе [2]. Однако нельзя исключать и истинный рост заболеваемости.
В настоящее время основными факторами, способствующими онкогенезу, считают неблагоприятную экологическую обстановку, увеличение количества медицинских обследований с использованием ионизирующего излучения (КТ, рентген, сцинтиграфия), распространение лучевых методов лечения, загрязнение окружающей среды токсическими веществами, обладающими канцерогенными свойствами [1, 3]. Свой вклад также вносят изменение образа жизни, ожирение. Установлено, что инсулинорезистентность и гиперинсулинемия повышают риск развития всех видов рака [4, 5].
В России в 2005–2015 гг. отмечено возрастание заболеваемости ДРЩЖ на 22,5%. Распространенность патологии среди лиц мужского пола увеличилась на 37,5%, женского пола – на 19,6%. Наибольший удельный вес приходится на возрастные группы от 15 до 19 лет (10,8%), от 20 до 24 лет (10,4%), от 25 до 29 лет (8,8%), от 30 до 34 лет (7,9%).
В настоящее время усилия специалистов направлены на установление причин повышения заболеваемости ДРЩЖ, улучшение диагностических методов, позволяющих выявлять злокачественные образования на ранних стадиях, создание систем стратификации риска, проведение профилактических мероприятий и своевременного лечения.
Использование УЗИ и его относительно низкая стоимость сыграли ключевую роль в повышении выявляемости рака щитовидной железы [6, 7]. В 2009 г. E. Horvarth и соавт., взяв за основу принципы разработки BIRADS (Breast Imaging Reporting and Data System), создали TIRADS (Thyroid Image Reporting and Data System) [8]. Последняя представляет собой классификацию признаков, выявляемых при проведении УЗИ щитовидной железы, по степени риска злокачественности новообразования. TIRADS позволяет интерпретировать и протоколировать очаговую патологию щитовидной железы для выработки оптимальной тактики ведения пациентов [7]. Предпосылками создания данной системы стали [9]:
- быстрый рост заболеваемости;
- стремительное улучшение выявляемости очаговой патологии щитовидной железы благодаря увеличению количества диагностических методов и технологий визуализации, прежде всего УЗИ, появлению новейших технологий эхографии (цветокодированных режимов, трехмерной реконструкции, эластографии, контраст-усиленной ультразвуковой диагностики и т.д.);
- большое количество ошибок на всех этапах диагностического поиска;
- субъективность существующих критериев отбора пациентов для проведения тонкоигольной аспирационной биопсии (ТАБП);
- отсутствие преемственности специалистов, неверная или неполная интерпретация результатов УЗИ как врачами-диагностами, так и эндокринологами, хирургами;
- отсутствие стандартного подхода.
В 2011 г. J.Y. Kwak и соавт. модифицировали TIRADS. Ее использование позволило значительно улучшить интерпретацию выявляемой патологии щитовидной железы и стандартизировать лечебно-диагностический алгоритм [9].
В 2017 г. Европейская тиреоидологическая ассоциация выпустила рекомендации по ультразвуковой стратификации риска развития рака щитовидной железы – EU-TIRADS. Аналогичные рекомендации выпустили Американская тиреоидологическая ассоциация (ACR-TIRADS, 2017) и Корейское общество радиационной тиреоидологии (K-TIRADS, 2016). На сегодняшний день в России TIRADS используется редко.
Целью нашего исследования стала оценка эффективности использования TIRADS в рутинной клинической практике, а также изучение дополнительных факторов риска развития ДРЩЖ.
Материал и методы
В исследование были включены пациенты (n = 6156), прикрепленные к ФГБУ «Поликлиника № 2» Управления делами Президента РФ, которым проводилось УЗИ щитовидной железы с января 2016 г. по март 2018 г.
Среди них женщин – 4545 (74%), мужчин – 1611 (26%). Минимальный возраст пациентов составлял 24 года, максимальный – 76 лет, средний – 53 года.
Все пациенты прошли стандартное эндокринологическое обследование: сбор жалоб, анамнеза, физикальный осмотр, включая визуально-пальпаторную оценку щитовидной железы. При наличии жалоб, характерных для патологии щитовидной железы, определяли уровень тиреотропного гормона (ТТГ), свободного тироксина, свободного трийодтиронина, антител к тиреопероксидазе, тиреоглобулина и антител к рецепторам ТТГ. При подозрении на озлокачествление проводили ТАБП с цитоморфологией пунктата. Гистологическое исследование удаленной тиреоидной ткани выполняли после тиреоидэктомии.
Сбор данных осуществляли с помощью программного обеспечения MCS 2000.
Для оптимизации работы врача-эндокринолога и улучшения контроля за узловыми образованиями щитовидной железы в ФГБУ «Поликлиника № 2» Управления делами Президента РФ была внедрена система TIRADS.
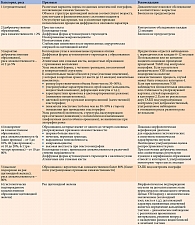
Анализ ультразвукового изображения по TIRADS предполагает выделение определенных оценочных категорий (табл. 1).
Для более эффективного использования системы TIRADS была создана внутренняя система реагирования при выявлении категорий 4 и 5 TIRADS. Сформирован статистический отчет «Впервые выявленная жизнеопасная патология». Информация о пациенте и выявленной патологии автоматически поступала на рабочий компьютер заведующего отделением ультразвуковой диагностики, терапевтическим отделением, хирургическим отделением, а также врача-эндокринолога с пометкой «Срочно!». Указанные специалисты также имели доступ к электронной истории болезни пациента, протоколу УЗИ, результатам других инструментальных и лабораторных методов исследования, дневникам врачей.
Кроме того, были созданы три статистических отчета по выявленным категориям TIRADS, позволяющих отслеживать количество проведенных УЗИ, присвоение категорий, положительную и отрицательную динамику, переход пациента в другую категорию риска.
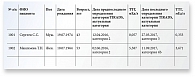
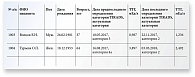
Для удобства использования отчетов были созданы дополнительные фильтры. С их помощью можно было выбрать участок прикрепления пациента, лечащего врача, отслеживать и сопоставлять результаты лабораторных анализов (рис. 1–3).
Результаты
Было проведено 6156 УЗИ щитовидной железы. Уровень ТТГ определен у 3672 пациентов.
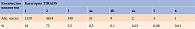
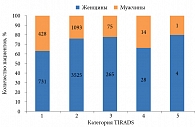
Распределение пациентов в зависимости от категории TIRADS представлено в табл. 2.
Распределение пациентов в разных категориях TIRADS в зависимости от пола представлено на рис. 4.
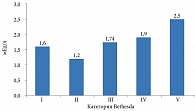
Средний уровень ТТГ у пациентов с TIRADS 1 составлял 1,79 мЕд/л, с TIRADS 2 – 2,12 мЕд/л, с TIRADS 3 – 2,08 мЕд/л, с TIRADS 4a – 1,59 мЕд/л, TIRADS 4b – 1,65 мЕд/л, TIRADS 4c – 0,94 мЕд/л, TIRADS 5 – 1,2 мЕд/л, TIRADS 6 – 3,8 мЕд/л.
В ходе исследования выявлена прямая связь между риском развития рака щитовидной железы и возрастом пациентов. Доля пациентов моложе 30 лет и старше 60 лет увеличивалась в категориях TIRADS c высоким риском развития рака щитовидной железы (рис. 5).
При проведении повторного УЗИ у 79 (1,2%) пациентов выявлена положительная динамика, поэтому они были переведены в категории с более низким риском развития рака щитовидной железы, преимущественно в категории 2 и 3.
У 55 (0,9%) пациентов выявлена отрицательная динамика, по результатам повторного УЗИ они были переведены в более высокую категорию TIRADS.
За период наблюдения 59 пациентам проведена ТАБП, пунктированы 88 узлов.
По результатам цитологического исследования у шести пациентов (один мужчина и пять женщин) выявлены признаки папиллярного рака, у восьми женщин – цитограмма фолликулярной аденомы. Проведено десять тиреоидэктомий. Четыре пациента с фолликулярными аденомами отказались от оперативного лечения и находились под наблюдением эндокринолога. Послеоперационное гистологическое исследование ткани узлов щитовидной железы подтвердило цитологический диагноз в 100% случаев.
Показатель впервые выявленных злокачественных новообразований в 2016 г. составил 10,7 на 100 тыс. человек (8,1 в среднем по России и 7,28 по г. Москве), в 2017 г. – 28,8 на 100 тыс. человек, что значительно превышает среднее значение по Россиии и подтверждает эффективность выбранной диагностической стратегии.
Выявлена также взаимосвязь между уровнем ТТГ и риском развития рака щитовидной железы. Более высокий уровень ТТГ ассоциировался с более высокими категориями риска – Bethesda IV и V.
Выводы
Система TIRADS является эффективным методом диагностики и наблюдения за узловыми образованиями щитовидной железы в условиях поликлиники. Работа с классификацией TIRADS позволила:
- объективизировать УЗИ щитовидной железы – стандартизировать интерпретацию данных исследования, оценить злокачественный потенциал узла по его эхографическим признакам, определить показания к биопсии, состояние регионарных лимфоузлов;
- обеспечить преемственность между врачами ультразвуковой диагностики, лучевой диагностики, эндокринологами, хирургами, как следствие, гарантировать своевременность лечебно-диагностических мероприятий;
- улучшить показатели выявляемости очаговой патологии щитовидной железы за счет увеличения количества ультразвуковых, эластографических исследований, уменьшения необоснованных повторных УЗИ и ТАБП щитовидной железы;
- выработать единую тактику обследования, ведения и лечения пациентов с различной патологией щитовидной железы, определить объем хирургического вмешательства при верифицированных опухолях;
- разработать единую систему реагирования при выявлении категорий 4 и 5 TIRADS.
При соответствующем заполнении всех пунктов алгоритма протокола УЗИ в электронной истории болезни проводится массовая рассылка писем-уведомлений врачам-эндокринологам о новом случае выявленной патологии щитовидной железы с высокой категорией TIRADS, требующей дальнейших оперативных действий со стороны клинициста. Все сведения формируются в отчет «Впервые выявленная жизнеопасная патология». Среди недостатков следует отметить следующие:
- при присвоении категории TIRADS не предусмотрена оценка локализации и размеров узла, учитывается только эхографическая картина узловых образований;
- отсутствуют четкие рекомендации по дальнейшему наблюдению пациентов с категориями 4 и 5 TIRADS и по некоторым причинам (малые размеры узла, отказ пациента от проведения ТАБП) не проводится морфологическая верификация узла;
- следует учитывать, что, несмотря на объективизацию результатов УЗИ, метод остается операторзависимым. На присвоение категории, а также на оценку динамики и перевод пациента в другую категорию влияет квалификация врача, проводящего исследование.
S.V. Novosad, N.S. Martirosyan, I.G. Novichkova, N.A. Petunina
I.M. Sechenov First Moscow State Medical University
Polyclinic № 2 of the Administration of the RF President
Contact person: Sofya Vladimirovna Novosad, sophia.novosad@gmail.com
The system of control over pathology of a thyroid gland, including differentiated thyroid cancer is presented, of civil servants: ultrasound examination protocols, statistical reports on identified TIRADS categories, positive and negative dynamics, way of response in the case detection of life-endangering pathology. Executed the effectiveness evaluation of the system TIRADS, its correlation with the Bethesda system. Investigated independent risk factors for thyroid cancer, such as sex, age, thyroid-stimulating hormone levels.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.