Применение эверолимуса в терапии метастатического медуллярного рака щитовидной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
Нейроэндокринные опухоли (НЭО) представляют собой гетерогенную группу новообразований, происходящих из разных типов нейроэндокринных клеток, находящихся в различных органах и тканях. По данным американского регистра, общая заболеваемость составляет 5,25 случая на 100 000 человек. Более 51% НЭО возникает в органах желудочно-кишечного тракта (ЖКТ), 27% – в легких и 6% – в поджелудочной железе [1]. Регистр больных НЭО в России находится в стадии формирования.
При локализованных формах заболевания основным методом лечения считается хирургический [1, 2]. Однако на момент постановки диагноза 5–44% пациентов с НЭО ЖКТ и 28% пациентов с НЭО легких имеют метастатическое поражение [1].
При лечении диссеминированных форм НЭО используются аналоги соматостатина, интерфероны, цитостатики, таргетные препараты: ингибитор протеина mTOR и ингибиторы тирозинкиназы [2, 3–6].
Наследственный и спорадический медуллярный рак щитовидной железы встречается крайне редко. Это достаточная сложная для лечения нейроэндокринная злокачественная опухоль, составляющая 3–4% всех тиреоидных карцином [7, 8]. По данным зарубежных авторов, заболеваемость составляет 0,11 случая на 100 000 человек [9].
При локальном процессе рекомендовано хирургическое лечение в объеме тиреоидэктомии с профилактическим удалением центральной клетчатки шеи [7, 9]. Для паллиативного лечения метастазов химиотерапевтические режимы малоэффективны.
Клинический случай
Пациентка, 25 лет, обратилась впервые в Областной онкологический диспансер г. Иркутска в апреле 2010 г. по поводу увеличения лимфатических узлов на шее. Из анамнеза: в августе 2005 г. по месту жительства проведено оперативное лечение по поводу медуллярного рака щитовидной железы в объеме правосторонней гемиструмэктомии щитовидной железы с лимфодиссекцией. При цитологическом исследовании увеличенных лимфатических узлов выявлены метастазы медуллярного рака. Уровень кальцитонина – 1152 пкг/мл. При обследовании отдаленного метастазирования органов и систем не выявлено, синдром множественной эндокринной неоплазии исключен. В июне 2010 г. выполнены эпифасциальная тиреоидэктомия, футлярно-фасциальная лимфодиссекция справа и слева. При гистологическом исследовании в удаленных лимфатических узлах подтверждены метастазы медуллярной карциномы щитовидной железы. При динамическом наблюдении в ноябре 2010 г. зафиксировано повышение уровня кальцитонина до 3071 пкг/мл. Результаты мультиспиральной компьютерной томографии (МСКТ) показали метастатическое поражение печени (единичные очаги), остеобластические метастазы в телах позвонков Th11, L2, L3. Клинически – болевой синдром в поясничном отделе позвоночника.
В связи с прогрессированием заболевания пациентке выполнили три курса системной полихимиотерапии с интервалом 21 день: доцетаксел 70 мг/м2, цисплатин 70 мг/м2.
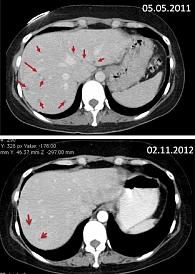
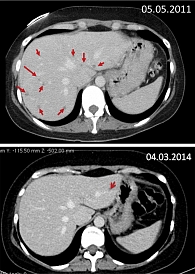
После того как было выявлено прогрессирование заболевания, провели еще три курса с интервалом 21 день по схеме: карбоплатин АUС6, доксорубицин 50 мг/м2. По данным МСКТ органов брюшной полости, выполненной в мае 2011 г., выявлены множественные метастатические очаги в печени. Принимая во внимание, что медуллярный рак щитовидной железы – НЭО, было принято решение о назначении с июня 2011 г. эверолимуса 10 мг/сут ежедневно в комбинации с препаратом Октреотид-лонг ФС 30 мг внутримышечно один раз в 28 дней. При оценке результатов непрерывной терапии через 18 месяцев (ноябрь 2012 г.) зафиксирована выраженная положительная динамика (рис. 1).
С учетом выраженного эффекта терапия была продолжена. Через 32 месяца (март 2014 г.) непрерывной терапии почти полностью исчезли метастатические очаги в печени, стабилизировался процесс в позвонках, уровень кальцитонина достиг 1068 пкг/мл. Какие-либо клинические проявления заболевания отсутствовали (рис. 2).
С марта 2014 г. пациентку перевели на монотерапию эверолимусом.
При контрольном обследовании, проведенном в декабре 2014 г., отмечался полный регресс метастатических очагов в печени. Уровень кальцитонина составлял 1012 пкг/мл.
Из-за отсутствия эверолимуса в клинике лечение этим препаратом не проводилось с августа по ноябрь 2015 г. С декабря 2015 г. прием был возобновлен. Последняя оценка эффективности, проведенная в январе 2016 г., подтвердила отсутствие прогрессирования заболевания. Уровень кальцитонина составлял 1034 пкг/мл.
В феврале 2016 г. общая продолжительность приема эверолимуса составила 51 месяц.
Терапия была безопасной, хорошо переносилась больной. Из нежелательных явлений, наблюдаемых в процессе лечения, имел место рецидивирующий стоматит 1–2-й степени. Он, как правило, проявлялся единичными эрозиями на слизистой оболочке десен. При использовании местных антисептиков, противогрибковых препаратов симптомы стоматита быстро купировались, снижения дозы и отмены препарата не потребовалось. В феврале 2015 г. пациентка перенесла гнойный гайморит, что потребовало двухнедельного перерыва в лечении и назначения антибиотикотерапии. С первых месяцев лечения присутствовала астения, проявлявшаяся повышенной утомляемостью и сонливостью.
Отклонения гематологических и биохимических показателей от физиологических норм в процессе лечения не наблюдалось. Других нежелательных явлений не зарегистрировано.
Обсуждение
На сегодняшний день эверолимус – препарат с доказанной высокой эффективностью в лечении широкого спектра прогрессирующих НЭО [10–13]. Результаты исследования RADIANT-2, в которое были включены пациенты с НЭО разных локализаций с карциноидным синдромом и прогрессированием на фоне химиотерапии, показали, что медиана общей выживаемости без прогрессирования в группе «эверолимус + октреотид ЛАР» была выше, чем в группе «плацебо + октреотид ЛАР», – 16,4 против 11,3 месяца [12].
В исследовании RADIANT-3 оценивали эффективность терапии эверолимусом у больных метастатическими НЭО поджелудочной железы с прогрессированием на фоне химиотерапии или терапии аналогами соматостатина [11]. Больные были рандомизированы в группы эверолимуса 10 мг/сут (n = 207) и плацебо (n = 203). Согласно результатам, медиана выживаемости без прогрессирования в группе эверолимуса была значимо выше, чем в группе плацебо, – 11,0 против 4,6 месяца. Медиана общей выживаемости составила 44,0 и 37,7 месяца соответственно [11].
В международном двойном слепом исследовании RADIANT-4, результаты которого были представлены на Европейском онкологическом конгрессе в 2015 г. в Вене, приняли участие 302 пациента с распространенными нефункциональными высокодифференцированными НЭО легких или ЖКТ. Участники исследования получали эверолимус в первой или второй линии терапии [6]. В результате случайного распределения пациенты попадали в экспериментальную или контрольную группу в соотношении 2:1, соответственно принимали эверолимус 10 мг или плацебо. Главным критерием эффективности служил показатель выживаемости без прогрессирования. Применение эверолимуса способствовало 52%-ному снижению риска прогрессирования опухоли или летального исхода, а также увеличению среднего показателя выживаемости без прогрессирования более чем на семь месяцев [10]. Пациенты хорошо переносили препарат.
Профиль безопасности эверолимуса в представленных исследованиях был практически одинаков. Наиболее частые побочные эффекты, связанные с его применением: афтозные язвы во рту (53,9 против 13,3%), кожная сыпь (52,5 против 15,8%), диарея (48,0 против 23,6%), хроническая усталость (44,6 против 26,6%), а также склонность к инфекциям [10, 11].
Во всех проведенных клинических исследованиях использование эверолимуса в лечении широкого диапазона метастатических НЭО было связано со значительным улучшением выживаемости без прогрессирования. Выводы о безопасности были сопоставимы с известным профилем токсичности препарата [10–12].
Незначительное количество больных с медуллярным раком щитовидной железы ограничивает проведение крупных клинических исследований. Однако в одной из первых публикаций авторы продемонстрировали эффективность эверолимуса in vitro и in vivo в комбинации с октреотидом ЛАР у двух пациентов с прогрессирующим медуллярным раком щитовидной железы [14]. Генетические изменения, влияющие на тирозинкиназные сигнальные пути и возникающие в опухолях щитовидной железы [8, 15], инициировали несколько клинических исследований фазы II для оценки безопасности и эффективности применения эверолимуса у пациентов с распространенным раком щитовидной железы [16–18].
В одном из клинических исследований фазы II [14] семь пациентов с метастатическим медуллярным раком щитовидной железы принимали эверолимус. Главной задачей было определение эффективности лечения, оценка токсичности. Полученные результаты оказались многообещающими [16]. Учитывая высокий уровень клинической пользы и относительно низкий профиль токсичности, авторы считают, что исследования необходимо продолжать в более крупных когортах пациентов, используя эверолимус в монорежиме в последовательной или комбинированной терапии [16, 17].
Представленный нами клинический случай подтверждает высокую эффективность применения эверолимуса в лечении редкой НЭО – спорадического метастатического медуллярного рака щитовидной железы. Заболевание на этой стадии является неизлечимым, однако использование эверолимуса в отсутствие токсических явлений 3–4-й степени позволило увеличить продолжительность жизни, длительно осуществлять контроль над заболеванием. При этом сохранялись достаточно удовлетворительное качество жизни и социальный статус пациентки.
Заключение
Применение эверолимуса в лечении метастатического медуллярного рака щитовидной железы в данном клиническом случае привело к длительному выраженному положительному эффекту. Продолжительность жизни пациентки с момента подтверждения метастазирования составила 56 месяцев без признаков прогрессирования. Удовлетворительная переносимость препарата, отсутствие тяжелых нежелательных явлений, поддержание хорошего качества жизни позволяют продолжать терапию.
A.V. Shevchuk, D.M. Ponomarenko, D.Yu. Yukalchuk, M.V. Demchenkova
District Oncologic Dispensary (Irkutsk)
Contact person: Anna Vitalyevna Shevchuk, anna-shevchuk@yandex.ru
Here, we describe a clinical case of efficient long-term use of everolimus during metastatic medullary thyroid cancer, which is a rare neuroendocrine tumor deriving from APUD-system (C-cells) that may occur sporadically, in 25% cases observed during syndrome of multiple endocrine neoplasia type IIa and IIb. Upon that, surgery is the major therapeutic approach. During metastatic spreading, no efficient chemotherapy regimens exist. Targeted therapy with everolimus during metastatic medullary thyroid cancer allows to increase progression-free and total survival, preserve quality of life and social status of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


