Вандетаниб при медуллярном раке щитовидной железы
- Аннотация
- Статья
- Ссылки
- English

Введение
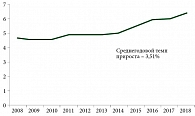
Рак щитовидной железы (РЩЖ) выявляется чаще других карцином эндокринной системы. С 2008 по 2018 г. показатели заболеваемости РЩЖ в России увеличились на 43,52% (рис. 1) [1].
Медуллярный рак щитовидной железы (МРЩЖ) регистрируется примерно в 4% случаев среди всех форм РЩЖ [1, 2]. В Иркутской области в 2019 г. выявлено десять пациентов с МРЩЖ [3]. Общая десятилетняя выживаемость при этом заболевании достигает в среднем 75%, однако при метастатическом и местнораспространенном МРЩЖ сокращается до 40% [4–7].
МРЩЖ встречается в виде самостоятельного (спорадического) и наследственного заболевания в рамках синдромов множественной эндокринной неоплазии (МЭН) типов 2А и 2Б. При наследственных формах МРЩЖ манифестирует в 100% случаев [8]. Спорадический МРЩЖ может возникнуть в любом возрасте, но чаще приходится на возраст 30–60 лет [1].
К основным факторам прогноза относят RET-статус и размер первичного очага [6, 9]. Протоонкоген RET локализуется на длинном плече 10-й хромосомы, локус 11.2. Он кодирует трансмембранный тирозинкиназный рецептор, экспрессирующийся на тиреоидных C-клетках [9, 10]. Практически весь наследственный МРЩЖ и около 40% спорадического МРЩЖ имеют мутантный тирозинкиназный рецептор, являющийся продуктом гена RET [9, 11]. В спорадическом МРЩЖ помимо RET-мутации встречаются мутации H-RAS (около 56% случаев), KRAS и редко NRAS [9, 12].
На момент установления диагноза 13–15% пациентов с МРЩЖ уже имеют местнораспространенный процесс и отдаленные метастазы. Эффективного системного лечения до появления таргетной терапии не было [13]. В настоящее время при нерезектабельном местнораспространенном или метастатическом МРЩЖ препаратом выбора считается мультикиназный ингибитор (МКИ) вандетаниб [4, 14].
Клинический случай
В 2002 г. у пациентки в возрасте 46 лет диагностирован МРЩЖ, стадия III, Т3N0M0 по международной классификации TNM 7. Выполнена тиреоидэктомия с центральной лимфодиссекцией. После хирургического лечения рекомендована заместительная гормонотерапия L-тироксином 125 мкг/сут, которую пациентка получает и сегодня. Регулярно проходила контрольное обследование: ультразвуковое исследование (УЗИ) шеи и брюшной полости, компьютерная томография (КТ) шеи и грудной клетки, анализ крови на гормоны (кальцитонин, тиреотропный гормон (ТТГ), периферические тиреоидные гормоны (Т3, Т4), раковый эмбриональный антиген (РЭА)).
В январе 2008 г. при очередном контрольном обследовании выявлено повышение уровня кальцитонина в крови до 1700 пг/мл, увеличение размеров шейного лимфоузла справа до 0,9 × 0,5 мм по данным УЗИ и КТ. С целью дообследования на предмет рецидива проведена тонкоигольная аспирационная биопсия, морфологически – картина медуллярного рака. По поводу метастаза в шейном лимфоузле справа выполнена операция – лимфаденэктомия шеи справа. После этого уровень кальцитонина снизился. Послеоперационное гистологическое исследование подтвердило метастатическое поражение лимфоузла МРЩЖ. Последующие пять лет пациентка находилась под динамическим наблюдением, дополнительного лечения основного заболевания не проводилось.
В марте 2013 г. уровень кальцитонина – 1250 пг/мл. Диагностированы рецидив в ложе удаленной опухоли щитовидной железы и повторный метастаз в шейном лимфоузле справа. Выполнена операция – удаление рецидива опухоли, лимфаденэктомия шеи справа. Иммуногистохимический анализ послеоперационного материала показал метастазы медуллярного рака в шейном лимфоузле и мягких тканях шеи. После операции уровень кальцитонина снизился до 775 пг/мл, РЭА – 154.
В июле 2014 г. зафиксировано прогрессирование заболевания. При обследовании уровень кальцитонина – 1055 пг/мл. Результаты КТ шеи, грудной клетки и брюшной полости показали метастаз в надключичном лимфоузле справа, подключичном лимфоузле справа, медиастинальных лимфоузлах, 11-м и 12-м грудных позвонках. При этом общее состояние пациентки оставалось удовлетворительным.
С 12 августа 2014 г. начата таргетная терапия препаратом вандетаниб (Капрелса) в дозе 300 мг/сут. Каждые две недели таргетной терапии проводились контроль клинического и биохимического анализов крови, электролитов крови (кальций, магний, калий), забор крови на гормоны (ТТГ, Т3, Т4), электрокардиограмма (ЭКГ). Каждые два месяца приема вандетаниба выполнялось контрольное обследование: УЗИ шеи, КТ шеи, грудной клетки и брюшной полости, анализ крови на гормоны (кальцитонин, ТТГ, Т3, Т4), РЭА. Дополнительной терапии не требовалось.
На 37-й день терапии, согласно результатам ЭКГ, зафиксировано нежелательное явление в виде усиления потенциалов левого желудочка, нарушения процессов реполяризации переднебоковой стенки левого желудочка. С целью купирования нежелательного явления прием вандетаниба был приостановлен на 12 дней. После нормализации показателей ЭКГ прием вандетаниба 150 мг/сут возобновился на фоне терапии эналаприлом и Панангином. В течение 7,5 месяца пациентка принимала вандетаниб 150 мг.
В апреле 2015 г. уровень кальцитонина увеличился до 3732 пг/мл, однако, согласно данным КТ шеи, грудной клетки и брюшной полости, стабилизация опухолевого процесса сохранялась. Дозу вандетаниба увеличили до 200 мг/сут. Через две недели на фоне приема препарата в указанной дозе отмечалось снижение уровня кальцитонина до 1291 пг/мл.
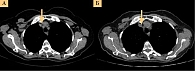
На данный момент пациентка продолжает прием вандетаниба в дозе 200 мг/сут. Регулярно оцениваются изменения в лимфоузлах (рис. 2 и 3), определяется уровень онкомаркера (в феврале 2020 г. уровень кальцитонина составил 1684 пг/мл), выполняются клинический и биохимический анализы крови. Состояние пациентки удовлетворительное, работоспособность сохранена.
Обсуждение
Лечение МРЩЖ обычно начинается с тиреиодэктомии. При единичных отдаленных метастазах (в пределах одного органа), медленном прогрессировании процесса эффективными могут быть хирургическое лечение либо другие методы местного воздействия (радиоабляция, фотодинамическая терапия, лучевая терапия, химиоэмболизация). Указанные процедуры не приводят к излечению, но способны отсрочить проведение системной терапии, снизить вероятность болевого синдрома, сдавления окружающих структур [2]. Применение лучевой терапии, стандартной химиотерапии не дает какого-либо объективного ответа у пациентов данной группы [4, 15, 16]. В качестве системной химиотерапии используется доксорубицин в монотерапии либо в комбинации с 5-фторурацилом и дакарбазином [9].
К настоящему моменту накоплены данные о молекулярно-генетических изменениях при МРЩЖ (экспрессия VEGF-A, VEGF-C, VEGFR-1, -2, -3, EGFR, mTOR, активность RET-киназы, в ряде случаев наличие BRAF-мутации), что позволяет рассчитывать на эффективность таргетной терапии. Большие надежды клиницисты возлагают на МКИ, позволяющие блокировать несколько ключевых киназных триггеров канцерогенеза [17].
В рандомизированном плацебоконтролируемом клиническом исследовании ZETA эффективность продемонстрировал мультикиназный (RET, VEGFR-2, VEGFR-3, EGFR, VEFR-1) ингибитор вандетаниб [9, 19]. В исследовании принимал участие 331 пациент из 23 стран. 231 пациент получал вандетаниб, остальные – плацебо [4]. Все пациенты были старше 18 лет с нерезектабельным либо метастатическим МРЩЖ. Встречались наследственные и спорадические формы. Другие критерии отбора включали в себя 0–2 балла по шкале ECOG и уровень кальцитонина выше 500 пг/мл [4]. На фоне приема вандетаниба объективный ответ при спорадическом RET-позитивном МРЩЖ зафиксирован в 51,8% случаев, контроль заболевания – в 87% случаев. Биохимическая ремиссия по показателям кальцитонина – 69% случаев, по канцерэмбриональному антигену – 52%, а в группе плацебо только 2% случаев [4]. Зарегистрированы стойкая частичная ремиссия – 20% и стабилизация заболевания более чем на 24 недели – 73% пациентов [4]. Общая безрецидивная выживаемость составила 30,5 месяца [21]. Суммарно выраженное побочное действие, повлиявшее на общее состояние и потребовавшее симптоматической терапии, наблюдалось примерно у 31% пациентов. Среди всех побочных эффектов различной выраженности чаще возникали диарея (56%) и кожные проявления (45%) [4]. Из сердечно-сосудистых побочных явлений – гипертензия – 32% и удлинение интервала QT – 14% пациентов [4]. Редукция дозы потребовалась лишь в 35% случаев (в исследовании кабозантиниба – в 79% случаев) [20]. Во время терапии вандетанибом также необходимо следить за уровнем ТТГ – на фоне лечения он может повышаться. Увеличение дозы левотироксина с 91 ± 24 до 116 ± 24 мкг/м2/кг обычно приводит к нормализации уровня ТТГ [17].
Вандетаниб применяли и в ряде других исследований с участием пациентов с МРЩЖ. Речь, в частности, идет об ограниченном исследовании по оценке эффективности вандетаниба 300 мг/сут у пациентов с мутацией RET+/- (по 40 пациентов в каждой группе), рандомизированном двойном слепом исследовании эффективности вандетаниба 150 и 300 мг/сут у пациентов с неоперабельным местнораспространенным и метастатическим МРЩЖ. Кроме того, в стадии набора пациентов находится исследование по применению вандетаниба у детей с синдромами МЭН 2А и МЭН 2Б.
Перспективным методом лечения в онкологии считается иммунотерапия. Исследования иммунотерапии МРЩЖ ведутся в нескольких направлениях:
- монотерапия дендритными клетками, тропными к РЭА (принимало участие семь пациентов, у трех из них зарегистрирован объективный ответ, период наблюдения составил 13,1 месяца);
- изучение экспрессии PD-L1 на послеоперационном гистологическом материале 16 пациентов с МРЩЖ. В результате исследования только у одной пациентки выявили PD-L1-позитивные клетки (5%), в остальных случаях реакция негативная;
- оценка эффективности комбинированного воздействия препаратами МКИ с иммуномодулирующим лечением (рекрутированные опухоль-ассоциированные макрофаги, Т-клеточная терапия, применение дендритных клеток) [21–23].
Опубликованных результатов применения иммунопрепаратов (ипилимумаб, пембролизумаб, ниволумаб, авелумаб) в монорежиме и комбинации с другими видами лечения при МРЩЖ на данный момент нет.
Исходя из изложенного, можно сделать вывод, что вандетаниб на сегодняшний день является золотым стандартом лечения пациентов с нерезектабельным местнораспространенным или метастатическим МРЩЖ.
Результаты
Целесообразность и эффективность МКИ при нерезектабельном местнораспространенном или метастатическом МРЩЖ не вызывают сомнения. При ограниченных возможностях лечения вандетаниб способствует значительному увеличению выживаемости без прогрессирования и характеризуется минимальным количеством побочных эффектов по сравнению с другими МКИ.
Рассмотренный клинический случай иллюстрирует потенциальный благоприятный эффект в отношении отдаленных результатов лечения при назначении вандетаниба при нерезектабельном местнораспространенном или метастатическом МРЩЖ. Показано, что применение вандетаниба более пяти лет позволило не только добиться частичной ремиссии опухолевого процесса, но и продлить жизнь без признаков прогрессирования.
K.V. Tolmachyov, D.Yu. Yukalchuk, M.V. Mirochnik, L.Ye. Ivanova, U.K. Masnikova
Irkutsk Regional Oncological Dispensary
Contact person: Konstantin V. Tolmachyov, mako-tolmachevs@mail.ru
The article presents a clinical case illustrating the effectiveness of vandetanib in progressive medullary thyroid cancer. The incidence of thyroid cancer is increasing every year. Accordingly, the number of patients in need of effective systemic therapy is increasing. The low effectiveness and high toxicity of standard chemotherapy requires the search for new treatment methods. Knowledge of key points and signaling pathways of carcinogenesis gives clinicians the hope for good results from the use of targeted therapy. The multi-kinase inhibitor vandetanib showed high efficacy and low toxicity. To date, vandetanib at a dose of 300 mg/day is recommended as a therapy for unresectable locally advanced or metastatic medullary thyroid cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


