Осложнения и причины летальности при АНЦА-ассоциированных системных васкулитах
- Аннотация
- Статья
- Ссылки
- English


![Рис. 1. Время, прошедшее от дебюта ПСВ до назначения патогенетической терапии, Me [LQ; HQ]](/upload/resize_cache/iblock/43e/195_350_1/Chudinov3.jpg)


Введение
Первичные системные васкулиты (ПСВ) представляют собой группу аутоиммунных заболеваний, при которых развивается некротизирующее воспаление сосудов, приводящее к ишемическим изменениям в органах и тканях, снабжение кровью которых осуществляется по пораженным сосудам [1]. К группе ПСВ с поражением сосудов мелкого и среднего калибра относятся гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА), эозинофильный гранулематоз с полиангиитом (ЭГПА), узелковый полиартериит (УП) [2]. Гранулематоз с полиангиитом – аутоиммунное заболевание, характеризующееся гранулематозным воспалением респираторного тракта и некротизирующим васкулитом сосудов мелкого калибра. Распространенность патологии достигает 2,3 случая на 100 тыс. [3]. Микроскопический полиангиит – малоиммунный некротизирующий васкулит сосудов мелкого калибра. Чаще отмечаются признаки некротизирующего гломерулонефрита, реже – легочного капиллярита [4]. Эозинофильный гранулематоз с полиангиитом, или синдром Черджа – Стросса, – эозинофильное гранулематозное воспаление респираторного тракта с некротизирующим васкулитом. Последний часто сочетается с бронхиальной астмой, аллергическим ринитом и экстравазальными эозинофильными гранулемами [5]. Узелковый полиартериит представляет собой некротизирующий васкулит сосудов среднего калибра без гломерулонефрита. Однако при данной форме заболевания часто формируются микроаневризмы и тромбозы, что приводит к ишемии и инфаркту разных органов [6].
Некротизирующее воспаление сосудов мелкого и среднего калибра обусловливает тяжесть и полиорганность поражений при ПСВ.
В связи со сказанным представляется актуальным изучение особенностей клинического течения ПСВ для проведения ранней диагностики и своевременного назначения адекватной патогенетической терапии.
Цель нашего исследования – выявить особенности клинического течения, характер осложнений и причины летальности в первые три года от начала ПСВ.
Материал и методы
В исследование включено 232 пациента с первичными системными васкулитами. Больные находились на стационарном лечении в клинической ревматологической больнице № 25 г. Санкт-Петербурга с 2010 по 2018 г.
Критериями включения в исследование стали:
- дебют заболевания в возрасте более 18 лет;
- соответствие диагноза критериям Американской коллегии ревматологов (American College of Rheumatology – ACR) 1990 г.;
- морфологическое подтверждение диагноза в отсутствие АНЦА-позитивности;
- длительность заболевания на момент поступления больного в стационар менее одного года.
Основную группу составили 209 пациентов с системными васкулитами, ассоциированными с антинейтрофильными цитоплазматическими антителами (АНЦА-СВ). Она в свою очередь была разделена на три подгруппы: ГПА – 94 человек, МПА – 46, ЭГПА – 69 человек. В группу сравнения вошли 23 больных УП.
Среди участников исследования было 134 женщины.
Длительность заболевания на момент включения пациентов в исследование в среднем составляла 6,7 ± 1,3 месяца.
Оценивался характер поражений ЛОР-органов, легких, кожи, почек, центральной и периферической нервной системы, органов зрения, желудочно-кишечного тракта, опорно-двигательного аппарата, сердечно-сосудистой системы в течение первых трех лет заболевания.
Определялось влияние проводимой терапии на течение ПСВ и наиболее частые осложнения такого лечения.
Анализировались случаи летальных исходов.
Для обработки данных с помощью SPSS 22.0 использовались методы описательной статистики, однофакторный дисперсионный анализ с поправкой Бонферрони, t-критерий Стьюдента, U-критерий Манна – Уитни, χ2 с поправкой Йейтса, корреляционный анализ Пирсона.
Результаты
При изучении частоты и характера поражения органов и систем у больных ПСВ установлено, что в подгруппе ГПА превалировало поражение ЛОР-органов – 87% случаев. Доля синуситов составляла 57%, отитов – 39%, субглоточного стеноза гортани – 16%, язвенно-некротического ринита – 63%, в сочетании с деформацией носовой перегородки – 9%. Развитие гнойного отита, потребовавшее госпитализации в ЛОР-стационар, зафиксировано у 7% больных. При ЭГПА поражение ЛОР-органов отмечалось реже – в 50% случаев, при МПА и УП – почти не определялось.
Поражение сердечно-сосудистой системы (преимущественно в виде коронарита и перикардита) чаще наблюдалось при ЭГПА и МПА – 38 и 35% пациентов. При ГПА и УП таковое отмечалось в 21,0 и 27,5% случаев. Формирование венозных тромбозов выявлено у трех (7,1%) пациентов с МПА, у шести (9,2%) с ЭГПА, у двух (8,2%) с УП и у пяти (4,7%) больных ГПА.
Поражение центральной нервной системы в виде церебрального васкулита в основной группе отмечалось чаще, чем в группе сравнения. Так, оно диагностировано у 22% пациентов с МПА, у 17% – с ГПА, у 13% – с ЭГПА и только у 4% больных УП.
Аналогичная закономерность прослеживалась при оценке частоты развития инсультов (табл. 1).
Поражение периферической нервной системы в виде ишемической полинейропатии наиболее часто отмечалось в группе сравнения – 83% случаев. В основной группе ишемическая полинейропатия обнаружена у 65% пациентов с МПА и у такого же количества больных ЭГПА. При ГПА патология зафиксирована только в одной трети случаев.
В течение первых трех лет патология легких развилась практически у всех (99%) больных ЭГПА. Наиболее часто встречался синдром бронхиальной астмы – 97%, реже – мигрирующие эозинофильные инфильтраты – 64%. При ГПА легкие поражались достоверно чаще, чем при МПА – 84 против 59% случаев (p < 0,001). Необходимо отметить, что у больных ГПА преимущественно фиксировались инфильтраты с распадом легочной ткани (70%), у пациентов с МПА – проявления легочного капиллярита (50%).
При ГПА в отличие от трех других нозологий чаще фиксировались случаи кровохарканья, иногда с легочным кровотечением, – 28 и менее 4% случаев соответственно (p < 0,002). В одном случае легочное кровотечение, возникшее на фоне высокой активности ГПА и образования множественных инфильтратов с полостями распада, привело к летальному исходу.
Пурпуры и язвенно-некротические изменения кожи отмечались у 83% больных УП, что достоверно превышало частоту таковых в когорте пациентов с АНЦА-СВ – 56% (p < 0,01). В группе УП также чаще фиксировалась ишемическая гангрена дистальных фаланг пальцев – 35% против 1 и 2% случаев в подгруппах ГПА и МПА основной группы. Таким пациентам требовалось оперативное лечение. При этом достоверной корреляции между развитием ишемии конечностей и проводимой патогенетической терапией выявлено не было.
К характерным особенностям течения ГПА следует отнести поражение органов зрения – 36% больных. При этом 16% случаев приходилось на ретробульбарную гранулему, столько же – на конъюнктивит, 13% – на увеит, 11% случаев – на эписклерит. У семи (8%) пациентов с ГПА для верификации диагноза проводилась биопсия тканей орбиты. В таблице 2 приведены наиболее часто встречающиеся у пациентов с ГПА осложнения со стороны органов зрения.
Патология органов зрения у больных МПА, ЭГПА и УП диагностировалась значительно реже.
Поражение почек в виде малоиммунного гломерулонефрита с полулуниями обнаружено у 96% больных МПА и 78% больных ГПА. Быстропрогрессирующий гломерулонефрит в когорте пациентов с МПА отмечался достоверно чаще, чем в когорте больных ГПА – 48 против 19% случаев (p < 0,001). Значительно реже указанная патология фиксировалась при ЭГПА и УП – 38 и 26% пациентов. При ЭГПА и УП быстропрогрессирующий гломерулонефрит развивался в единичных случаях – менее 3%.
При МПА также чаще развивалась хроническая болезнь почек (ХБП) – 61% случаев. Этот показатель был достоверно выше показателя при ГПА и ЭГПА – 12 и 24% случаев (p < 0,01). Терминальная стадия ХБП, потребовавшая проведения гемодиализа, отмечалась у 15% больных МПА и 5% больных ГПА.
Изменения со стороны желудочно-кишечного тракта обнаружены у 21% пациентов основной группы и 4% пациентов группы сравнения (p < 0,001). Кроме того, у 5,6% больных АНЦА-СВ зафиксированы желудочно-кишечные кровотечения, потребовавшие экстренного перевода в хирургический стационар.
Поражение опорно-двигательного аппарата чаще встречалось при УП и МПА (83 и 80% соответственно), реже – при ГПА и ЭГПА (50 и 52% соответственно). Гнойный артрит осложнял течение заболевания у 2,3% больных основной группы. Асептический некроз головки бедренной кости сформировался у 5% больных УП, а также у 2% лиц с АНЦА-СВ. У 2% пациентов с ГПА развился остеомиелит.
Инфекционные осложнения, потребовавшие госпитализации пациентов, фиксировали при всех нозологиях: при МПА – в 23% случаев, при ГПА – в 19%, при УП – в 15%, при ЭГПА – в 13% случаев. Формирование сепсиса зафиксировано у трех пациентов с ГПА и одного больного МПА. Внегоспитальные пневмонии на фоне иммуносупрессивной терапии в первые три года болезни выявлялись при всех формах ПСВ. Частота случаев составляла 4,5%.
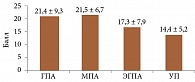
При оценке проводимой патогенетической терапии установлено, что период времени от дебюта заболевания до назначения глюкокортикостероидов (ГКС) был наибольшим в подгруппе ГПА – пять месяцев. В подгруппах МПА, ЭГПА и УП он составлял три – три с половиной месяца. Аналогичная тенденция прослеживалась и при назначении цитостатической терапии (рис. 1). Необходимо отметить, что в течение первого года заболевания цитостатическая терапия назначалась в 93% случаев при ГПА, в 85% – при МПА, в 47% – при ЭГПА и в 78% – при УП (табл. 3). Для индукции ремиссии чаще назначали циклофосфамид.
В одном случае при ГПА в качестве препарата первой линии использовали блокатор пролиферации В-клеток ритуксимаб. За время исследования терапию ритуксимабом получали 12 пациентов с ГПА и два больных МПА. Один пациент с ГПА применял белимумаб. Терапия внутривенными иммуноглобулинами была назначена восьми больным ГПА и одному пациенту с МПА.
При индукции ремиссии у 4% пациентов с ГПА развился геморрагический цистит как осложнение терапии циклофосфамидом.
При назначении патогенетической терапии у всех пациентов был рассчитан Бирмингемский индекс активности васкулита (Birmingham Vasculitis Activity Score – BVAS) (третья версия). Наиболее высоким он оказался в когорте больных ГПА и МПА. Различие показателей между подгруппами ГПА и МПА и подгруппой ЭГПА и группой УП было достоверным (p < 0,01) (рис. 2).
Рефрактерность к первоначально назначенной патогенетической терапии (отсутствие регресса клинических проявлений в течение шести недель) отмечалась у 39% больных УП, у 28 пациентов с ГПА, у 27% пациентов с МПА и 7% больных ЭГПА.
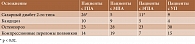
Такие осложнения, как стероидный диабет, остеопороз и компрессионные переломы позвонков, кандидоз, как правило, ассоциировались с длительным приемом высоких доз ГКС в связи с рефрактерным течением заболевания (табл. 4).
В первые три года от начала заболевания зафиксировано всего 11 (4,7%) летальных исходов: при ГПА – пять (5,3%), при МПА – четыре (8,7%), при ЭГПА – один (1,4%), при УП – один (4,3%). В двух (0,9%) случаях (один при ГПА и один при МПА) причиной смерти была полиорганная недостаточность, развившаяся вследствие высокой активности ПСВ после самостоятельной отмены патогенетической терапии. Инфекционные осложнения стали причиной летального исхода в трех (1,3%) случаях, тромбоэмболические (инсульт, инфаркт миокарда, тромбоэмболия легочной артерии) – в пяти (2,2%) (табл. 5).
Следует отметить, что на момент назначения патогенетической терапии группы с летальным исходом и без такового статистически значимо не различались по возрасту, полу, варианту цитостатической терапии, активности заболевания. В то же время через год от дебюта заболевания у первых достоверно чаще развивалась ХБП – 71 против 24% случаев (p < 0,005).
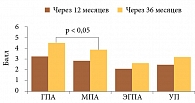
Индекс повреждения при васкулитах (Vasculitis Damage Index – VDI) определялся через 12 и 36 месяцев заболевания (рис. 3) [7]. Через 36 месяцев среднее значение VDI в подгруппе ГПА было наибольшим и достоверно превосходило средние значения в подгруппах МПА, ЭГПА и группе УП – 4,7, 3,8, 2,7 и 3,1 балла. Эти данные свидетельствуют о прогностически неблагоприятном течении ГПА и высоком риске инвалидизации.
Обсуждение результатов
Наиболее часто осложнения при ПСВ возникают в первый год заболевания в связи с поздним назначением патогенетической иммуносупрессивной терапии. Одна из основных причин несвоевременности получения лечения –трудность дифференциальной диагностики вследствие вариабельности дебюта и недостаточной информированности врачей первичного звена об особенностях течения ПСВ.
Для гранулематоза с полиангиитом характерно поражение зрительного нерва, развитие легочного кровотечения, гнойного отита и стероидного диабета. При этом осложнения связаны как с поздним назначением патогенетической терапии, так и с активно проводимой иммуносупрессивной терапией. Несвоевременное применение цитостатиков приводит не только к более быстрому прогрессированию воспалительного процесса, но и к более длительному приему высоких доз ГКС. Как следствие, увеличивается риск развития инфекций, стероидного диабета и компрессионных переломов на фоне стероидного остеопороза.
Известно, что легочные кровотечения – самая частая причина острой летальности в дебюте системных некротизирующих васкулитов. Данное осложнение часто встречалось при ГПА и значительно реже при МПА. Анализ зарубежной литературы свидетельствует, что пятилетняя выживаемость при ГПА составляет 61–75%, при МПА – 45–75%, при УП – 60–80%, при ЭГПА – 68–100%. Предикторами высокой летальности являются пожилой возраст, ХБП и максимально высокий уровень креатинина уже в первые месяцы болезни [8, 9]. Результаты нашего исследования подтверждают эти данные.
Клиническое течение МПА определялось поражением почек с частым формированием ХБП, нередко с исходом в терминальную стадию.
Среди тромбоэмболических осложнений необходимо отметить высокую частоту ишемических инсультов при МПА и инфаркта миокарда при УП. Поэтому в дебюте заболевания таким пациентам требуется агрессивное вмешательство с применением высокодозных схем пульс-терапии ГКС и цитостатиками.
В настоящее время при высокой активности и полиорганности поражения в дебюте ГПА и МПА показаны блокаторы пролиферации В-клеток, в частности ритуксимаб.
В нашем исследовании такую терапию получали 14 пациентов, что позволило существенно снизить активность и повреждения васкулита через 36 месяцев.
Высокая частота ишемического повреждения конечностей при УП требует проведения более агрессивной патогенетической терапии, обязательного использования антитромботических препаратов, особенно при появлении первых признаков заболевания.
Заключение
В настоящее время перед клиницистами стоит непростая задача – в максимально ранние сроки уточнять диагноз и начинать активную иммуносупрессивную терапию. При выборе базисных препаратов следует учитывать варианты дебюта ПСВ, превалирующее поражение тех или иных органов, а также сопутствующую патологию.
К факторам риска развития значимых осложнений относятся длительный прием высоких доз ГКС, позднее назначение цитостатиков, ХБП. Поэтому в максимально ранние сроки после уточнения диагноза необходимо начать индукционную терапию.
Причинами летальности в первые годы болезни являются полиорганная недостаточность, инфекционные и тромбоэмболические осложнения. Мониторинг и их профилактика являются неотъемлемой задачей курирования таких пациентов.
Ранняя диагностика и активная стратегия лечения позволят минимизировать риск развития осложнений и смерти, а также сохранить высокое качество жизни больных.
A.L. Chudinov, I.B. Belyayeva, DM, Prof., V.I. Mazurov, DM, Prof., O.V. Inamova, PhD
Clinical Rheumatological Hospital № 25, Saint-Petersburg
I.I. Mechnikov North-Western State Medical University
Contact person: Anton Leonidovich Chudinov, anton-chudinov@mail.ru
The article analyzes the features of the course, as well as the main complications of ANCA-associated systemic vasculitis (granulomatosis with polyangiitis, microscopic polyangiitis, eosinophilic granulomatosis with polyangiitis) and polyarteritis nodosa in the first three years from the onset of the disease. Demonstrated the relationship between the development of complications and long-term glucocorticosteroid therapy. Shown the importance of studying the features of organ and system damage in systemic vasculitis to improve the algorithm of diagnosis and treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.