Основные теоретические и практические аспекты нейрореабилитации
- Аннотация
- Статья
- Ссылки
- English




Предпосылки эффективной реабилитации
Цель нейрореабилитации – создание оптимальных условий для активного участия пациента в жизни общества, социально-бытовая адаптация и в конечном итоге улучшение качества жизни как самого больного, так и его родственников. Среди основных задач нейрореабилитации – восстановление жизненных функций человека с помощью физических и психических методов, медикаментозной терапии и выработка системы адаптации при необратимых изменениях, вызванных патологическим процессом.
В процессе восстановления пациента важно учитывать теоретические представления об организации физиологических и патологических движений, формировании кратко- и долговременных компенсаторных процессов поврежденных структур и нарушенных функций, функциональных системах организма. Кроме того, необходимо помнить о влиянии сенсорных и речевых воздействий на эффективность физических методов реабилитации.
На выработку компенсаторных механизмов большое влияние оказывает сигнализация из внешней и внутренней сред организма – так называемая обратная связь [1]. Надежность функционирования головного мозга обеспечивается динамичной межнейрональной деятельностью, которая приводит к морфологически избыточной связи. Реабилитация пациентов, перенесших инвалидизирующие неврологические заболевания, основывается также на системной организации мозговых функций, которая указывает на резервные возможности головного мозга при реорганизации его структур в условиях патологического процесса. Данная реорганизация вызывает двигательное переобучение пациента, что приводит либо к восстановлению, либо к компенсации нарушенных функций.
При проведении нейрореабилитации следует стремиться к истинному восстановлению функций, когда функции полностью возвращаются или максимально приближаются к исходному состоянию. Основной механизм, обеспечивающий истинное восстановление функций, – растормаживание инактивированных нервных элементов с помощью методических приемов, направленных на их стимуляцию.
В случае значительных деструктивных повреждений головного мозга восстановление функций происходит благодаря компенсации за счет сохранных функциональных систем. Данный процесс обеспечивается пластичностью нервных центров и многосторонними анатомическими связями между различными отделами нервной системы. Пластичность мозга заключается в способности нервной ткани менять как структурную, так и функциональную организацию под влиянием внешних и внутренних факторов и связана с рядом механизмов [2–4]:
- функционированием ранее неактивных связей;
- спраутингом волокон сохранившихся нейронов (возобновлением роста пораженного аксона, изменением ветвистости волокон, площади и плотности шипиков дендритов);
- формированием новых синапсов;
- синаптическим ремоделированием (изменением конфигурации и свойств синапсов);
- реорганизацией нейрональных цепей (формированием многих цепей, обеспечивающих близкие функции);
- обеспечением внесинаптической нейрональной передачи возбуждения;
- изменением астроглии (изменением структуры астроцитов, увеличением числа контактов синапсов и астроцитов).
Осуществляя медицинскую и социальную реабилитацию, необходимо помнить, что тяжелые неврологические заболевания не только оказывают кратковременное влияние на соматоневрологический статус пациента, но и вызывают длительную инвалидизацию и социальную дезадаптацию.
Медицинская реабилитация реализуется в рамках трех этапов в зависимости от состояния пациента [5]. Первый этап реабилитации при отсутствии противопоказаний проводится в течение острого периода заболевания в отделениях реанимации и интенсивной терапии. Второй этап реабилитации – в течение раннего восстановительного периода, позднего восстановительного периода, периода остаточных явлений заболевания в условиях стационарной реабилитации. Третий этап реабилитации – в течение раннего восстановительного периода, позднего восстановительного периода, периода остаточных явлений заболевания в амбулаторных условиях, а также на дому.
Особенности нарушения функционирования неврологических систем при органических заболеваниях головного мозга
Для организации и проведения адекватной и эффективной реабилитации необходимо учитывать особенности нарушения функционирования неврологических систем при различных органических заболеваниях головного мозга.
Нарушения функционирования двигательной системы
Восстановление двигательных функций у пациента с гемиплегией аналогично развитию младенца, и поэтому последовательность восстановления способности контролировать статику и динамику тела у пациента после, например, сосудистого поражения головного мозга соответствует последовательности стадий развития и роста ребенка. Сначала появляется контроль за движениями головы вслед за переворачиванием, затем – сохранность равновесия в положении сидя и стоя, следом – вертикализация и, наконец, хождение с постепенным повышением степени устойчивости и увеличением скорости перемещения.
Для оценки состояния двигательных функций пациента, прогнозирования результатов реабилитации, а также постановки целей реабилитации необходимо понять, на какой «ступени развития» находится пациент [6]. Поэтому при осмотре следует уделить внимание тому, как пациент контролирует движения, устойчивость туловища и походку. Кроме того, необходимо оценить слабость отдельных мышечных групп и мышц, например, с помощью шкалы Комитета медицинских исследований, а также общую выраженность гемипареза, используя модифицированный Индекс произвольных движений [6].
Нередко для специалистов более значимую проблему представляют пациенты не с выраженным гемипарезом или даже гемиплегией, а с минимальными двигательными нарушениями и прежде всего с так называемой кортикальной рукой. Порой синдром «кортикальной руки» расценивают как поражение периферических нервов, но более тщательный анализ свидетельствует о возникновении данного синдрома вследствие очагового поражения головного мозга, например инсульта.
Ограниченный двигательный дефект, нормальный мышечный тонус, отсутствие анизорефлексии и патологических симптомов еще более дезориентируют специалистов, и они не верифицируют диагноз очагового поражения головного мозга. Кроме того, пациент может не предъявлять субъективные жалобы на слабость в конечностях. В данном случае наиболее чувствительными пробами для оценки состояния кортикоспинальных путей будет выявление тонких движений пальцев верхней конечности или быстрых движений кисти. Положительный результат этих проб соответствует таким двигательно-функциональным проблемам пациентов с отсутствием жалоб на слабость мышц, как трудности при письме. При этом больные описывают данное состояние не как слабость, а как неловкость/неуклюжесть.
Нередко для диагностики синдрома «кортикальной руки» используют различные пробы и тесты, которые позволяют установить легкий двигательный дефект в руке при поднятии и удерживании обеих верхних конечностей (верхняя проба Барре, тест позы Будды, симптом Мингаццини). Опускание одной из рук при закрытых глазах – достоверный показатель легкого двигательного дефицита, а данные методики расцениваются как чувствительные скрининговые тесты для оценки двигательных функций. Однако положительный результат не всегда вызван нарушением функционирования двигательной системы, иногда он может быть обусловлен:
- снижением глубокой чувствительности, вследствие чего пальцы пытаются двигаться самостоятельно (симптом игры на фортепьяно, псевдоатетоз);
- невниманием, приводящим к высокоамплитудным движениям, в том числе и вверх;
- мозжечковой дисфункции, при которой также возможны высокоамплитудные движения.
Важно! Двигательные нарушения, которые наблюдаются у больного в постели, могут не совпадать с двигательными нарушениями, проявляющимися при вертикализации и ходьбе.
В то время как существенные двигательные нарушения, диагностированные у пациента в постели, могут быть следствием невнимания, а не слабости, отсутствие признаков мышечной слабости в кровати не исключает тяжелые атактические нарушения, приводящие к трудностям при ходьбе или ее полной невозможности.
В некоторых случаях при осмотре пациентов в кровати выявляется, на первый взгляд, гемиплегия. Однако позже выясняется, что и верхняя, и нижняя конечности способны к самостоятельному перемещению в вертикальном положении. Данное парадоксальное состояние встречается при капсулярном «предупредительном» синдроме или повторных транзиторных ишемических атаках вследствие поражений мелких артерий и артериол головного мозга [6, 7]. Подобные нарушения могут быть вызваны гемодинамически значимыми стенозами внутренней сонной артерии [6]. Причиной капсулярного синдрома также могут быть синдром невнимания и/или апраксия, что необходимо учитывать при определении реабилитационного потенциала и прогнозировании функционального исхода заболевания. Так, у пациентов с обширной зоной поражения в субдоминантном полушарии выраженный гемипарез или гемиплегия достаточно быстро регрессируют по мере разрешения синдрома невнимания [8].
Расстройства движений после перенесенного очагового поражения головного мозга нередко вызваны повышенным мышечным тонусом, который приводит к трудностям в выполнении простых движений, снижению уровня бытовой адаптации и соответственно качества жизни.
Мышечная спастичность, например после инсульта, распределяется неравномерно, что проявляется достаточно типичной для постинсультных двигательных нарушений позой Вернике – Манна. При этом спастичность больше выражена в аддукторах плеча, сгибателях руки и пронаторах предплечья (рука приведена к туловищу, предплечье согнуто в локтевом суставе и пронировано, кисть и пальцы согнуты) и разгибателях нижней конечности (бедро разогнуто и приведено, голень разогнута, стопа ротирована кнутри, наблюдается ее подошвенное сгибание). Кроме того, могут быть и другие типы распределения повышенного мышечного тонуса у пациентов с очаговым поражением головного мозга:
- выраженная гиперпронация предплечья и разгибание пальцев кисти;
- гиперсупинация предплечья и разгибание кисти;
- причудливые установки кисти и пальцев;
- повышение мышечного тонуса в сгибателях нижней конечности.
Нарушения функционирования системы чувствительности
Нарушения чувствительности при очаговых поражениях головного мозга представляют собой существенную и порой трудноразрешимую проблему. Так, более чем у 50% пациентов после инсульта нарушается функционирование системы чувствительности. Однако у половины из них адекватно оценить чувствительность и ее изменения не представляется возможным вследствие спутанности сознания или коммуникативных проблем. В то же время грубые нарушения чувствительности, особенно расстройство глубокой чувствительности, могут привести к выраженной инвалидизации, не меньшей, чем вследствие глубоких парезов. Значительно ухудшить психоэмоциональное состояние пациентов могут такие субъективные неприятные ощущения, как онемение и покалывание лица и кистей. В этой связи важно обращать внимание на сенсорные жалобы пациентов, даже если при осмотре чувствительный дефект якобы отсутствует.
При осмотре пациента с органическим поражением головного мозга на предмет установления чувствительных нарушений специалист нередко встречается с рядом трудностей (сонливостью, нарушением речи, когнитивными расстройствами, деменцией, зрительно-пространственными нарушениями), которые мешают точной диагностике. На достоверность результатов осмотра также может влиять сенсорное угасание как проявление зрительно-пространственных нарушений. При сенсорном угасании пациент теряет способность воспринимать тактильное раздражение на одной стороне тела при одновременном тактильном стимулировании обеих сторон, но воспринимает данное раздражение в случае последовательных тактильных стимулов.
Специалисты нередко сталкиваются с достаточно ограниченными нарушениями чувствительности в необычных сочетаниях, прежде всего с хейро-оральным синдромом (табл. 1) [6].
Нарушения высших мозговых функций
Обнаружение тех или иных нарушений высших мозговых функций достаточно важная, но в то же время сложная задача.
Внимание. Недостаток внимания ведет к нарушению концентрации и появлению рассеянности, что может негативно сказаться на результатах реабилитации. Оценка состояния внимания и концентрации должна проводиться у постели больного и базироваться, по крайней мере, на четырех тестах и заданиях:
- ориентация в себе, пространстве и времени;
- перечисление названий пальцев с первого до пятого и затем с пятого до первого;
- перечисление дней недели и месяцев года в обратном порядке;
- осуществление серии вычитаний числа «7».
Память. Нередко у пациентов с органическим поражением головного мозга достаточно трудно установить точную причину расстройства памяти, поскольку встречающееся на фоне поражения мозга нарушение концентрации внимания снижает способность усвоения новой информации. Кроме того, когнитивные дисфункции отмечаются у многих пациентов и до развития заболевания.
Для оценки состояния памяти пациента можно провести краткое исследование [9]:
- ориентация пациента в собственной личности, пространстве и времени;
- перечисление месяцев года в прямом и обратном порядке;
- перечисление дней недели в прямом и обратном порядке;
- называние пальцев руки;
- осуществление элементарных математических действий.
Речь. Нарушение речи у пациентов с поражением головного мозга проявляются в виде афазии или дизартрии [6]. Чаще всего афазия сочетается с аграфией и алексией. В то же время устная и письменная речь – важные речевые функции, они должны рассматриваться и оцениваться отдельно. При поражении субдоминантного полушария головного мозга возможно развитие апросодии, которая характеризуется потерей способности правильно использовать ударения, колебания тона, интонации и эмоциональные жесты.
Следует проводить дифференциальную диагностику афазии/дисфазии и анартрии/дизартрии. В первые дни после перенесенного очагового поражения головного мозга, например инсульта, нередко может наблюдаться абсолютное отсутствие экспрессивной речи, что происходит чаще всего вследствие грубой афазии. Иногда причиной полного отсутствия экспрессивной речи выступает анартрия как следствие двустороннего поражения ствола головного мозга. В большинстве случаев наблюдается смешанная афазия, то есть сочетание экспрессивной и рецептивной афазии, когда нарушается и продукция, и понимание речи.
Важно! Ряд пациентов страдают так называемым интактным повторением, которое возникает при нарушении кровообращения либо в бассейне передней мозговой артерии (транскортикальная моторная афазия), либо в бассейне задней мозговой артерии (транскортикальная сенсорная афазия). Поэтому, оценивая экспрессивность и импрессивность речи, нельзя ограничиваться вопросами, требующими однозначных утвердительных или отрицательных ответов, и простыми так называемыми социальными диалогами.
При реабилитации пациентов, особенно после инсульта, специалисты встречаются с трудностями при таких видах афазии, как акустико-мнестическая, семантическая, амнестическая.
Синдром игнорирования (неглекта) и сопряженные состояния
При проведении реабилитации важно выявлять у пациентов синдром игнорирования (неглекта) – потерю способности реагировать на внешнее воздействие или воспринимать информацию стороной, противоположной пораженному полушарию головного мозга. По разным данным, синдром отмечается у 33–85% больных с правополушарным инсультом [6] и у 24% – с левополушарным [10]. Синдром неглекта в значительной мере снижает эффективность реабилитации [6, 11] и является одним из основных признаков неблагоприятного прогноза восстановительного лечения [12, 13]. Таких больных необходимо наблюдать с соблюдением специальных правил и принципов.
Признаки синдрома неглекта:
- геми-невнимание (отсутствие адекватного ответа на окружающие пациента раздражающие стимулы: приближение людей, различные звуки);
- тактильное угасание (утрата способности реагировать на тактильные стимулы при одновременном тактильном стимулировании обеих сторон);
- зрительное угасание (утрата способности реагировать на зрительные стимулы при одновременном стимулировании обоих полей зрения);
- аллоэстезия (ощущение сенсорных стимулов на стороне, противоположной стимуляции);
- анозогнозия (отрицание нарушений неврологических функций);
- отрицание принадлежности конечностей одной стороны своему телу.
Одно из ярких проявлений синдрома неглекта – синдром Риддоха [13]. Это расстройство оптического восприятия в гомонимных половинах полей зрения при сохранности стереоскопического зрения. Пациент не замечает человека, стоящего у кровати на стороне, противоположной очагу поражения головного мозга, игнорирует слова на левой половине страницы. В выраженных случаях пациенты бреют лишь одну половину лица, не надевают рукав куртки/рубашки на вторую руку. При этом оптический дефект самим пациентом, как правило, не осознается, а при исследовании полей зрения дефект может не обнаруживаться.
Важно! Установление феномена игнорирования левой половины пространства имеет такое же значение в диагностике поражений правого полушария, как и выявление афазии в диагностике поражений левого полушария.
Для диагностики визуального игнорирования можно использовать тест Альберта, который позволяет выявить и количественно оценить пространственное (визуальное) игнорирование [14]. Пациенту предлагают набор отрезков разнонаправленной ориентации, сгруппированных в семь столбцов, и просят перечеркнуть все отрезки. Пропущенные отрезки свидетельствуют о визуальном игнорировании. При этом процент пропущенных отрезков коррелирует со степенью восстановления когнитивных функций через шесть месяцев после проведения исследования.
Мультидисциплинарный принцип ведения пациентов
Одно из важнейших условий эффективной реабилитации – соблюдение мультидисциплинарного принципа ее проведения. Для реализации данного принципа необходимо наличие мультидисциплинарных бригад (МДБ) на этапах стационарной, амбулаторной и домашней реабилитации.
В МДБ входят различные специалисты, которые функционируют не по отдельности, а как единая команда с четкой согласованностью и координированностью действий, что обеспечивает проблемный и целенаправленный подход к проведению реабилитации пациентов. Основные специалисты МДБ – врач, медицинская сестра, врач и инструктор лечебной физической культуры, эрготерапевт, логопед (табл. 2) [15, 16]. Необходимо отметить жизненно важную и уникальную роль медицинской сестры МДБ. Медицинская сестра МДБ прежде всего клинический специалист. Она находится с пациентом 24 часа в сутки, в связи с чем может проинформировать о состоянии пациента остальных членов МДБ, которые общаются с пациентом в течение незначительного периода времени и в основном днем. Одна из основных функций медицинской сестры МДБ – координация процесса реабилитации от поступления пациента до его выписки. Кроме того, в состав МДБ целесообразно включать психолога, нейропсихолога, мануального терапевта, ортопеда-подотерапевта, ассистента среднего медицинского персонала и ассистента – методиста лечебной физической культуры, диетолога, координатора досуга и социального работника.
Преимущества ведения пациента с помощью МДБ [15]:
- более активное участие каждого специалиста – члена МДБ;
- возможность всех членов МДБ участвовать в планировании и проведении реабилитации;
- большая профессиональная заинтересованность в деятельности медицинских сестер;
- оптимальные условия для повышения квалификации специалистов – членов МДБ;
- экономия рабочего времени;
- нормализация психоэмоционального состояния пациента и его родственников;
- повышение мотивации пациента к реабилитации;
- вовлечение в процесс реабилитации самого пациента и его родственников.
Основные направления деятельности МДБ:
- осмотр пациента, оценка его состояния и степени нарушения функций с участием всех специалистов МДБ и заполнением специальных оценочных карт [11, 17, 18];
- совместная постановка целей лечения [15];
- совместное создание адекватной окружающей среды для пациента в зависимости от его потребностей;
- совместное обсуждение особенностей ведения пациента;
- совместное планирование выписки:
- заблаговременное планирование выписки;
- определение условий дальнейшего лечения, которые позволят добиться наибольшей самостоятельности пациента в повседневной жизни (реабилитация в стационарных, амбулаторных, домашних, санаторно-курортных условиях);
- оценка способности родственников научиться приемам ухода за пациентом и помощи ему, обучение их этим навыкам;
- составление совместно с пациентом и его родственниками плана дальнейшего наиболее рационального ведения пациента;
- оценка эффективности проводимого вмешательства.
Для обеспечения согласованности действий всех членов МДБ необходимо проводить собрания МДБ для совместной выработки стратегии и тактики лечения. На таких собраниях происходит знакомство всех членов МДБ с новыми пациентами, членам бригад сообщается о положительных или отрицательных изменениях в состоянии пациентов, обозначаются реальные цели лечения и согласовываются соответствующие действия для их достижения, составляется план выписки. Ниже приведена примерная схема проведения собраний МДБ [15].
Первое собрание.
- Представление врачом медицинских деталей в отношении нового пациента: жалобы, анамнез, факторы риска и предполагаемые причины перенесенного заболевания, а также факторы риска ухудшения состояния вследствие сопутствующих заболеваний.
- Сообщение врача и других членов МДБ о социальном статусе пациента: место и условия проживания, состав семьи, материальные условия и окружение (ухаживающие лица).
- Обсуждение неврологического статуса больного, в котором активное участие принимают врач, инструктор лечебной физической культуры, логопед.
- Сообщение медицинских сестер о функциональных возможностях пациента на настоящий момент.
- Составление списка приоритетных проблем пациента.
- Постановка краткосрочных целей лечения.
- Составление плана реабилитационных действий и вмешательств.
Последующие собрания.
- Обобщение проблем пациента, целей лечения и совместных действий по ведению больного.
- Выступление каждого члена МДБ о динамике в состоянии пациента, решенных проблемах и достигнутых целях, новых поставленных целях и способах их достижения. Необходима краткая, но четкая формулировка проблем пациента, важно отказаться от слишком пространных и общих формулировок. Данную информацию целесообразно подавать в определенном порядке: нарушение структуры и/или функции, ограничение активности и участия в бытовой и общественно-социальной жизни.
- Обсуждение более отдаленных целей: время визита домой, выписки и встречи с родственниками.
Деятельность МДБ отличает мультидисциплинарное целевое планирование, которое основывается на эффективной оценке потребностей пациентов и составлении программ для их реализации, обеспечивает координацию усилий членов МДБ и направлено на повышение роли самого пациента в программе лечения, а также своевременное поступление пациента на лечение ко всем необходимым специалистам.
Для целевого планирования реабилитационного лечения необходимо вовлечь в процесс пациента и его родственников. Определяются проблемы, потребности, надежды пациента, устанавливаются его физические, психоэмоциональные и социальные ресурсы. Для этого используются оценочные и измерительные шкалы, тесты, формы и опросники, оценка состояния пациента проводится всеми специалистами МДБ (табл. 3) [10, 16, 18–35].
Реабилитационные цели отличаются следующими параметрами и характеристиками:
- согласованностью (постановка целей лечения совместно всеми специалистами МДБ);
- специфичностью (учитываются прежде всего приоритеты и пожелания пациента и его родственников);
- реалистичностью (учитываются функциональное состояние и ресурсы пациента во избежание амбициозности целей, поскольку невозможность их достижения окажет негативное влияние на состояние как самого пациента, так и специалистов);
- измеряемостью (возможность для специалистов точно сказать, достигнуты цели или нет);
- временной определенностью (устанавливается промежуток времени, в течение которого цель будет достигнута) [15].
Так, долгосрочные цели определяют, что пациент будет в состоянии делать после выписки или через определенный промежуток времени (через несколько недель или месяцев). Эти цели задают направление деятельности, на котором фокусируются усилия всех членов МДБ, и отражают следующие вопросы:
- где пациент будет находиться;
- что пациент будет способен делать;
- будет ли пациент нуждаться в помощи.
При разделении долгосрочных целей на этапы можно выделить краткосрочные цели, достижимые для как самого пациента, так и для членов МДБ в течение дней – недель.
Медикаментозная реабилитация
Восстановление двигательных, чувствительных, когнитивных функций, уровень социально-бытовой адаптации, купирование болевых синдромов у пациентов после инсульта, а также качество их жизни в существенной степени зависят от своевременного и адекватного применения методов физической и нейропсихологической реабилитации, осуществления правильного ухода, соблюдения мультидисциплинарного принципа ведения данной категории пациентов. Однако, согласно результатам различных исследований, существенную роль в комплексной реабилитации и повышении ее эффективности играет медикаментозная терапия [2, 36–40].
Главное условие, которому должны соответствовать препараты, используемые в реабилитации пациентов с неврологическими заболеваниями, – благоприятное воздействие на процессы нейропластичности тканей головного мозга. Кроме того, к перспективным направлениям медикаментозной реабилитации также относят использование предшественников компонентов клеточных мембран с нейромедиаторными, нейротрансмиттерными и нейрорецепторными свойствами и препараты, восстанавливающие синаптические передачи.
Одним из лекарственных средств, которое в полной мере отвечает представленным требованиям, является препарат Целлекс. В его состав входят ряд сигнальных белков и пептидов – факторы роста и дифференцировки нервных клеток, а также сигнальные молекулы клеточных ядер, цитоплазмы и межклеточного матрикса с молекулярной массой от 10 до 250 кДа.
Основные клинические эффекты Целлекса связывают с существенным уменьшением или полным устранением последствий перенесенного повреждения мозгового вещества, обусловленного, в частности, ишемией, посредством нормализации кровоснабжения и белкового синтеза, восстановления баланса нейротрансмиттеров и нейромедиаторов, а также активации процессов нейрорегенерации и нейрорепарации.
Целлекс обладает прямым нейрорепаративным действием, что обусловлено входящими в его состав тканеспецифическими сигнальными белками и полипептидами – факторами роста и дифференцировки нервных клеток и сосудов.
В экспериментальных условиях было показано, что нейропротективное действие Целлекса связано с наличием в его составе сигнальных молекул. Это ведет к конкурентному ингибированию сигналов к апоптозу, которое обеспечивает сохранение нейронов в зоне пенумбры, торможению местной воспалительной реакции и уменьшению отека, а также восстановлению локального кровотока ишемизированной зоны с ее реперфузией, превосходящей уровень до ишемии.
Отмечено тканеспецифическое и системное репаративное действие препарата с восстановлением регенеративного и репаративного потенциала клеток мозга [41], активизацией процессов нейропластичности и синаптогенеза сохраненных нейронов, что крайне важно для проведения результативной и эффективной реабилитации.
Первичное нейропротективное действие Целлекса способствует уменьшению очага некроза мозговой ткани за счет прерывания процесса апоптоза в зоне пенумбры [42]. Кроме того, на фоне терапии Целлексом наблюдается уменьшение выраженности перифокального отека в зоне пенумбры [43].
Для изучения влияния нейроцитопротективной терапии на повышение эффективности комплексной реабилитации пациентов после инсульта нами было проведено исследование.
Цель и задача исследования
Цель исследования – повысить эффективность реабилитации постинсультных пациентов. Задача исследования – проанализировать эффективность препарата Целлекс у пациентов, перенесших инсульт, по таким критериям, как степень восстановления неврологических функций, уровень социально-бытовой адаптации, психоэмоциональное состояние.
Материал и методы
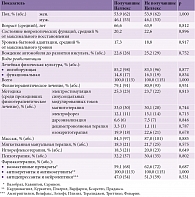
Анализу были подвергнуты результаты лечения 230 пациентов (124 женщин и 106 мужчин), перенесших ишемический инсульт. Возраст пациентов от 32 до 82 лет, средний возраст – 65,3 года.
Пациенты были разделены на две группы по 115 человек в каждой. Группы были стандартизированы по различным показателям: возрасту, полу, степени выраженности неврологических и психоэмоциональных нарушений, уровню бытовой адаптации, а также проводимым видам и методам физической, физиотерапевтической, нейропсихологической и психотерапевтической реабилитации (принцип matched-controlled) (табл. 4). Одна группа получала препарат Целлекс, вторая – нет. Целлекс назначался в течение первых шести месяцев инсульта и вводился подкожно по 0,1 мг (1 мл) один раз в сутки в течение десяти дней. Через месяц после окончания первого проводился повторный аналогичный курс.
При анализе результатов лечения учитывались следующие параметры: восстановление неврологических функций, уровень социально-бытовой адаптации, психоэмоциональное состояние.
Нарушение и степень восстановления неврологических функций определялись с помощью индекса Бартел [44], шкалы Линдмарка [45] и Скандинавской шкалы [46]. По индексу Бартел оценивались двигательные функции и бытовая адаптация, по шкале Линдмарка – функции движения и чувствительности, по Скандинавской шкале – двигательные, речевые функции, ориентация во времени, пространстве и собственной личности. Вычислялась средняя арифметическая сумма баллов, набранная по трем перечисленным шкалам. Значение менее 30% баллов от максимального количества расценивалось как отсутствие восстановления, 30–49% – минимальное восстановление, 50–74% – удовлетворительное, 75–94% – достаточное, более 94% – полное восстановление.
Уровень бытовой и социальной адаптации определялся по шкале самооценки бытовых возможностей повседневной жизни Мертон и Саттон [27]: отсутствие бытовой адаптации – 0 баллов, минимальная адаптация – 1–29 баллов, удовлетворительная – 30–45 баллов, достаточная – 46–58 баллов, полная – 59 баллов. Кроме того, оценивалась способность к независимому выполнению отдельных бытовых навыков (использование туалета, умывание, принятие ванны, одевание, прием и приготовление пищи, вождение автомобиля, сексуальная активность).
Психоэмоциональное состояние оценивалось с помощью опросника Бека [33] и шкалы самооценки депрессии Уэйкфилда [47], на основании которых в процентном отношении устанавливалось среднее значение распространенности депрессии в каждой группе пациентов. При наличии депрессии с помощью опросника Бека также определялась степень ее выраженности.
Критерии включения пациентов в настоящее исследование:
- диагноз – инфаркт головного мозга, подтвержденный при проведении компьютерной или магнитно-резонансной томографии;
- степень нарушения неврологических функций (количество баллов по индексу Бартел, шкале Линдмарка и Скандинавской шкале – не более 24% от максимального количества);
- степень социально-бытовой дизадаптации:
- количество баллов по шкале Мертон и Саттон – не более 24% от максимального количества баллов;
- зависимость при выполнении и/или невозможность осуществления основных социально-бытовых навыков;
- психоэмоциональное состояние (депрессия любой степени выраженности, выявленная с помощью опросника Бека и шкалы Уэйкфилда).
Статистический анализ результатов исследования проводился с помощью пакетов программы SPSS 16.0. Для сравнения качественных признаков и процентных соотношений применялись критерий независимости качественных (категориальных) признаков χ², точный критерий Фишера и коэффициент неопределенности. Наличие зависимости между изучаемыми признаками признавалось, когда доверительный уровень составлял р < 0,05. При частоте изучаемого события менее пяти наблюдений в одной из ячеек таблицы использование критерия χ2 рассматривалось как некорректное, применялся точный критерий Фишера.
Результаты и их обсуждение
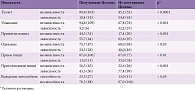
Согласно результатам исследования, применение Целлекса повышало эффективность реабилитации пациентов после инсульта (полученные результаты статистически значимы). Так, в группе пациентов, которым назначался Целлекс, достаточная и полная степень восстановления неврологических функций отмечалась у 68,7% больных, а в группе сравнения – только у 31,3% (р < 0,001) (табл. 5). У пациентов, принимавших Целлекс, уровень бытовой адаптации был достоверно выше, чем у пациентов в группе сравнения – 66,1 и 30,4% соответственно (р < 0,001).
Целлекс оказывал статистически значимое положительное влияние на достижение пациентами независимости при выполнении основных бытовых навыков (табл. 6). Так, 89,6% больных, которые получали Целлекс, приобрели независимость при использовании туалета (45,2% в группе сравнения, p < 0,0001), 94,8% – при умывании (67,8% в группе сравнения, p < 0,001), 87,0% – при приеме пищи (67,0% в группе сравнения, р < 0,01), 75,7% – при одевании (60,0% в группе сравнения, р < 0,05). Кроме того, 44,3% больных, которые принимали Целлекс, смогли самостоятельно принимать ванну (в группе контроля только 17,4%), 56,5% – готовить пищу (22,6% в группе сравнения), 23,5% – управлять автомобилем (13,0% в группе сравнения).
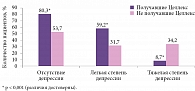
Нормализация психоэмоционального состояния также в существенной степени зависела от использования Целлекса. Так, после курса реабилитационного лечения психоэмоциональное состояние нормализовалось у 80,3% пациентов, перенесших инсульт и принимавших Целлекс, и только у 53,7% в контрольной группе (рисунок). Депрессия в группе пациентов, которым назначался Целлекс, была легкой степени (59,2%), а в группе больных, не получавших Целлекс, наоборот – тяжелой (34,2%). Таким образом, применение Целлекса статистически значимо способствовало улучшению психоэмоционального состояния (р < 0,001), что в свою очередь повысило эффективность комплексной реабилитации пациентов, перенесших инсульт.
Результаты проведенного исследования демонстрируют эффективность применения препарата Целлекс в постинсультном периоде. Использование препарата в рамках комплексной реабилитации статистически значимо повышало показатели восстановления неврологических функций, уровень социально-бытовой адаптации, а также приводило к нормализации психоэмоционального состояния пациентов. Полученные результаты согласуются с данными других авторов о том, что Целлекс повышает эффективность лечения пациентов после инсульта [42, 43, 48].
Учитывая большое разнообразие лекарственных препаратов, предлагаемых для реабилитации пациентов, перенесших инсульт, и отсутствие единодушного мнения исследователей в отношении их эффективности, можно отметить, что дальнейшие исследования в данной области представляются достаточно интересными и чрезвычайно полезными.
Заключение
Говоря об основах реабилитации в ангионеврологии, необходимо резюмировать, что это многогранный комплексный целенаправленный и проблемно-ориентированный процесс. Мультидисциплинарный подход к ведению пациентов после инсульта позволяет решить главную задачу реабилитации – повысить степень восстановления неврологических функций пациентов, уровень их социально-бытовой адаптации и в итоге улучшить качество жизни пациентов и их родственников.
V.V. Kovalchuk
City Hospital No 38 named after N.A. Semashko, Saint Petersburg
Contact person: Vitaly Vladimirovich Kovalchuk, vikoval67@mail.ru
The article discusses the basic principles of organization and conduct of rehabilitation of patients suffered from disabiling neurological diseases. Provides theoretical and practical aspects as well as preconditions for effective rehabilitation, particularly with regard to the functioning of the neurological system in focal brain lesions, which analysis is necessary for the general organization of the rehabilitation process and the conduct of certain types and methods of rehabilitation. Provided principles and features of the multidisciplinary team activity, providing adequate management of patients who have suffered organic brain damage. The results from efficacy studies with drug Cellex in 230 post-ischemic stroke patients are presented demonstrating that Cellex significantly increased recovery level of neurological functions, social adaptation and normalized psychoemotional state in post-stroke patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.