количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Особенности атопического дерматита у взрослых пациентов
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Дерматовенерология и дерматокосметология" № 3
- Аннотация
- Статья
- Ссылки
Атопический дерматит (АтД) у взрослых может быть результатом как персистенции заболевания, начавшегося в детском возрасте, так и позднего его дебюта. Две трети взрослых пациентов с АтД имеют классическую аллергическую форму заболевания, одна треть страдает неаллергическим эндогенным АтД. Выбор терапии в каждом конкретном случае зависит от вида, тяжести и продолжительности заболевания. Основу ухода за кожей больного составляют увлажняющие и смягчающие средства. Стандартом терапии АтД являются топические глюкокортикостероиды (ГКС), проактивная интермиттирующая терапия ГКС и ингибиторами кальциневрина позволяет контролировать течение заболевания. Исследования показывают, что проактивная терапия мометазона фуроатом успешно предотвращает развитие обострений АтД; кроме того, интермиттирующее применение препарата характеризуется высокой безопасностью. При резистентном к топической терапии АтД либо при тяжелой его форме применяется системная фармакотерапия, которая включает применение антигистаминных препаратов, ГКС, иммуносупрессоров (циклоспорин А).
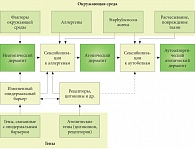
Рис. 1. Этапы развития атопического дерматита*

Таблица 1. Применение лекарственных форм при атопическом дерматите
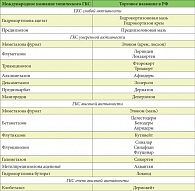
Таблица 2. Классификация топических ГКС

Рис. 2. Реактивная и проактивная терапия атопического дерматита*
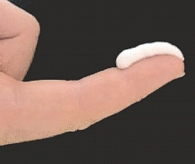
Рис. 3. Единица кончика пальца взрослого (fingertip unit, FTU) – количество топического ГКС при выдавливании из тубы диаметром 5 мм, покрывающего концевую фалангу пальца

Таблица 3. Динамика обсемененности кожи S. aureus у больных атопическим дерматитом на фоне интермиттирующей терапии мометазона фуроатом два раза в неделю на протяжении 24 недель*

Таблица 4. Безопасные дозы топических ГКС
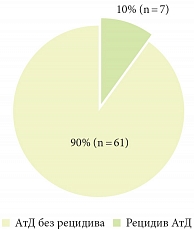
Рис. 4. Частота рецидивов АтД у больных на фоне проактивной терапии мометазона фуроатом (Элоком®)
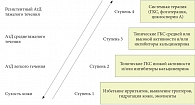
Рис. 5. Ступенчатая терапия атопического дерматита
Атопический дерматит (АтД) представляет собой хроническое воспалительное заболевание кожи, возникающее, как правило, в раннем детском возрасте у лиц с наследственной предрасположенностью к атопии, то есть синтезу IgE-антител в ответ на низкие дозы аллергенов, и характеризующееся выраженным кожным зудом и рецидивирующим течением. Особенности локализации и морфологии кожного поражения при атопическом дерматите определяются возрастом пациентов. Термин «атопический дерматит» был впервые предложен F. Wise и M.B. Sulzberger в 1930 г., поскольку это заболевание тесно ассоциировано с другими атопическими болезнями – аллергическим ринитом и бронхиальной астмой – и во многих случаях является первым проявлением атопии. Другой распространенный термин для обозначения этого заболевания – «атопическая экзема».
За последние 30 лет распространенность АтД в экономически развитых странах увеличилась в 2–3 раза, на сегодняшний момент этим заболеванием страдают 15–30% детского и 2–10% взрослого населения [1]. Хорошо известно, что 45% всех случаев АтД начинаются в течение первых 6 месяцев жизни, 60% – в течение первого года и 85% – в течение первых 5 лет. Тем не менее заболевание может начаться и во взрослом возрасте (АтД с поздним дебютом), и существенное число таких пациентов не имеет признаков IgЕ-обусловленной сенсибилизации [2]. Cчитается, что лишь 2% пациентов заболевают АтД в возрасте после 20 лет [3], однако распространенность атопического дерматита у взрослых много больше, ибо по меньшей мере у трети детей и подростков АтД персистирует и во взрослом возрасте [4].
Научные исследования АтД свидетельствуют о том, что существует не менее двух форм этого заболевания: аллергическая (экзогенная) и неаллергическая (эндогенная) [2, 5, 6]. Большинство пациентов (70–85%) страдают аллергической формой АтД, которая у большей части больных характеризуется определенной связью с присутствием экзоаллергенов, положительными кожными пробами с аллергенами, повышенным уровнем IgE-антител. Неаллергическая форма заболевания не связана с сенсибилизацией к экзоаллергенам. Этой формой АтД страдает меньшее количество больных – 15–30%, причем большинство из них женщины. У таких пациентов не развиваются респираторные аллергические заболевания, для них характерны нормальный уровень IgE, отрицательные кожные пробы и отсутствие специфических IgE-антител. Причины существования двух форм АтД объясняет так называемая объединяющая гипотеза, суть которой сводится к тому, что естественное развитие АтД проходит в три этапа (рис. 1) [7].
На начальном этапе (в раннем детстве), когда сенсибилизация еще не произошла, у такого пациента может наблюдаться неатопический дерматит. Позднее у 60–80% детей с отягощенной наследственностью по атопии происходит сенсибилизация, в результате чего у них развивается аллергия на пищевые и другие аллергены окружающей среды с клиническими проявлениями АтД. На этом этапе существенный вклад в формирование АтД вносят экзотоксины S. aureus, которые обладают свойствами суперантигенов. Наконец, расчесывание и механическое повреждение эпидермиса могут приводить к формированию аутоантигенов, образующихся из собственных белков кератиноцитов, развитию аутосенсибилизации и аутоиммунного (аутоаллергического) АтД [8, 9]. Этот процесс может быть следствием схожести структуры эпитопов аллергенов, поступающих из окружающей среды, и человеческих протеинов в контексте молекулярной мимикрии.
Исследования, посвященные АтД у взрослых, довольно редки. Одно из последних, проведенное в Италии, включало 322 пациента старше 18 лет, страдающих АтД [10]. Диагноз «атопический дерматит» ставился на основании критериев J. Hanifin и G. Rajka [11]. Базируясь на клинических данных, результатах кожных тестов с аллергенами и уровне IgE, в соответствии с критериями B. Wüthrich [5], больные были классифицированы как страдающие аллергическим и неаллергическим атопическим дерматитом. Тяжесть АтД у пациентов определялась на основании индекса тяжести атопического дерматита (Eczema Area and Severity Index (EASI)) [12], включающего оценку площади поражения и выраженность клинических симптомов (эритема, инфильтрация или папулезные высыпания, экскориации и лихенификация). Общая сумма баллов EASI варьирует от 0 до 72. В данном исследовании АтД считался легким, если значение EASI было менее 8 баллов; cредней тяжести – при EASI от 8 до 15 баллов и тяжелым, если значение EASI превышало 15 баллов.
Исходя из приведенных выше критериев, у 26,5% больных диагностирован АтД легкого течения, у 18,7% – среднетяжелого течения, у 54,8% больных – тяжелого течения. Примечательно, что почти половина больных (47,6%) заболели АтД после достижения 18-летнего возраста. Отягощенный наследственный анамнез по атопии (в том числе по АтД) имелся у 36,7% пациентов.
Сопутствующие атопические заболевания (аллергический ринит, конъюнктивит, бронхиальная астма) отмечались у 57,8% пациентов, значимого влияния на этот показатель пола пациентов или возраста дебюта АтД не установлено. Повышенный уровень IgE был выявлен у 61,7% больных, значимого влияния на этот показатель пола пациентов или возраста дебюта АтД не установлено. Положительные кожные пробы с ингаляционными или пищевыми аллергенами были получены у 68,4% больных, причем положительная реакция чаще развивалась на ингаляционные аллергены, по сравнению с пищевыми (178 случаев против 37). У 79 больных (23,8%) были получены положительные аппликационные тесты. Самой частой причиной контактной аллергической реакции служил сульфат никеля (у 49,4%), затем в порядке убывания – хлорид кобальта (12,7%), ароматная смесь (11,4%) и бихромат калия (10,1%). У 62,6% пациентов наиболее частой локализацией кожного поражения являлись верхние конечности (локтевые сгибы и кисти рук), у 44,9% – лицо (веки, периоральная область, лоб и щеки), у 36,1% пациентов – нижние конечности, у 22% – шея, у 20,8% больных – туловище. Астеатоз и кожный зуд в непораженных областях были практически постоянными симптомами у 91,9% пациентов, причем у трети из них эти симптомы были тяжелыми.
Сопутствующие атопические заболевания (аллергический ринит, конъюнктивит, бронхиальная астма) отмечались у 57,8% пациентов, значимого влияния на этот показатель пола пациентов или возраста дебюта АтД не установлено. Повышенный уровень IgE был выявлен у 61,7% больных, значимого влияния на этот показатель пола пациентов или возраста дебюта АтД не установлено. Положительные кожные пробы с ингаляционными или пищевыми аллергенами были получены у 68,4% больных, причем положительная реакция чаще развивалась на ингаляционные аллергены, по сравнению с пищевыми (178 случаев против 37). У 79 больных (23,8%) были получены положительные аппликационные тесты. Самой частой причиной контактной аллергической реакции служил сульфат никеля (у 49,4%), затем в порядке убывания – хлорид кобальта (12,7%), ароматная смесь (11,4%) и бихромат калия (10,1%). У 62,6% пациентов наиболее частой локализацией кожного поражения являлись верхние конечности (локтевые сгибы и кисти рук), у 44,9% – лицо (веки, периоральная область, лоб и щеки), у 36,1% пациентов – нижние конечности, у 22% – шея, у 20,8% больных – туловище. Астеатоз и кожный зуд в непораженных областях были практически постоянными симптомами у 91,9% пациентов, причем у трети из них эти симптомы были тяжелыми.
В результате проведенного обследования экзогенный АтД был диагностирован у 231 (69,6%) пациента (115 мужчин и 116 женщин, средний возраст 31,6 лет), неаллергический эндогенный атопический дерматит – у 101 (30,4%) пациента (30 мужчин и 71 женщина, средний возраст 27,1 лет). Значимой разницы в отношении возраста дебюта АтД и локализации кожного поражения между больными этих двух групп выявлено не было. У больных с аллергическим АтД наследственный анамнез по атопии был отягощен значимо чаще. Разницы в частоте контактной сенсибилизации между пациентами с аллергическим и неаллергическим АтД отмечено не было.
Анализ предшествующих исследований [13–18] свидетельствует о том, что АтД у взрослых может быть результатом персистенции АтД, начавшегося в детском или подростковом возрасте, либо позднего дебюта АтД. Как показало исследование L. Zeppa и соавт. [10], поздний атопический дерматит может развиваться почти у половины взрослых пациентов (47,6%). Таким образом, критерий раннего, произошедшего в детском возрасте, дебюта АтД не столь значим в диагностике АтД у взрослых. Две трети взрослых пациентов, страдающих АтД, имеют классическую аллергическую форму заболевания, и только одна треть страдает неаллергическим эндогенным АтД, что в целом соответствует распределению данных фенотипов и в других возрастных группах, варьируя в зависимости от страны и выбранных критериев [19]. Следовательно, в диагностике АтД у взрослых, так же как и у детей, наравне с анамнезом и клинической картиной большое значение имеет специфическое аллергологическое обследование. В исследовании L. Zeppa и соавт. [10] не отмечено гендерной разницы в частоте АтД у взрослых, тогда как в других исследованиях [13, 20] среди взрослых пациентов с АтД установлено некоторое превалирование женщин, а в исследовании R. Tanei [21] соотношение пожилых мужчин и женщин, страдающих АтД, составило 3:1.
Диагноз «атопический дерматит» у взрослых пациентов, так же как и у детей, является клиническим и основывается на типичной морфологии (наличие лихенификации, расчесов и корочек; в фазе обострения – папулезных и везикулезных высыпаний; выраженного кожного зуда) и локализации кожного поражения. Типично поражение верхних конечностей и лица.
Дифференциальный диагноз АтД у взрослых проводят с себорейным дерматитом, нуммулярным дерматитом, ирритантным контактным дерматитом (особенно при поражении кожи кистей рук), аллергическим контактным дерматитом (особенно при поражении кожи кистей рук), фотоаллергическим и фототоксическим дерматитами, поражением кожи под действием лекарств, лимфомой кожи, чесоткой, псориазом (особенно с эритродермической формой), укусами насекомых. Особого внимания заслуживает поражение кожи кистей рук при АтД, которое требует проведения дифференциальной диагностики с контактным аллергическим или ирритантным дерматитом.
Выбор терапии в каждом конкретном случае АтД зависит от вида, тяжести и продолжительности заболевания. Единой рекомендацией для всех пациентов с АтД является устранение контакта с триггерными факторами. У большинства пациентов применяется преимущественно топическое лечение как наиболее эффективное и имеющее наименьшее количество побочных эффектов.
Системная терапия глюкокортикостероидами и иммуносупрессорами применяется при резистентном к топической терапии АтД либо при тяжелой его форме. При неэффективности традиционной топической терапии может использоваться фототерапия. Основу ухода за кожей больных АтД составляют увлажняющие и смягчающие средства.
Системная терапия глюкокортикостероидами и иммуносупрессорами применяется при резистентном к топической терапии АтД либо при тяжелой его форме. При неэффективности традиционной топической терапии может использоваться фототерапия. Основу ухода за кожей больных АтД составляют увлажняющие и смягчающие средства.
Общими в лечении АтД являются меры по элиминации специфических аллергенов, если таковые выявлены при специфическом аллергологическом обследовании; избегание неспецифических ирритантов; меры, направленные на гидратацию и смягчение кожи; информирование пациентов.
Уход за кожей при АтД предполагает исключение физических упражнений и занятий, вызывающих повышенное потоотделение; исключение соприкосновения кожи с жесткой тканью и шерстью (предпочтителен хлопок); поддержание в спальне прохладной температуры (не выше 20 °С). Нельзя использовать для стирки одежды и постельного белья моющие средства с ферментными добавками, во время мытья рекомендуется не пользоваться мочалками и жесткими губками, не использовать горячую воду для ванны и душа, применять только высококачественные моющие средства с нейтральным рН (5,5), после купания кожу следует промокнуть мягким полотенцем и сразу нанести смягчающие средства на пораженные участки.
Больным АтД, обусловленным пищевой аллергией, а также пациентам с неаллергической пищевой гиперчувствительностью назначается специальная элиминационная диета. Пациенты с АтД должны ограничивать употребление в пищу продуктов с высоким содержанием гистамина или обладающих гистаминолиберирующей активностью, а также острой и горячей пищи. Существуют диетические рекомендации в отношении некоторых пищевых продуктов, употребление которых может быть полезно при АтД: морковный сок, содержащий бета-каротин, продукты, содержащие основные жирные кислоты (масло зерен черной смородины, масло первоцвета, жиры лососевых рыб). Полезны также морские водоросли, богатые йодом и другими минералами, а также витамины группы В, витамины А, Е и С. Пациентам с АтД рекомендуется ежедневное принятие ванны с использованием теплой дехлорированной воды. Эта простая процедура очищает и увлажняет кожу, способствует более глубокому проникновению лекарственных препаратов. Дехлорирование воды проводится путем ее отстаивания в ванне в течение 1–2 часов с последующим согреванием воды или добавлением кипятка. У многих пациентов оказываются эффективными ванны с морской солью или с крахмалом (200–300 г крахмала на 1 ванну). Возможно использование специальных масел для ванн. При условии отсутствия пыльцевой сенсибилизации могут быть полезны ванны с отварами или настоями трав (льняное семя, корень лопуха и аира, мать-и-мачеха, крапива, тысячелистник, фиалка). Следует использовать настой или отвар одной травы, а не смеси трав. При выраженном мокнутии рекомендуются ванны с антисептическими средствами, в частности, с перманганатом калия в слабой концентрации (раствор должен иметь бледно-розовый цвет).
Основу ухода за кожей, пораженной АтД, составляют увлажняющие и смягчающие средства, которые должны применяться постоянно, независимо от фазы кожного процесса. Найти наиболее подходящий для конкретного пациента смягчитель чаще всего удается с помощью метода проб и ошибок. Далеко не всегда дорогие эмолиенты оказываются лучше дешевых. Увлажняющие и смягчающие средства должны использоваться, по меньшей мере, дважды в день, лучше сразу после душа или ванны (в течение 3 минут), чтобы обеспечить максимальный увлажняющий эффект. Все смягчители делятся на окклюзивы и увлажнители. Первые обеспечивают образование жировой пленки на поверхности кожи, замедляя тем самым потерю воды через кожу, повышая ее содержание в роговом слое и защищая кожу от внешних раздражителей. К этой группе средств относятся масла для ванн, оставляющие тонкую масляную пленку на коже. Большее окклюзивное действие, чем масла для ванн, оказывают лосьоны, которые лучше всего применять сразу после купания, а кремы – еще более выраженный окклюзивный эффект, чем лосьоны. Максимальный окклюзивный эффект обеспечивает применение мазей, которые содержат чистый белый мягкий или жидкий парафин или вазелин.
Увлажнители – это вещества, которые проникают в роговой слой кожи, увеличивая ее способность удерживать воду. К ним относятся: глицерин, мочевина, альфа-гидроксильные кислоты (молочная кислота, гликолевая кислота), церамиды, холестерол. Для ухода за кожей существуют различные средства специальных лечебно-косметических серий Атодерм, Мустела, Авен, А-Дерма, Топикрем, Элобейз, Локобейз, Урьяж, Физиогель и другие, доступные в настоящее время на отечественном фармацевтическом рынке. В состав большинства этих лечебно-косметических серий входят как очищающие средства (мыла, гели и молочко для душа), так и увлажняющие/смягчающие средства (лосьоны, эмульсии, кремы, средства для ванн).
Для наружной противовоспалительной терапии АтД применяются следующие группы лекарственных препаратов:
- топические глюкокортикостероиды (ГКС);
- ингибиторы кальциневрина;
- традиционные средства;
- топические антибактериальные и противогрибковые препараты.
Выбор лекарственной формы для наружной терапии АтД зависит от фазы воспалительного процесса (табл. 1).
Топические ГКС являются стандартом терапии АтД, с которым сравнивают другие виды лечения. Эти препараты применяются для лечения АтД более 50 лет и по-прежнему остаются основным видом наружной терапии этого заболевания. Терапевтический эффект наружных ГКС обусловлен их противовоспалительным, сосудосуживающим и антипролиферативным действием.
Противовоспалительный эффект топических ГКС в коже и других тканях реализуется при участии различных механизмов, но наибольшее значение имеет механизм, опосредованный цитозольными рецепторами. Суть его состоит в том, что гормон-рецепторный комплекс, проникая в ядро клеток-мишеней в коже (кератиноциты, фибробласты, дендритные клетки и др.), увеличивает экспрессию генов, кодирующих синтез пептидов, называемых липокортинами. Они ингибируют активность лизосомальной фосфолипазы А2 и тем самым уменьшают образование медиаторов воспаления – эйкозаноидов (простагландины, лейкотриены) из фосфолипидов (геномный эффект). Внегеномный механизм действия, являющийся преимущественным для мометазона фуроата, реализуется путем взаимодействия гормон-рецепторного комплекса с цитозольными факторами транскрипции: активирующим протеином и ядерным фактором каппа. В результате этого процесса происходит супрессия транскрипции генов, кодирующих образование провоспалительных цитокинов (интерлейкинов (ИЛ) 1–6, 11 и 13, фактора некроза опухоли (ФНО), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), молекул адгезии). Кроме того, действуя на гранулоциты и лимфоциты, кортикостероиды тормозят их активность. Механизм сосудосуживающего действия кортикостероидов изучен недостаточно, вероятно, он обусловлен сужением метартериол. Антипролиферативное действие ГКС связано с торможением синтеза нуклеиновых кислот, прежде всего ДНК, в клетках базального слоя эпидермиса и фибробластах дермы. Топические ГКС могут влиять на бактериальную колонизацию при атопическом дерматите, уменьшая плотность колоний S. aureus. По степени фармакологической активности топические ГКС подразделяются на ГКС слабой, средней, высокой и очень высокой активности (табл. 2) [22, 23]. АтД является хроническим персистирующим заболеванием, поэтому наружные ГКС большинству больных приходится использовать в течение многих лет. Среди наружных кортикостероидов выделяют фторированные (содержащие фтор) и нефторированные препараты. К фторированным ГКС относятся: дексаметазон, бетаметазон, флуоцинолон, флуметазон, флутиказон, триамцинолон, клобетазол. В группу нефторированных ГКС входят гидрокортизона ацетат, гидрокортизона бутират, мометазона фуроат, метилпреднизолона ацепонат.
Фторированные ГКС, как правило, обладают большей противовоспалительной активностью, но чаще вызывают развитие побочных эффектов. Их не рекомендуется использовать на коже лица и в области кожных складок, длительность их применения не должна превышать 7 дней, тогда как нефторированные ГКС можно использовать на этих областях в течение 2 недель, а на остальной поверхности кожи – до 4 недель.
Противовоспалительный эффект топических ГКС в коже и других тканях реализуется при участии различных механизмов, но наибольшее значение имеет механизм, опосредованный цитозольными рецепторами. Суть его состоит в том, что гормон-рецепторный комплекс, проникая в ядро клеток-мишеней в коже (кератиноциты, фибробласты, дендритные клетки и др.), увеличивает экспрессию генов, кодирующих синтез пептидов, называемых липокортинами. Они ингибируют активность лизосомальной фосфолипазы А2 и тем самым уменьшают образование медиаторов воспаления – эйкозаноидов (простагландины, лейкотриены) из фосфолипидов (геномный эффект). Внегеномный механизм действия, являющийся преимущественным для мометазона фуроата, реализуется путем взаимодействия гормон-рецепторного комплекса с цитозольными факторами транскрипции: активирующим протеином и ядерным фактором каппа. В результате этого процесса происходит супрессия транскрипции генов, кодирующих образование провоспалительных цитокинов (интерлейкинов (ИЛ) 1–6, 11 и 13, фактора некроза опухоли (ФНО), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), молекул адгезии). Кроме того, действуя на гранулоциты и лимфоциты, кортикостероиды тормозят их активность. Механизм сосудосуживающего действия кортикостероидов изучен недостаточно, вероятно, он обусловлен сужением метартериол. Антипролиферативное действие ГКС связано с торможением синтеза нуклеиновых кислот, прежде всего ДНК, в клетках базального слоя эпидермиса и фибробластах дермы. Топические ГКС могут влиять на бактериальную колонизацию при атопическом дерматите, уменьшая плотность колоний S. aureus. По степени фармакологической активности топические ГКС подразделяются на ГКС слабой, средней, высокой и очень высокой активности (табл. 2) [22, 23]. АтД является хроническим персистирующим заболеванием, поэтому наружные ГКС большинству больных приходится использовать в течение многих лет. Среди наружных кортикостероидов выделяют фторированные (содержащие фтор) и нефторированные препараты. К фторированным ГКС относятся: дексаметазон, бетаметазон, флуоцинолон, флуметазон, флутиказон, триамцинолон, клобетазол. В группу нефторированных ГКС входят гидрокортизона ацетат, гидрокортизона бутират, мометазона фуроат, метилпреднизолона ацепонат.
Фторированные ГКС, как правило, обладают большей противовоспалительной активностью, но чаще вызывают развитие побочных эффектов. Их не рекомендуется использовать на коже лица и в области кожных складок, длительность их применения не должна превышать 7 дней, тогда как нефторированные ГКС можно использовать на этих областях в течение 2 недель, а на остальной поверхности кожи – до 4 недель.
Выбор топического ГКС – сложная задача, решение которой зависит от возраста пациента, локализации кожного поражения и степени выраженности кожного воспаления. У больного с легкой атопической экземой применение топического ГКС низкой активности в течение нескольких дней позволит достичь полного очищения кожи от экзематозного повреждения на 1–2 недели. Для начала положительной динамики кожного процесса у пациента со среднетяжелым АтД может потребоваться применение более активных топических ГКС в течение, по меньшей мере, 2 недель, а для полного очищения кожи нужно продолжать лечение в течение нескольких недель. При тяжелом АтД лишь частичное улучшение состояния больного может наблюдаться даже после нескольких месяцев применения активных топических ГКС. Главный принцип применения топических ГКС заключается в том, что всегда следует стремиться использовать наименее активный топический ГКС в наименьшем количестве, при этом на коже в деликатных областях, характеризующихся высокой степенью резорбции (лицо, гениталии, складки), применяются только топические ГКС слабой и средней активности. В нескольких клинических исследованиях было показано, что нет никакой пользы в использовании топических ГКС более одного раза в день [24]. Вместо второго-третьего использования топических ГКС следует использовать смягчающие и увлажняющие средства.
Кроме того, топические ГКС нового поколения, такие как метилпреднизолона ацепонат, гидрокортизона бутират, мометазона фуроат, флутиказона пропионат, рекомендованы к назначению один раз в сутки и обладают высоким терапевтическим индексом, то есть высокой местной противовоспалительной активностью и минимальным риском побочных эффектов.
Традиционно топические ГКС назначались в период обострения АтД на пораженные участки кожи и отменялись сразу или постепенно с уменьшением дозы и кратности применения после купирования обострения – так называемая реактивная терапия АтД. В последние годы появилась другая стратегия противовоспалительной терапии АтД – проактивная терапия (рис. 2) [25, 26]. Cуть проактивной терапии заключается в комбинированном применении длительной превентивной противовоспалительной терапии низкими дозами препаратов (топических ГКС или ингибиторов кальциневрина), которые наносятся на ранее пораженные участки кожи, и эмолиентов на всю кожу, а также предварительного расписания врачебных визитов для контрольного осмотра [26].
Первое исследование интермиттирующего применения топических ГКС при АтД было опубликовано в 1999 г. [27]. Проактивная терапия, заключающаяся в интермиттирующем применении топических ГКС обычно дважды в неделю на ранее пораженные участки кожи, начинается сразу после достижения ремиссии в результате каждодневной (1–2 раза в день), интенсивной терапии топическими ГКС, при этом применение эмолиентов во время ремиссии продолжается [28, 29]. Увлажняющий крем следует наносить за 15 минут до противовоспалительных препаратов, а если это мазь, то через 15 минут после их применения [28, 29].
Существует достаточно много исследований, демонстрирующих эффективность проактивной терапии с использованием топических ГКС и ингибиторов кальциневрина в отношении предотвращения обострений АтД [28, 29].
Правильное дозирование топического ГКС является залогом безопасной терапии и должно осуществляться в соответствии с правилом fingertip unit (FTU) – единица кончика пальца взрослого человека. 1 FTU определяется как количество топического ГКС при выдавливании из тубы диаметром 5 мм, покрывающего концевую фалангу пальца взрослого человека (рис. 3). Считается, что около 1 FTU необходимо, чтобы нанести препарат на кисть руки или паховую область, 2 FTU – для лица или ступни, 3 FTU – для всей руки, 6 FTU – для всей ноги, 14 FTU – для туловища. Для того чтобы покрыть тело среднего взрослого человека, необходимо около 30 г препарата.
Кратность применения топических ГКС при проактивной терапии составляет 1–3 раза в неделю: 3 раза в неделю – при тяжелой степени дерматита, 2 раза в неделю – при средней степени тяжести заболевания, 1 раз в неделю – при легком течении.
Продолжительность интермиттирующей терапии в каждом случае подбирается индивидуально и, в первую очередь, определяется степенью тяжести АтД: при легком течении терапия может длиться в среднем 3 месяца; при среднетяжелом – 6 месяцев; при тяжелом – 9–12 месяцев [28, 29].
В одном из многоцентровых исследований изучали эффективность и безопасность применения мази мометазона фуроата, содержащей 0,1% гексиленгликоля (препарат Элоком®), при лечении взрослых пациентов с АтД средней степени тяжести. Эффективность терапии оценивали по регрессу клинических проявлений заболевания (эритемы и инфильтрации), динамике поражения кожного покрова, которые оценивали в баллах, кроме того, пациентам проводили бактериологическое исследование. Лечение осуществляли в 2 этапа. На первом этапе 90 пациентов получали мометазона фуроат 1 раз в день на протяжении 3 недель. На втором этапе 68 больных с выраженным эффектом от лечения продолжили терапию мометазона фуроатом 2 раза в неделю на протяжении 6 месяцев (24 недели). Кроме того, на протяжении всего курса терапии пациенты использовали крем, содержащий 5% мочевины, в качестве эмолиента [30]. В результате проактивной терапии мометазона фуроатом у подавляющего большинства больных (90%) на протяжении всего курса лечения не отмечалось обострений АтД (рис. 4).
Следует отметить высокую безопасность интермиттирующего применения мометазона фуроата: лишь у одного пациента наблюдались признаки атрофии кожи, возможно, связанные с терапией, у двух пациентов возникли проявления фолликулита, и один пациент отмечал ощущение жжения после нанесения препарата. У пациентов с АтД на фоне интермиттирующей терапии мометазона фуроатом два раза в неделю на протяжении 24 недель снизилась обсемененность кожи S. aureus (табл. 3).
Таким образом, мометазона фуроат (Элоком®) эффективен и безопасен в интермиттирующей терапии АтД. Проактивная интермиттирующая терапия топическими стероидами позволяет контролировать течение заболевания, значительно снижая риск развития обострения и продлевая период стабильной ремиссии. Феномен тахифилаксии, описанный и часто наблюдаемый при терапии топическими ГКС, не развивается при лечении мометазона фуроатом (Элоком®) даже при длительной (более 6 месяцев) интермиттирующей терапии [30].
Побочные эффекты топических ГКС, как правило, появляются только после длительного и/или неправильного применения препаратов. Местные (кожные) побочные эффекты включают стрии, атрофию, телеангиоэктазии, гипертрихоз, гипопигментацию, акнеформную сыпь. Для профилактики системных эффектов, которые могут развиться в результате подавления гипоталамо-гипофизарно-надпочечниковой системы вследствие системной абсорбции топических ГКС, подобраны безопасные дозы этих препаратов (табл. 4) [31]. Иногда у пациентов с АтД может не наблюдаться ответа на терапию топическим ГКС. Причинами этого могут быть продолжение контакта с аллергеном или ирритантом; суперинфекция S. aureus; выбор неадекватного по активности топического ГКС; недостаточное количество используемого топического ГКС; аллергия на топический ГКС; стероидная резистентность. Однако наиболее частой причиной отсутствия эффекта от топического ГКС является несоблюдение режима лечения топическими ГКС, поскольку многие пациенты из-за боязни побочных эффектов не применяют их или применяют неправильно.
Топические ингибиторы кальциневрина пимекролимус (крем Элидел®) и такролимус (0,1% и 0,03% мазь Протопик®) были разработаны и внедрены в практику лечения АтД у детей и взрослых 10 лет назад. В настоящее время накоплен уже достаточно большой опыт клинического применения этих препаратов, представляющих собой клеточноселективные ингибиторы воспалительных цитокинов и действующие преимущественно на Т-лимфоциты. Пимекролимус и такролимус препятствуют образованию и высвобождению воспалительных цитокинов, таких как ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-8, ИЛ-10, интерферон (ИНФ)-гамма, ГМ-КСФ, ФНО, и предотвращают пролиферацию Т-лимфоцитов. Кроме того, они препятствуют высвобождению медиаторов воспаления (гистамин, триптаза, ФНО) из активированных тучных клеток. Обладая высоким сродством к коже, эти препараты избирательно воздействуют на кожное воспаление, проникают глубоко в эпидермис, вместе с тем обладая минимальной способностью к всасыванию, что исключает развитие системных эффектов. Эти препараты не влияют на синтез коллагена и, следовательно, не вызывают атрофию кожи. Они хорошо переносятся пациентами всех возрастных групп и могут безопасно применяться на любых участках кожи, включая лицо, шею и складки кожи. Наиболее распространенное побочное действие этих препаратов – чувство жжения и покраснение кожи в местах их применения, которое обычно не требует отмены препарата. В международных согласительных документах по АтД препараты этой группы предлагаются как альтернативная терапия топическим стероидам в острую фазу болезни, а также как поддерживающая терапия при персистирующем или непрерывно-рецидивирующем течении атопического дерматита (рис. 5) [32]. Недавний метаанализ [33], в который были включены данные 17 клинических исследований, сравнивающих эффективность топического такролимуса с топическими ГКС у детей (n = 2328) и взрослых (n = 2849), продемонстрировал одинаковую эффективность такролимуса и высоко и умеренно активных топических ГКС.
К средствам традиционной топической терапии атопического дерматита относятся препараты нафталана, дегтя, ихтиола, препараты цинка. Они используются в виде паст, мазей, кремов различных концентраций в зависимости от стадии и клинической формы заболевания (чем острее воспалительный процесс, тем меньше должна быть концентрация входящих в лекарственную форму препаратов). Препараты нафталана, дегтя, ихтиола издавна применяли для лечения больных атопическим дерматитом, особенно в стационарных условиях. Их общим недостатком, ограничивающим применение у пациентов с АтД, является неприятный запах и то, что они пачкают одежду.
Препараты, содержащие цинк, обладают противовоспалительным, бактериостатическим и противогрибковым действием и в некоторых случаях при умеренно выраженных обострениях АтД оказываются эффективными даже в виде монотерапии. К готовым формам цинксодержащих препаратов относятся препараты линии Скин-кап (крем, аэрозоль и шампунь), Деситин (мазь), Цинокап (крем).
Основное действующее вещество препарата Скин-кап – цинка пиритионат, активированный на молекулярном уровне действием электромагнитного поля, приводящим к структурной перестройке молекулы с активацией атомов цинка и серы, стабилизации молекулы цинка пиритионата и длительному ее сохранению в активной форме на коже. Вспомогательные поверхностно-активные вещества, содержащиеся в препарате, увеличивают проницаемость кожи, обеспечивают быстрое всасывание основного активного вещества и доставку его в корневой слой эпидермиса, что приводит к существенному усилению активности цинка пиритионата. Этим механизмом и объясняется быстрый и выраженный лечебный и косметический эффект препаратов Скин-кап. Действующим веществом препарата Цинокап также является пиритионат цинка. Деситин – мазь, содержащая 40% оксида цинка, рыбий жир (масло из печени трески), вазелин и ланолин, – оказывает подсушивающее, противовоспалительное и антисептическое действие. Деситин уменьшает экссудацию и мокнутие, снимает местные проявления воспаления и раздражения в месте нанесения.
При присоединении вторичной микробной или грибковой инфекции могут быть эффективны комбинированные препараты, содержащие топический ГКС, антибиотик и/или антимикотик (Тридерм, Акридерм, Пимафукорт и др.).
Системная фармакотерапия АтД включает применение антигистаминных препаратов, ГКС, иммуносупрессоров (циклоспорин А).
Антигистаминные препараты являются наиболее часто используемыми системными средствами в лечении АтД у детей и взрослых, хотя гистамин играет не самую значительную роль в патогенезе заболевания, и нет исследований, которые убедительно доказывали бы эффективность этой группы препаратов в лечении АтД, особенно у взрослых. Однако бесспорно, что антигистаминные препараты показаны пациентам с АтД, страдающим сопутствующими аллергическими заболеваниями (ринитом, конъюнктивитом, крапивницей).
Препараты, являющиеся системными иммуномодуляторами, используются в лечении тяжелого АтД, рефрактерного к топической терапии. К таким препаратам относятся, прежде всего, системные ГКС и циклоспорин А. Иногда короткий курс системных ГКС (преднизолон) оказывается полезен при выраженном обострении АтД, когда исчерпаны другие возможности лечения (прежде всего возможности применения топических ГКС). Однако в процессе короткого курса системной терапии необходимо начать терапию топическим ГКС, чтобы избежать обострения кожного процесса после отмены системных ГКС. Циклоспорин А – сильный иммуносупрессивный препарат, ингибирующий кальциневрин. Во многих исследованиях продемонстрирован эффект коротких курсов (1–4 месяца) терапии циклоспорином А у детей и взрослых с тяжелым, рефрактерным к традиционной терапии АтД [34–36]. Лечение циклоспорином А приводит к редуцированию кожного процесса и улучшению качества жизни больного, однако при прерывании лечения происходит, как правило, возврат симптомов заболевания. Лечение циклоспорином А всегда связано с высоким риском развития серьезных побочных эффектов: повышения уровня сывороточного креатинина, нарушения функции почек, артериальной гипертонии.
Таким образом, хотя выбор терапии АтД и является сугубо индивидуальным процессом в отношении каждого пациента, он должен основываться на общепринятых международных рекомендациях. Успех терапии АтД зависит от эффективного взаимодействия врача и пациента, а также от поддержки больного родственниками, друзьями и коллегами.
1. Williams H., Flohr C. How epidemiology has challenged 3 prevailing concepts about atopic dermatitis // J. Allergy Clin. Immunol. 2006. Vol. 118. № 1. P. 209–213.
2. Novak N., Bieber T. Allergic and nonallergic forms of atopic diseases // J. Allergy Clin. Immunol. 2003. Vol. 112. № 2. P. 252–262.
3. Rudikoff D., Lebwohl M. Atopic dermatitis // Lancet. 1998. Vol. 351. № 9117. P. 1715–1721.
4. Williams H.C., Strachan D.P. The natural history of childhood eczema: observations from the British 1958 birth cohort study // Br. J. Dermatol. 1998. Vol. 139. № 5. P. 834–839.
5. Wüthrich B. Neurodermatitis atopica sive constitutionalis: ein pathogenetisches Modell aus der Sicht des Allergologen // Akta Dermatologie. 1983. Vol. 9. P. 1–7.
6. Johansson S.G., Bieber T., Dahl R. et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003 // J. Allergy Clin. Immunol. 2004. Vol. 113. № 5. P. 832–836.
7. Bieber T. Atopic dermatitis // N. Engl. J. Med. 2008. Vol. 358. № 14. P. 1483–1494.
8. Valenta R., Natter S., Seiberler S. et al. Molecular characterization of an autoallergen, Hom s 1, identified by serum IgE from atopic dermatitis patients // J. Invest. Dermatol. 1998. Vol. 111. № 6. P. 1178–1183.
9. Ochs R.L., Muro Y., Si Y. et al. Autoantibodies to DFS 70 kd/transcription coactivator p75 in atopic dermatitis and other conditions // J. Allergy Clin. Immunol. 2000. Vol. 105. № 6. Pt. 1. P. 1211–1220.
10. Zeppa L., Bellini V., Lisi P. Atopic dermatitis in adults // Dermatitis. 2011. Vol. 22. № 1. P. 40–46.
11. Hanifin J.M., Rajka G. Diagnostic features of atopic dermatitis // Acta Derm. Veneriol. (Stockh.). 1980. Suppl. 92. P. 44–47.
12. Hanifin J.M., Thurston M., Omoto M. et al. The eczema area and severity index (EASI): assessment of reliability in atopic dermatitis. EASI Evaluator Group // Exp. Dermatol. 2001. Vol. 10. № 1. P. 11–18.
13. Plunkett A., Merlin K., Gill D. et al. The frequency of common nonmalignant skin conditions in adults in central Victoria, Australia // Int. J. Dermatol. 1999. Vol. 38. № 12. P. 901–908.
14. Bannister M.J., Freeman S. Adult-onset atopic dermatitis // Australas J. Dermatol. 2000. Vol. 41. № 4. P. 225–228.
15. Ingordo V., D’Andria G., D’Andria C. Adult-onset atopic dermatitis in a patch test population // Dermatology. 2003. Vol. 206. № 3. P. 197–203.
16. Ozkaya E. Adult-onset atopic dermatitis // J. Am. Acad. Dermatol. 2005. Vol. 52. № 4. P. 579–582.
17. Saeki H., Tsunemi Y., Fujita H. et al. Prevalence of atopic dermatitis determined by clinical examination in Japanese adults // J. Dermatol. 2006. Vol. 33. № 11. P. 817–819.
18. Muto T., Hsieh S.D., Sakurai Y. et al. Prevalence of atopic dermatitis in Japanese adults // Br. J. Dermatol. 2003. Vol. 148. № 1. P. 117–121.
19. Leung D.Y., Boguniewicz M., Howell M.D. et al. New insights into atopic dermatitis // J. Clin. Invest. 2004. Vol. 113. № 5. P. 651–657.
20. Sandström Falk M.H., Faergemann J. Atopic dermatitis in adults: does it disappear with age? // Acta Derm. Venereol. 2006. Vol. 86. № 2. P. 135–139.
21. Tanei R. Atopic dermatitis in the elderly // Inflamm. Allergy Drug Targets. 2009. Vol. 8. № 5. P. 398–404.
22. Barry B.W., Woodford R. Comparative bio-availability of proprietary topical corticosteroid preparations vasoconstrictor assays on thirty creams and gels // Br. J. Dermatol. 1974. Vol. 91. № 3. P. 323–338.
23. Miller J.A., Munro D.D. Topical corticosteroids: clinical pharmacology and therapeutic use // Drugs. 1980. Vol. 19. № 2. P. 119–134.
24. Williams H.C. Established corticosteroid creams should be applied only once daily in patients with atopic eczema // BMJ. 2007. Vol. 334. № 7606. P. 1272.
25. Bieber T. Atopic dermatitis // Ann. Dermatol. 2010. Vol. 22. № 2. P. 125–137.
26. Wollenberg A., Bieber T. Proactive therapy of atopic dermatitis – an emerging concept // Allergy. 2009. Vol. 64. № 2. P. 276–278.
27. Van der Meer J.B., Glazenburg E.J., Mulder P.G. et al. The management of moderate to severe atopic dermatitis in adults with topical fluticasone propionate. The Netherlands Adult Atopic Dermatitis Study Group // Br. J. Dermatol. 1999. Vol. 140. № 6. P. 1114–1121.
28. Ring J., Alomar A., Bieber T. et al. Guidelines for treatment of atopic eczema (atopic dermatitis) part I // J. Eur. Acad. Dermatol. Venereol. 2012. Vol. 26. № 8. P. 1045–1060.
29. Ring J., Alomar A., Bieber T. et al. Guidelines for treatment of atopic eczema . № atopic dermatitis) Part II // J. Eur. Acad. Dermatol. Venereol. 2012. Vol. 26. № 9. P. 1176–1193.
30. Faergemann J., Christensen O., Sjövall P. et al. An open study of efficacy and safety of long-term treatment with mometasone furoate fatty cream in the treatment of adult patients with atopic dermatitis // J. Eur. Acad. Dermatol. Venereol. 2000. Vol. 14. № 5. P. 393–396.
31. Sara G.A. Van Velsen Pitfalls and opportunities in the treatment of atopic dermatitis. Ontwerp: Ton van Velsen, 2011. 188 р.
32. Akdis C.A., Akdis M., Bieber T. et al. Diagnosis and treatment of atopic dermatitis in children and adults: European Academy of Allergology and Clinical Immunology/American Academy of Allergy, Asthma and Immunology/PRACTALL Consensus Report // J. Allergy. Clin. Immunol. 2006. Vol. 118. № 1. P. 152–169.
33. Svensson A., Chambers C., Gånemo A., Mitchell S.A. A systematic review of tacrolimus ointment compared with corticosteroids in the treatment of atopic dermatitis // Curr. Med. Res. Opin. 2011. Vol. 27. № 7. P. 1395–1406.
34. Granlund H., Erkko P., Sinisalo M., Reitamo S. Cyclosporin in atopic dermatitis: time to relapse and effect of intermittent therapy // Br. J. Dermatol. 1995. Vol. 132. № 1. P. 106–112.
35. Berth-Jones J., Graham-Brown R.A., Marks R. et al. Long-term efficacy and safety of cyclosporin in severe adult atopic dermatitis // Br. J. Dermatol. 1997. Vol. 136. № 1. P. 76–81.
36. Sidbury R., Hanifin J.M. Systemic therapy of atopic dermatitis // Clin. Exp. Dermatol. 2000. Vol. 25. № 7. P. 559–566.
Новости на тему
29.07.2015
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.