Эффективность моноклональных антител, специфически блокирующих рецепторы интерлейкинов 4 и 13, при терапии атопических заболеваний у детей из Приамурья
- Аннотация
- Статья
- Ссылки
- English
Все пациенты получали дозу препарата, соответствующую их весу, возрасту и диагнозу.
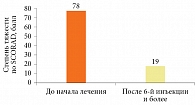
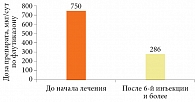
Оценка эффективности терапии проводилась после шестой инъекции препарата. Так, отмечалось значительное снижение выраженности кожных проявлений атопического дерматита (с 78 до 19 баллов по SCORAD), частоты эпизодов бронхиальной обструкции (с 10,3 до 0,7 случая в месяц), а также дозы топических глюкокортикостероидов (с 750 до 286 мкг) у детей с бронхиальной астмой. Значимых нежелательных явлений не обнаружено.
Таким образом, дупилумаб продемонстрировал эффективность и безопасность при терапии атопических заболеваний у детей.
Все пациенты получали дозу препарата, соответствующую их весу, возрасту и диагнозу.
Оценка эффективности терапии проводилась после шестой инъекции препарата. Так, отмечалось значительное снижение выраженности кожных проявлений атопического дерматита (с 78 до 19 баллов по SCORAD), частоты эпизодов бронхиальной обструкции (с 10,3 до 0,7 случая в месяц), а также дозы топических глюкокортикостероидов (с 750 до 286 мкг) у детей с бронхиальной астмой. Значимых нежелательных явлений не обнаружено.
Таким образом, дупилумаб продемонстрировал эффективность и безопасность при терапии атопических заболеваний у детей.
Введение
Широкое распространение атопических заболеваний в первую очередь обусловлено изменением совокупного генотипа населения индустриально развитых стран, вызванным кардинальной сменой образа жизни в последнем столетии. Интенсивный рост частоты встречаемости атопических заболеваний в Западной Европе и Северной Америке начался с 60-х гг. прошлого века. Через 20 лет эта тенденция была отмечена и в странах Восточной Европы. В настоящее время наибольшие показатели заболеваемости зафиксированы в развивающихся странах, переходящих к индустриальному типу производства [1].
Среди атопических заболеваний у детей лидируют атопический дерматит, аллергический ринит, бронхиальная астма и крапивница [2]. При этом наибольшую опасность с учетом хронического течения, риска смерти и влияния на качество жизни представляют бронхиальная астма и атопический дерматит.
Бронхиальная астма и атопический дерматит являются мультифакториальными заболеваниями, поэтому причины их быстрого распространения разнообразны. У детей в основе их развития, как правило, лежит атопическое воспаление.
В последние годы общепринятой считается теория, согласно которой аллергические заболевания обусловлены нарушениями регуляции иммунной системы, связанными с повышенной несбалансированной активацией аллерген-специфических клонов Тh2. Аллергический вариант реагирования иммунной системы называют иммунным ответом второго типа. В норме он обеспечивает защиту от гельминтов и ряда других патогенов, а при патологии приводит к развитию аллергии.
Иммунологические механизмы формирования иммунного ответа второго типа обусловлены активацией Тh2 и выработкой ими характерного набора цитокинов, синтезом В-лимфоцитами иммуноглобулина Е (IgE), накоплением и активацией эозинофилов, базофилов и тучных клеток. К так называемым цитокинам второго типа иммунного ответа относятся интерлейкины 4, 5, 9 и 13. В норме стимуляция Тh2 вызывает активацию гуморального звена иммунитета, без которого невозможно нормальное течение защитных реакций против целого ряда патогенов, при аллергии такая активация приобретает черты патологического воспаления [3].
Важно отметить, что Тh2-воспаление реализуется за счет взаимодействия адаптивной и врожденной иммунной системы. Данный процесс запускается посредством IgE-зависимого механизма, однако дальнейшее поддержание воспаления происходит за счет функционирования эндогенных порочных кругов патологической воспалительной реакции, разорвать которые без внешнего воздействия крайне сложно [4, 5].
Как следствие, при хронических, длительно текущих атопических заболеваниях воздействие на цитокины, регулирующие атопическое воспаление, представляется более перспективным, чем блокирование IgЕ.
В ряде работ установлено повышение уровня интерлейкинов 4 и 13 у детей как с бронхиальной астмой [3–8], так и с атопическим дерматитом [9–13]. Именно поэтому данные интерлейкины представляются перспективной мишенью для таргетной терапии хронических атопических заболеваний.
В России для лечения атопических заболеваний зарегистрирован блокатор рецепторов интерлейкинов 4 и 13 дупилумаб. Данный препарат разрешен к применению у детей.
Дупилумаб рекомендован экспертами Европейской академии аллергологии и клинической иммунологии для терапии как атопического дерматита [14], так и бронхиальной астмы [15]. Его эффективность подтверждена в нескольких крупных зарубежных исследованиях, однако она различается в разных регионах [16–21]. В России, в Московском регионе, также было проведено одно довольно масштабное исследование эффективности дупилумаба при бронхиальной астме и атопическом дерматите у взрослых пациентов [22]. Однако в доступной нам литературе работ по оценке эффективности такой терапии у российских детей не обнаружено.
Целью настоящего исследования стала оценка эффективности дупилумаба у детей из Приамурья, страдавших бронхиальной астмой и атопическим дерматитом.
Материал и методы
Работа проведена на базе клиники (педиатрическое и консультативно-диагностическое отделения) и лаборатории комплексных методов исследований бронхолегочной и перинатальной патологии Хабаровского филиала ФГБНУ «Дальневосточный научный центр физиологии и патологии дыхания» – Научно-исследовательского института охраны материнства и детства.
В исследование были включены десять детей с атопическим дерматитом и шесть детей с бронхиальной астмой. Среди первых было восемь мальчиков и две девочки, среди вторых – пять мальчиков и одна девочка. Возраст пациентов составил от 6 до 18 лет.
Все дети получали таргетную терапию дупилумабом в дозах, соответствующих их весу, возрасту и диагнозу.
У детей с атопическим дерматитом критерием начала таргетной терапии было тяжелое течение заболевания (согласно клиническим рекомендациям Министерства здравоохранения РФ по атопическому дерматиту, четыре балла по общей оценке исследователем (Investigator Global Assessment, IGA) [23]), торпидное к традиционной терапии, у детей с бронхиальной астмой – отсутствие контроля на фоне терапии (согласно клиническим рекомендациям Министерства здравоохранения РФ по бронхиальной астме, четвертая или пятая ступени [24]).
Эффективность терапии оценивалась после шестой инъекции дупилумаба. У детей с атопическим дерматитом она анализировалась по изменению тяжести кожного процесса, определяемой по SCORAD (Scoring of Atopic Dermatitis) [23], у детей с бронхиальной астмой – по частоте обострений и дозе получаемых топических глюкокортикостероидов. Согласно критериям экспертов Глобальной инициативы по бронхиальной астме [25], оценка дозы проводилась по флутиказону с пересчетом иных препаратов по уровню биоэквивалентности.
Результаты исследования были введены в ранее созданную и утвержденную электронную базу Excel-2013. Для анализа данных использовали стандартные методы вариантной статистики с применением пакета программ Statistica для Windows (версия 10.0). Все значения представлены в виде М ± m – среднее ± стандартная ошибка среднего (SD/sqrt(n) = SEM, где n – объем выборки). В связи с малым количеством случаев в группах, обусловленным характером терапии, проверку статистической гипотезы равенства групповых средних проводили с помощью U-критерия Манна – Уитни – Уилкоксона.
В работе приведены значения, достоверность различий которых составила р < 0,05.
Результаты и их обсуждение
У десяти больных атопическим дерматитом после шестой инъекции дупилумаба достоверно было обнаружено четырехкратное снижение среднего значения интегрального показателя тяжести кожного процесса, оцениваемого по SCORAD, – с 78 до 19 баллов (р = 0,041) (рис. 1).
На фоне проводившейся терапии в двух случаях из десяти удалось добиться полной ремиссии заболевания (IGA – ноль баллов), в восьми случаях – значительного улучшения (IGA – один балл).
Полученные нами результаты коррелируют с результатами многоцентровых исследований с участием 367 пациентов из 61 учреждения шести стран [16]. В то же время они демонстрируют несколько большую эффективность терапии, сходную с эффективностью, представленной в итальянском исследовании 2022 г. [26]. В указанном исследовании у 55 детей из 24 дерматологических и педиатрических центров, равномерно распределенных в Северной, Центральной и Южной Италии, фиксировалось уменьшение количественных показателей поражения кожи примерно в четыре раза.
У детей с бронхиальной астмой на фоне терапии дупилумабом обнаружено достоверное снижение частоты проявлений обструкции – в 14,7 раза (с 10,3 до 0,7 случая в месяц, р = 0,001). На момент начала терапии контроль над заболеванием отсутствовал у всех детей. После шестой инъекции дупилумаба контроль бронхиальной астмы достигнут также у всех пациентов.
Представленные результаты согласуются с данными многоцентрового международного исследования VOYAGE по оценке эффективности терапии бронхиальной астмы дупилумабом у 408 детей, 273 из которых получали препарат, 135 – плацебо [27]. Однако наше исследование продемонстрировало несколько большую эффективность дупилумаба, что может быть связано с малочисленностью группы.
Современные клинические рекомендации [24, 25] не подразумевают обязательного снижения дозы топических глюкокортикостероидов при терапии бронхиальной астмы у детей после начала применения дупилумаба. В то же время достигнутый контроль заболевания позволяет проводить таковое в рамках соблюдения ступенчатой терапии.
У детей, получавших дупилумаб, средняя доза ингаляционных глюкокортикостероидов сократилась в 2,6 раза – с 750 до 286 мкг (р = 0,03) по флутиказону (рис. 2). В трех случаях удалось отменить их полностью, оставив дупилумаб в виде монотерапии.
Нам не удалось обнаружить работ, посвященных влиянию таргетной терапии на дозу ингаляционных глюкокортикостероидов, поэтому полученные результаты могут представлять особый интерес.
На фоне терапии дупилумабом в двух случаях наблюдалась эритематозная папула с зудом в месте инъекции диаметром до 3 см, самостоятельно купировавшаяся в течение двух часов. Других побочных эффектов лечения, в том числе развития конъюнктивита, наиболее часто описываемого в литературе, не обнаружено.
Все зафиксированные нежелательные реакции были легкой степени и не требовали отмены или коррекции терапии. Кроме того, они не являлись уникальными (указаны в инструкции по медицинскому применению дупилумаба) и, согласно общим правилам, были репортированы.
Заключение
Дупилумаб показал высокую эффективность в отношении уменьшения интенсивности симптомов атопического дерматита, кратного снижения баллов по SCORAD. В ряде случаев его применение привело к клинической ремиссии. Прием препарата также ассоциировался с устойчивым сокращением частоты обострений бронхиальной астмы. Кроме того, на фоне его применения удалось кратно снизить объем глюкокортикостероидов, необходимый для контроля над заболеванием, а в некоторых случаях даже отменить их.
Терапия дупилумабом хорошо переносилась и отличалась благоприятным профилем безопасности.
Таким образом, на современном этапе применение дупилумаба при атопических заболеваниях, в частности при атопическом дерматите и бронхиальной астме, является оптимальной стратегией. Ограничение его назначения при легком течении этих заболеваний обусловлено социально-экономическими причинами и может быть преодолено в ходе дальнейшего развития фармакологической промышленности.
E.N. Suprun, PhD, N.O. Abdulina, S.V. Suprun, MD, PhD, O.I. Galyant, PhD, O.A. Lebedko, MD, PhD
Khabarovsk Branch of Federal State Budgetary Scientific Institution ‘Far Eastern Scientific Center of Physiology and Pathology of Respiration’ – Research Institute of Maternity and Childhood Protection
Federal State Budgetary Educational Institution of Higher Education ‘Far Eastern State Medical University’
Contact person: Evgeny N. Suprun, evg-suprun@yandex.ru
The article presents the results of a study of the effectiveness of targeted therapy (dupilumab) for severe atopic dermatitis in 10 patients (8 boys and 2 girls) and uncontrolled bronchial asthma in 6 patients (5 boys and 1 girl) aged 6 to 18 years living in the Amur region are presented.
All patients received a dose of the drug according to their weight, age and diagnosis. Clinical efficacy was evaluated after the 6th injection of the drug. There was a multiple, from 78 to 19 SCORAD points, decrease in the severity of skin manifestations in children with atopic dermatitis and a decrease by an order of magnitude, 10.3 to 0.7 per month in the frequency of episodes of bronchial obstruction, as well as the dose of topical glucocorticosteroids by 2.6 times from 750 to 286 mcg. No significant adverse events were detected. Thus, dupilumab has demonstrated efficacy and safety in the treatment of atopic diseases in children.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.