Особенности диагностики эозинофильного энтерита
- Аннотация
- Статья
- Ссылки
- English
Введение
Эозинофильные желудочно-кишечные заболевания (Eosinophilic Gastrointestinal Diseases – EGIDs) – это группа хронических иммуноопосредованных заболеваний, которые характеризуются клиническими симптомами, патологической эозинофильной инфильтрацией желудочно-кишечного тракта (ЖКТ) при отсутствии иных (вторичных) причин тканевой эозинофилии [1].
Наиболее известным эозинофильным заболеванием является эозинофильный эзофагит. Распространенность колеблется в среднем от 22 до 43 случаев на 100 тысяч населения с преобладанием среди мужчин [1–3]. По данным официального сайта Минздрава России, эозинофильный эзофагит внесен в перечень орфанных заболеваний от 12 марта 2025 г. [4].
В настоящее время существенный интерес представляют также эозинофильные желудочно-кишечные расстройства, выходящие за рамки эозинофильного эзофагита (Non-Eosinophilic Esophagitis Eosinophilic Gastrointestinal Diseases – non-EoE EGIDs). Согласно международным консенсусным рекомендациям, к ним относят эозинофильный гастрит, эозинофильный энтерит (ЭоЭн: эозинофильный дуоденит, эозинофильный еюнит, эозинофильный илеит), эозинофильный колит [1, 5].
Распространенность данных заболеваний невелика и составляет три – восемь случаев на 100 тысяч населения с преобладанием среди женщин [1, 5, 6].
Эозинофильные желудочно-кишечные заболевания были впервые описаны в 1937 г. шведским врачом R. Kaijer, однако и в настоящее время их диагностика представляет определенные сложности [1, 6, 7], что иллюстрирует приводимый нами клинический случай.
В марте 2025 г. в отделение гастроэнтерологии Саратовской городской клинической больницы № 5 (клиническая база кафедры терапии, гастроэнтерологии и пульмонологии Саратовского государственного медицинского университета им. В.И. Разумовского) была госпитализирована пациентка С. 33 лет с жалобами на чувство переполнения и боль в верхних отделах живота, выраженное урчание в животе, тошноту, жидкий стул (тип 6 по Бристольской шкале) без патологических примесей до трех раз в сутки.
Из анамнеза известно, что около девяти лет назад (2016 г.) пациентка впервые отметила выраженную тяжесть, чувство переполнения, давящую боль в верхней половине живота, которая усиливалась после приема пищи, сопровождалась тошнотой, упорной рвотой.
Симптомы появились без явной причины через четыре месяца после родов (роды протекали без осложнений) и были расценены как проявления пищевой токсикоинфекции. Пациентка находилась в инфекционном стационаре, где ей проводили дезинтоксикационную и регидратационную терапию, на фоне которой симптоматика была полностью купирована.
После выписки пациентка чувствовала себя удовлетворительно, за медицинской помощью не обращалась до июня 2020 г., когда вновь отметила появление давящей боли в верхних отделах живота, рвоты, а также увеличение размеров живота. Была госпитализирована в хирургическое отделение по линии скорой медицинской помощи.
Вследствие подозрения на острый панкреатит были выполнены диагностическая лапароскопия и дренирование брюшной полости. При ревизии во всех отделах брюшной полости и малом тазу определялось умеренное количество серозного выпота, другой патологии брюшной полости не было обнаружено. Установлен диагноз: «острый панкреатит, отечная форма, осложненный ферментативным перитонитом». Проведено лечение: спазмолитики, антибактериальные препараты (цефтриаксон), ингибиторы протонной помпы (омепразол), аналоги соматостатина (октреотид), а также инфузионная терапия. Самочувствие улучшилось, абдоминальная боль и диспепсические симптомы были купированы. После выписки пациентка чувствовала себя удовлетворительно, никаких лекарственных препаратов не принимала.
Следующее ухудшение самочувствия возникло в январе 2024 г., когда без явной причины появились тяжесть и вздутие в эпигастрии, тошнота. На амбулаторном этапе пациентка принимала тримебутин 600 мг/сут в течение двух недель без эффекта.
В феврале 2024 г. боль в верхних отделах живота усилилась, присоединились рвота, увеличение размеров живота, в связи с чем пациентка была госпитализирована в хирургическое отделение по линии скорой медицинской помощи. При объективном исследовании было отмечено умеренное вздутие живота, умеренная болезненность в эпигастрии, а также притупление перкуторного звука в отлогих частях живота, симптомов раздражения брюшины не было.
При лабораторном обследовании в общем анализе крови (ОАК) отмечались лейкоцитоз до 23,19 × 109/л и выраженная эозинофилия (66%; 15,3 × 109/л), прочие показатели ОАК от нормы не отклонялись.
Антитела к ВИЧ, Hepatitis C virus и поверхностный антиген Hepatitis B virus не обнаружены, общий анализ мочи – без патологии. Показатели биохимического исследования крови – в пределах нормы (альбумин – 44 г/л, холестерин – 4,1 ммоль/л, общий белок – 68 г/л, глюкоза – 4,8 ммоль/л, общий билирубин – 10 мкмоль/л, С-реактивный белок (СРБ) – 5 мг/л, альфа-амилаза – 24 Ед/л, аспартатаминотрансфераза (АСТ) – 11 Ед/л, аланинаминотрансфераза (АЛТ) – 8 Ед/л, гамма-глютамилтранспептидаза – 10 Ед/л), при динамическом контроле отклонений также не выявлено. Паразиты и яйца гельминтов в кале (трехкратно, методом обогащения) не выявлены, антиген Helicobacter pylori в кале не обнаружен, онкомаркер СА 19-9 – 5 Ед/мл (при референсном значении от 0 до 34 Ед/мл), раково-эмбриональный антиген 2 нг/мл (при референсном значении 5 нг/мл).
При ультразвуковом исследовании (УЗИ) органов брюшной полости определялась свободная жидкость в брюшной полости во всех отделах в значительном количестве, в малом тазу – около 500 мл, диффузная неоднородность и повышение эхогенности поджелудочной железы, пневматоз кишечника. Исследование асцитической жидкости не проводилось по техническим причинам.
При УЗИ почек и малого таза патологии не выявлено (за исключением выпота в малом тазу).
При эзофагогастродуоденоскопии (ЭГДС) выявлен поверхностный гастрит, взята биопсия из тела, антрального отдела желудка и луковицы двенадцатиперстной кишки; гистологические изменения были расценены как признаки поверхностного антрального гастрита, хронического дуоденита, не ассоциированного с Helicobacter pylori.
Проведена толстокишечная эндоскопия (осмотр до купола слепой кишки), патологии не выявлено, взята биопсия из восходящей ободочной кишки, поперечной ободочной кишки, сигмовидной и прямой кишок; гистологическое исследование биоптатов не выявило диагностически значимых изменений.
При проведении компьютерной томографии (КТ) брюшной полости выявлены: инфильтративные изменения стенок тонкой кишки (утолщение стенки до 0,5 см, протяженность – 3 см), выпот в брюшной полости, а также отсутствие патологических изменений поджелудочной железы. Пациентке был диагностирован хронический неверифицированный энтерит, асцит, очаговый поверхностный гастрит, не ассоциированный с Helicobacter pylori, высказано предположение о возможности ЭоЭн, однако верифицировать диагноз не удалось, от повторного эндоскопического обследования пациентка отказалась. В стационаре проводилась антибактериальная (цефтриаксон, метронидазол, ципрофлоксацин), спазмолитическая (папаверин, платифиллин), диуретическая (фуросемид) терапия. С учетом диагноза неверифицированного энтерита была назначена противовоспалительная терапия (месалазин 4 г/сут перорально), с учетом эозинофилии рекомендована гипоаллергенная элиминационная диета. На фоне лечения достигнуто улучшение состояния: купированы абдоминальная боль и рвота, значительно уменьшился асцит. К моменту выписки нормализовалось количество лейкоцитов (7 × 109/л), до 13% (0,9 × 109/л) уменьшилась эозинофилия периферической крови.
В течение года после выписки пациентка чувствовала себя удовлетворительно, диету не соблюдала и лекарственных препаратов не принимала.
В марте 2025 г. симптоматика рецидивировала без провоцирующих факторов (прием пищевых продуктов, лекарственных препаратов, иные заболевания, стрессовые ситуации отрицает), по поводу чего пациентка была госпитализирована в гастроэнтерологическое отделение для обследования и лечения.
Из анамнеза жизни известно, что хронических и атопических заболеваний, явлений пищевой и лекарственной аллергии у пациентки никогда не было. Наследственность отягощена – мать пациентки страдает аллергическим ринитом и конъюнктивитом. Пациентка не курит, не употребляет биологические добавки к пище и психотропные вещества. Алкоголь употребляет редко. Беременность одна, протекала без особенностей, роды срочные, ребенок здоров. Туберкулезом, иными хроническими инфекционными заболеваниями не страдает.
При поступлении в гастроэнтерологическое отделение состояние относительно удовлетворительное; вес – 73 кг; рост – 171 см (индекс массы тела – 25,3 кг/м2, избыточная масса тела); кожа и видимые слизистые оболочки обычного цвета, чистые; лимфатические узлы не пальпируются; периферических отеков нет; в легких дыхание везикулярное; частота дыхательных движений – 18 в минуту; тоны сердца ясные, ритмичные; пульс 80 ударов в минуту, артериальное давление – 125 и 70 мм рт. ст.
Живот мягкий, при пальпации умеренно болезненный в эпигастральной области и зоне Шоффара, притупление в отлогих частях не определяется; стул два раза в сутки, типа 6 по Бристольской шкале, цвет коричневый, без патологических примесей.
В общем анализе крови вновь обнаружена эозинофилия (26,3%; 2,15 × 109/л), прочие показатели – в пределах нормальных значений.
Пациентка консультирована гематологом; изменения в анализе крови были расценены как эозинофилия вторичного генеза.
По данным коагулограммы, общего анализа мочи, патологических изменений не обнаружено. Иммуноглобулин Е (IgE) сыворотки крови – в рамках референсного значения. Показатели биохимического анализа крови не отклонялись от нормальных значений (общий белок – 67,2 г/л, альбумин – 46 г/л, холестерин – 4,9 ммоль/л, глюкоза – 4,46 ммоль/л, железо – 9 мкмоль/л, билирубин прямой – 2,3 мкмоль/л, щелочная фосфатаза – 47 Ед/л, гамма-глутамилтрасфераза – 12 Ед/л, альфа-амилаза общая – 21,2 Ед/л, АСТ – 17 Ед/л, АЛТ – 24 Ед/л, креатинин – 52 мкмоль/л, СРБ – 4,3 мг/л).
Паразиты и яйца гельминтов в кале (методом PARASEP трехкратно) не выявлены, исследование кала методом полимеразной цепной реакции на возбудителей острых кишечных инфекций – отрицательный результат.
Кальпротектин кала составил 35 мкг/г (при референсном значении до 50 мкг/г).
НBsAg, Anti-HCV – отрицательны; HIV – 1,2 Abs, p24- antigen – отрицательные, антитела к Treponema pallidum методом иммуноферментного анализа – отрицательны.
При УЗИ органов брюшной полости обнаружено растяжение петель тонкого кишечника от 1,6 до 2 см, кишечный пневматоз, свободной жидкости в брюшной полости не выявлено.
При ЭГДС патологии не выявлено, взята биопсия из вертикальной ветви двенадцатиперстной кишки.
При илеоколоноскопии полностью осмотрена толстая кишка и терминальный отдел подвздошной кишки (ТОПК), в слепой кишке обнаружена умеренная пятнистая гиперемия. Взята биопсия из ТОПК, слепой кишки и ректо-сигмоидного отдела.
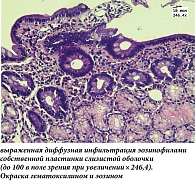
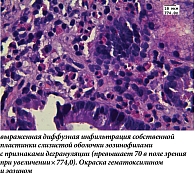
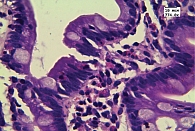
Гистологическое исследование биоптатов двенадцатиперстной кишки (ДПК) показало отек и диффузную инфильтрацию собственной пластинки лимфоцитами, плазмоцитами, эозинофилами; эозинофилы формировали очаговые скопления, инфильтрировали поверхностный и криптальный эпителий, эпителий бруннеровых желез, мышечную пластинку слизистой оболочки. Эозинофилы находились в состоянии дегрануляции (рис. 1–3).
В биоптатах терминального отдела подвздошной кишки также отмечена эозинофильная инфильтрация, эозинофилы инфильтрировали поверхностный эпителий и эпителий крипт, также отмечена дегрануляция эозинофилов. Гистологическая картина соответствовала ЭоЭн.
Гистологическая картина биоптатов толстой кишки была неспецифична, отмечалась смешанная инфильтрация стромы, не соответствующая критериям эозинофильного колита.
Наличие характерной симптоматики, типичная гистологическая картина биоптатов тонкой кишки, отсутствие данных за вторичный генез процесса позволили установить диагноз: «эозинофильный энтерит, рецидивирующее течение»; фоновый диагноз: «избыточная масса тела».
В соответствии с клиническими рекомендациями [15, 16] было назначено лечение, включающее элиминационную диету (исключение молока, сои, яиц, арахиса, орехов, рыбы и морепродуктов), прием будесонида 9 мг в сутки в течение восьми недель с постепенным снижением дозы до полной отмены препарата, симптоматическая терапия (спазмолитики, прокинетики). На фоне терапии отмечен быстрый регресс симптоматики, нормализация уровня эозинофилов периферической крови.
Обсуждение
Эозинофильный энтерит – идиопатическое заболевание ЖКТ, характеризующееся интенсивной эозинофильной инфильтрацией стенки тонкой кишки. Заболевание является редким, но, по нашим данным, не внесено в число орфанных [1, 8].
В последние годы появилось два международных консенсусных документа, касающихся данного заболевания: Совместные рекомендации ESPGHAN/NASPGHAN по эозинофильным желудочно-кишечным расстройствам, выходящим за рамки эозинофильного эзофагита (у детей), а также Международные консенсусные рекомендации по номенклатуре эозинофильных желудочно-кишечных заболеваний [1, 5].
Распространенность ЭоЭн составляет 5 на 100 тысяч человек (чаще диагностируется у детей до пяти лет). Среди взрослых заболевание поражает преимущественно женщин (57%), представителей европеоидной расы (77%), лиц в возрасте 30–50 лет (83%) [1, 8]. К факторам риска относятся высокий социально-экономический статус, избыточный вес [8].
Обнаружена ассоциация полиморфизмов некоторых генов (TXN, PRDX2, NR3C1, GRB2, PIK3C3, AP2B1, REPS) с особенностями гистологической и эндоскопической картины при ЭоЭн, функцией антимикробной защиты, уровнем интерлейкинов (ИЛ), степенью эозинофильной инфильтрации стенки органа [1, 9]. Считается, что лица, не подвергавшиеся поражению бактериальными инфекциями в детстве (в том числе неинфицированные Нelicobacter pylori), имеют более высокий риск формирования эозинофильных поражений ЖКТ [9, 10]. Основой патогенеза ЭоЭн считается аномальная эозинофильная инфильтрация тканей [1, 10, 11]. Эозинофилы присутствуют в собственной пластинке слизистой ЖКТ в норме, за исключением пищевода. Их количество в норме возрастает по направлению к дистальным отделам ЖКТ, достигая максимума в слепой кишке и аппендиксе, и несколько уменьшается в толстой кишке [1, 11, 12]. Процесс созревания, миграции, активации эозинофилов опосредуется с помощью Т-хелперов-2, ИЛ (например, ИЛ-1, 3, 4, 5), хемоаттрактантов (например, эотаксина) [1, 8, 12].
В стенке кишки происходит дегрануляция эозинофилов, высвобождение белков (эозинофильная пероксидаза, эозинофильный нейротоксин, эозинофильный катионный белок), медиаторов (лейкотриены), способствующих повышению проницаемости сосудов, повреждению эпителия, а также развитию фиброза, ремоделирования тканей [8, 12].
Определенное значение в патогенезе ЭоЭн имеют В-лимфоциты, IgE, тучные клетки. Изучается роль тимического стромального лимфопоэтина, а также связывающего сиаловую кислоту иммуноглобулин-подобного лектина 8 (Siglec-8) [11, 13].
Для постановки диагноза ЭоЭн требуется соблюдение трех критериев: клинические признаки, эозинофильная инфильтрация стенки кишки по данным гистологического исследования, отсутствие признаков вторичного эозинофильного поражения [1, 10].
Выраженность симптомов ЭоЭн зависит от степени поражения отдела тонкой кишки, а также глубины эозинофильной инфильтрации [12].
Мукозальный (слизистый) подтип ЭоЭн считается преобладающим (45–80% случаев) и проявляется диареей, болью в животе, тошнотой, рвотой, которые наблюдались в приведенном нами клиническом примере. Могут развиваться синдром мальабсорбции (гипоальбуминемия, анемия, потеря веса), изъязвление тонкой кишки, желудочно-кишечное кровотечение [1, 10, 12].
Мышечный подтип (12–30% случаев) сопровождается развитием признаков обструкции, тонкокишечной непроходимости (боль и вздутие живота, рвота, инвагинация, перфорация стенки кишки) [1, 12, 13].
В случае поражения серозной оболочки (12–40% случаев) появляется асцит (с эозинофилией асцитический жидкости), который также наблюдался у нашей пациентки [1, 12, 13].
Эозинофильное поражение ДПК может сопровождаться воспалительной обструкцией протока поджелудочной железы, что повышает риск развития панкреатита [1, 8]. Тяжесть клинической симптоматики не всегда коррелирует с выраженностью эозинофильной инфильтрации [14]. В 10–12% случаев наблюдается сочетанное эозинофильное поражение различных отделов ЖКТ [14]. Более 50% пациентов имеют сопутствующие атопические заболевания (бронхиальная астма, экзема, ринит, атопический дерматит, пищевая аллергия), а также отягощенный семейный анамнез по атопии [1, 8].
В настоящее время не предложено универсального биомаркера ЭоЭн [1]. Эозинофилия периферической крови не отражает тяжести поражения тканей, эффективности терапии, используется в качестве вспомогательного показателя [8, 10].
Вместе с тем эозинофилия асцитической жидкости (обычно более 50%) является критерием поражения серозной оболочки кишки [1].
Фекальный кальпротектин исследуется с целью дифференциальной диагностики, поскольку не отражает степени тяжести эозинофильной инфильтрации [1, 8].
В качестве перспективных биомаркеров, коррелирующих с активностью заболевания, изучаются тимический стромальный лимфопоэтин, ИЛ-5, ИЛ-33, эотаксин 1 [13, 14]. При эндоскопическом исследовании могут быть обнаружены неспецифические изменения слизистой оболочки тонкой кишки – гиперемия, разрыхление, отечность, зернистость, кровоточивость, а также утолщение складок, отек илеоцекального клапана, эрозии и язвы (в том числе с кровотечением, перфорацией), не отвечающие на антисекреторную терапию. Слизистая оболочка тонкой кишки может оставаться интактной в 67–83% случаев [1, 8].
С целью уточнения глубины инфильтрации стенки органа и наличия осложнений применимы КТ, магнитно-резонансная томография, в том числе с контрастным усилением, эндоскопическая ультрасонография [15]. По данным КТ могут быть отмечены: утолщение стенок, сужение либо расширение тонкой кишки, лимфоаденопатия, асцит [8]. Перспективным считается применение позитронно-эмиссионной томографии (ПЭТ) / КТ [12].
Множественные биоптаты для гистологического исследования при ЭоЭн получают из ДПК, подвздошной кишки (в том числе из интактной слизистой оболочки), размещая их отдельно в специально маркированные контейнеры [1, 8, 15].
Согласно клиническим рекомендациям, пороговые значения количества эозинофилов при высоком увеличении различаются в разных отделах ЖКТ. В биоптате ДПК они составляют более 50 eos/0,27 мм2, в терминальном отделе подвздошной кишки – более 60 eos/0,27 мм2 [1, 8]. Могут наблюдаться также криптит, гранулемы, дегрануляция эозинофилов, инфильтрация подслизистого и мышечного слоев. Признаками хронического эозинофильного воспаления являются атрофия, фиброз слизистой оболочки, удлинение/разветвление/деформация крипт [1, 10, 12].
В рамках дифференциальной диагностики ЭоЭн рассматриваются кишечные гельминтозы, пищевая аллергия, неоплазии, воспалительные заболевания кишечника, ревматические заболевания (эозинофильный гранулематоз с полиангиитом, системная красная волчанка, ревматоидный артрит, синдром Шегрена), гиперэозинофильный синдром, целиакия. Эозинофилия тканей может выявляться у пациентов, получающих иммуносупрессивную терапию после трансплантации органов [12, 13].
В настоящее время недостаточно рандомизированных, плацебо-контролируемых исследований лечения ЭоЭн [8]. Целями лечения ЭоЭн считаются: улучшение самочувствия, эндоскопических и гистологических показателей, предотвращение осложнений [1, 13]. В 40% случаев возможна спонтанная ремиссия заболевания [15]. Считается, что элиминационные диеты могут приводить к клиническому улучшению у части пациентов, однако данные о гистологическом ответе ограниченны. Используется эмпирическая диета 6 FED (Six-food Elimination Diet) с исключением шести наиболее распространенных пищевых аллергенов (молочные продукты, пшеница, яйца, соя, рыба, орехи). Данная диета дефицитна по ряду нутриентов, психологически трудно переносится и применима под руководством диетолога. После достижения ремиссии рекомендуется постепенный возврат к сбалансированному рациону. В детской популяции применяется элементарная диета [1, 12, 15].
Для индукции ремиссии применимы системные глюкокортикоиды (преднизон перорально в дозе 0,5–1 мг/кг с максимальной дозой 40 мг в течение двух недель с последующим снижением дозы в течение двух – восьми недель после достижения клинического улучшения) [15, 16].
В 25–60% случаев возможен рецидив заболевания с необходимостью поддерживающего лечения глюкокортикоидами в минимальной дозе. У 15% пациентов может развиться стероидозависимость [1, 13].
Пациентам с поражением подвздошной кишки и восходящего отдела толстой кишки назначают будесонид в дозе 9 мг/сут, с последующим снижением до 6 и до 3 мг/сут для поддерживающей терапии [15, 16].
В настоящее время изучается эффективность биологических препаратов (меполизумаб, реслизумаб, инфликсимаб, адалимумаб, ведолизумаб, омализумаб) при лечении ЭоЭн. Оценивается активность препарата дупилумаб (человеческие моноклональные антитела, подавляющие сигнальные пути ИЛ-4 и ИЛ-13), который применяется в настоящее время при эозинофильном эзофагите и тяжелых аллергических заболеваниях [16, 17].
Перспективным считается применение антител к Siglec-8 (AK002), подавляющих активность эозинофилов, тучных клеток и способствующих регрессу клинических симптомов [11].
При развитии стриктуры тонкой кишки в дополнение к медикаментозному рассматривается хирургическое лечение (эндоскопическая дилатация, сегментарная резекция с формированием анастомоза) [1, 18, 19].
Предикторами частых рецидивов ЭоЭн считаются периферическая эозинофилия, изъязвление слизистой оболочки [1, 15].
По результатам когортного исследования 2022 г., у пациентов с ЭоЭн выявлен повышенный риск смерти, связанной с раком. Вместе с тем не обнаружено корреляции между локализацией рака и эозинофильного поражения [1, 7].
В приведенном нами клиническом примере проявления ЭоЭн имели интермиттирующий характер и расценивались в разные сроки госпитализации как признаки пищевой токсикоинфекции, острого панкреатита, неверифицированного колита, чему не противоречил быстрый регресс клинических проявлений на фоне неспецифической симптоматической терапии. У пациентки наблюдались типичные факторы риска (женский пол, избыточная масса тела, возраст 30–50 лет); клинические и гистологические данные свидетельствовали в пользу мукозального подтипа поражения с вовлечением в процесс серозной оболочки (асцит). При подсчете в большом увеличении микроскопа количество эозинофилов в тонкой кишке превышало известные пороговые значения. В ходе обследования были исключены иные причины тканевой эозинофилии. Лечение, проведенное в соответствии с клиническими рекомендациями, оказало положительный эффект.
Заключение
Эозинофильный энтерит – редкое заболевание, которое рассматривается в спектре дифференциальной диагностики у пациентов с «кишечными» жалобами, верифицируется на основании клинических, морфологических данных при отсутствии вторичных причин эозинофилии. В качестве метода лечения в настоящее время используется гормонотерапия, перспективным считается применение биологических препаратов. В описанном нами клиническом случае заболевание протекало под маской пищевой токсикоинфекции и острого панкреатита. Диагноз был поставлен спустя девять лет от момента дебюта заболевания на основании результатов гистологического исследования биоптата из неизмененной слизистой оболочки тонкой кишки при исключении иных причин тканевой эозинофилии.
Информация о финансовой поддержке. Работа выполнена без финансовой поддержки.
Конфликт интересов. Авторы заявляют об отсутствии возможных конфликтов интересов.
Согласие пациента. От пациентки было получено письменное добровольное информированное согласие на публикацию фотографий, результатов обследования и лечения.
I.V. Kozlova, PhD, Prof., A.L. Pakhomova, PhD, T.A. Tikhonova, PhD, A.M. Napsheva, PhD, L.I. Lekareva, PhD
Saratov State Medical University named after V.I. Razumovsky (Razumovsky University)
Contact person: Tatyana A. Tikhonova, jdipisma@mail.ru
The article is devoted to the pathogenesis, clinical picture, diagnosis and treatment of eosinophilic enteritis.
Using the example of a clinical case, we demonstrate the difficulties of diagnosing the mucosal and serous forms of eosinophilic enteritis. The episodes of the disease were intermittent and were regarded as manifestations of food poisoning and acute pancreatitis. The diagnosis was verified based on histological data, 9 years after the onset of the disease. During the examination, other causes of tissue eosinophilia were excluded.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


