Особенности использования данных о резистентности уропатогенов как критерия выбора антибактериальной терапии инфекций мочевыводящих путей
- Аннотация
- Статья
- Ссылки

Заболеваемость ИМП зависит от пола и возраста пациентов. Хорошо известно, что ИМП в 15-20 раз чаще встречаются у женщин, и только у пациентов старше 60 лет это соотношение изменяется за счет увеличения частоты ИМП, развивающихся у мужчин на фоне доброкачественной гиперплазии предстательной железы. Показано, что частота возникновения ИМП среди женщин в возрасте 18-40 лет составляет 0,5-0,7 случаев в год. К 24 годам у трети женщин развивается по крайне мере один подтвержденный при осмотре врача эпизод ИМП, требующий назначения антимикробной терапии (2).
В исследовании СОНАР (2005-2006 гг.) нами впервые были собраны и проанализированы данные о распространенности неосложненных ИМП в России, Республике Беларусь, Казахстане, Кыргызии, Таджикистане. При обследовании 2160 женщин установлено, что к 18-20 годам, по крайней мере, один эпизод цистита развивается у 18,8% женщин, а с возрастом распространенность этой нозологической формы возрастает. Также подтверждена широкая распространенность рецидивирующих форм ИМП, прежде всего цистита, установленная ранее зарубежными авторами. Показано, что после перенесенного цистита, в течение последующего года как минимум один рецидив цистита развивается у 49,4% женщин, два эпизода – у 27,7%, три эпизода – у 12,8%.
С другой стороны, анализ назначения антимикробных препаратов по поводу ИМП показывает, что в амбулаторной практике врачи допускают ошибки в 40-50% случаев. В фармакоэпидемиологической части исследований UTIAP нами было установлено, что наиболее частой ошибкой является игнорирование локальных данных по антибиотикорезистентности основных уропатогенов (17, 10, 18).
Известно, что от большинства лекарственных препаратов антибиотики отличаются тем, что на этапе постмаркетингового изучения препарата может произойти существенный пересмотр его места в терапии тех или иных инфекций. Это обусловлено наличием у антимикробных препаратов особенности, типичной только для этой группы лекарственных средств – снижение активности с течением времени. В связи с этим на всех этапах оценки антимикробных препаратов, особенно после начала их широкого применения в клинической практике, проводят эпидемиологические исследования, позволяющие оценить распространенность наиболее устойчивых возбудителей.
Способность микроорганизмов формировать устойчивость к антибиотикам сопряжена с рядом негативных последствий как для отдельных пациентов, так и для общества в целом. Так, при устойчивости возбудителя инфекции к антибиотикам, возрастает вероятность неудачи эмпирического лечения конкретного пациента (2).
Применительно к ИМП, практический интерес представляют прежде всего исследования устойчивости E.coli – основного уропатогена, выделенного от пациентов с неосложненными ИМП внебольничного происхождения. При проведении подобных исследований могут анализироваться как различные популяции пациентов – взрослые, дети, беременные, так и различные формы ИМП – цистит, пиелонефрит, бессимптомная бактериурия и др.
Наиболее распространенным показателем, используемым для описания подобных эпидемиологических данных, является термин «резистентность» или «уровень резистентности». Под этим термином понимают частоту выявления уропатогенов (обычно E.coli) в популяции, резистентных к тем или иным антимикробным препаратам. Например, если из 100 исследованных штаммов E.coli 36 резистентны in vitro к ампициллину, говорят, что резистентность E.coli к ампициллину составляет 36%.
Сегодня в России накоплено достаточно данных как по структуре возбудителей ИМП, так и по состоянию резистентности этих возбудителей к антибактериальным препаратам. Например, подобные данные в России были получены нами в ходе многоцентровых эпидемиологических исследований UTIAP-1, -2, -3 (1998-2005 гг.).
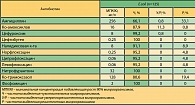
Как видно из таблицы 1, у пациентов с неосложненными ИМП в России отмечается высокая частота выделения резистентных штаммов E. coli к ампициллину (33,1%) и ко-тримоксазолу (19,4%). Установлен относительно высокий уровень резистентности к нефторированным хинолонам (налидиксовая к-та) – 8,9%, при этом фторированные хинолоны обладают высокой активностью. Выявлена одинаковая частота выделения резистентных штаммов для препаратов II поколения (норфлоксацин, ципрофлоксацин) и III поколения (левофлоксацин) – 4,8%. Резистентные к амоксициллину/клавуланату штаммы были выделены в 0,8% случаев. Не выявлено резистентных штаммов к пероральным цефалоспоринам II-III поколения (цефуроксим, цефтибутен), нитрофурантоину, фосфомицину.
Однако после получения данных о резистентности уропатогенов возникает закономерный вопрос об их интерпретации прежде всего с клинических позиций – как связан уровень резистентности и клиническая/микробиологическая эффективность терапии ИМП? Необходимо отметить, что в отношении уропатогенов такое значение существует только для интерпретации резистентности E.coli к триметоприму/ко-тримоксазолу. В частности, наиболее авторитетные руководства по терапии ИМП не рекомендуют использовать ко-тримоксазол (триметоприм) как препарат выбора при неосложненных ИМП, если уровень резистентности E.coli к этому антибиотику превышает 10-20% (7). Это критическое значение, применяемое для оценки уровня резистентности E.coli к триметоприму и ко-тримоксазолу, имеет клиническое обоснование, полученное в нескольких исследованиях.
В хорошо известном исследовании R.Raz и соавт. (2002 г.) были проанализированы клиническая и микробиологическая эффективность ко-тримоксазола назначаемого в дозе 960 мг дважды в день у женщин с острым неосложненным циститом в зависимости от наличия или отсутствия у возбудителя устойчивости к ко-тримоксазолу (5). Оказалось, что клиническая эффективность терапии составила 88%, если цистит был вызван чувствительными штаммами, и 54%, если заболевание вызывали резистентные бактерии. Различия были статистически достоверными. При анализе бактериологической эффективности были выявлены еще большие различия – эрадикация возбудителя достигалась в 86% случаев, если уропатогены были чувствительны к препарату, и только в 42%, если резистентны.
В исследовании Masterton et al. (1995 г.) были проанализированы данные 135 женщин с острым неосложненным циститом, получавших терапию ко-тримоксазолом в течение 7 дней (19). У 12% пациенток были выделены уропатогены, резистентные к ко-тримоксазолу. У этих пациенток эрадикация возбудителя спустя 7 дней после окончания составила 50%, тогда как в группе пациентов, у которых выделялись чувствительные к ко-тримоксазолу уропатогены, этот показатель составил 86%.
В исследовании McCarty et al. (1999 г.) было показано, что у пациенток получавших терапию ко-тримоксазолом в дозе 960 мг два раза в сутки в течение 3 дней, эрадикация ко-тримоксазол-резистентного возбудителя имела место в 60% случаев, а клиническая эффективность – в 50%. При терапии ко-тримоксазол-чувствительных ИМП – 93% (20).
На основании данных, полученных в описанном выше исследовании, K. Gupta и др. (2001 г.) (21) разработали математическую модель, которая позволила установить, что уровень резистентности уропатогенов в популяции к ко-тримоксазолу равный 10% обуславливает бактериологическую неэффективность терапии у 89%, а клиническую – у 92% пациентов. При уровне резистентности 20%, эти показатели эффективности терапии снижаются до 84% и 88% соответственно (22).
Таким образом, имеются убедительные данные, позволяющие утверждать, что клиническая и микробиологическая эффективность ко-тримоксазола в 1,6-3 раза ниже у пациентов с ИМП, вызванными резистентными возбудителями. К сожалению, подобные критерии для других препаратов, применяемых для терапии ИМП, не разработаны. В связи с этим достаточно часто встречаются две типичные ошибки при интерпретации уровня резистентности уропатогенов к тем или иным антибиотикам.
Первая ошибка связана с попытками использовать сравнение уровней резистентности уропатогенов в популяции в качестве критерия для сравнения эффективности антимикробных препаратов. Выполненные к настоящему времени исследования не дают основания использовать различия в уровнях резистентности как критерий для сравнения эффективности антимикробных препаратов. Другими словами, если в России резистентность E.coli к ципрофлоксацину составляет 4,8%, к нитрофурантоину – 0%, а к фосфомицину – 0%, то нельзя утверждать, что нитрофурантоин и фосфомицин более эффективны, чем ципрофлоксацин.
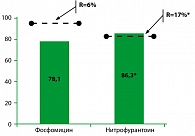
В качестве примера приведем результаты рандомизированного двойного слепого исследования, в котором сравнивали клиническую и бактериологическую эффективность макрокристаллического нитрофурантоина 100 мг в течение 7 суток и фосфомицина 3,0 г однократно при остром неосложненном цистите (9) (рисунок 1).
Как видно из рисунка, несмотря на то, что уровень резистентности уропатогенов к фосфомицину достоверно ниже, чем к нитрофурантоину (6% и 17%, p<0,05), эрадикация возбудителя достоверно чаще отмечалась при использовании нитрофурантоина, чем фосфомицина (86,3% и 78,1%, p<0,05). Объяснение этого результата кроется скорее всего в особенностях фармакокинетики препаратов, прежде всего в способностях создавать высокие концентрации не столько в моче, сколько в слизистой мочевого пузыря. Возможно, более низкая эффективность фосфомицина связана с применением препарата в виде одной дозы.
Возвращаясь к списку антимикробных препаратов, приведенных в таблице 1, необходимо отметить, что учет уровня резистентности позволяет исключить из нее препараты, к которым сформировался высокий уровень резистентности – аминопенициллины и ко-тримокзасол, но не позволяет установить, какой из оставшихся препаратов наиболее эффективен. В свою очередь, достоверные данные по сравнительной эффективности антимикробных препаратов можно получить только при проведении качественных, прежде всего рандомизированных клинических исследований.
Вторая ошибка связана с попытками использования критичного уровня резистентности, разработанного для триметоприма (10-20%), при оценке уровня резистентности других антибиотиков, например, фторхинолонов. Нужно отметить, что ответ на вопрос, как связана клиническая/микробиологическая эффективность терапии ИМП с уровнем резистентности уропатогенов, выявленных при проведении эпидемиологических исследований, не является простым и однозначным.
При классификации микроорганизмов, выделенных из клинических образцов, сравнивают минимальную подавляющую концентрацию (МПК) для каждого отдельного штамма с пограничными концентрациями (ПК), разработанными для отдельных антибиотиков. Если значение МПК ниже или равно нижнему значению ПК – препарат расценивается как чувствительный, если превышает верхнее значение – резистентный, если МПК находится между верхним и нижним значением ПК – штамм является умереннорезистентным. На сегодняшний день существует достаточно большое число нерешенных проблем, связанных с определением чувствительности уропатогенов к антибиотикам.
- ПК не являются некой абсолютной величиной, более того, они зависят от способа их разработки, который, в свою очередь, определяется организацией-разработчиком ПК. В настоящее время для определения ПК существует несколько процедур, разработанных различными организациями. В США Институтом кинических лабораторных стандартов (CLSI) разработаны процедуры определения ПК, которые являются стандартом для многих стран мира. Во многих европейских странах существуют свои процедуры определения ПК и, соответственно, свои величины ПК. Например, во Франции это стандарты Comite de l Antibiogramme de la Societe Francaise de Microbiologie (CASFM), в Германии их разрабатывает German Institute for Standardisation (DIN). В последние годы обозначилась тенденция к гармонизации европейских процедур по определению величин ПК. Эта работа координируется European Committee on Antimicrobial Susceptibility Testing (EUCAST). Однако целью настоящей публикации не является детальный анализ процедур определения критериев интерпретации чувствительности уропатогенов. Мы хотели бы подчеркнуть, что процедуры определения ПК очень далеки от совершенства и могут различаться в разных странах (таблица 2).
- Процесс разработки ПК базируется, в основном, на данных фармакокинетики (ФК) и фармакодинамики (ФД) антимикробных препаратов и мало учитывает клинические данные. Как правило, для выработки ПК используются полуколичественные подходы, моделирование, экспертные оценки. Все эти методы весьма далеки от категорий доказательной медицины и могут использоваться для прогнозирования эффективности терапии с большой осторожностью.
- Большая часть ПК разработана исходя из того, что концентрация антимикробного препарата в месте инфекции соответствует концентрации этого препарата в крови. Однако для многих инфекций, прежде всего для ИМП, это допущение требует пересмотра. Известно, что концентрации многих антибиотиков, например фторхинолонов, в моче в десятки раз выше, чем в крови. Например, максимальная сывороточная концентрация норфлоксацина после приема стандартной терапевтической дозы 400 мг составляет 1,58 мг/л, а максимальная концентрация препарата в моче – 417 мг/л (12), т. е. более чем в 260 раз выше. Для левофлоксацина концентрации в крови/моче составляют 4,5/166 мг/л (13). С другой стороны, не для всех форм ИМП концентрации антибиотика в моче являются определяющим фактором. Так, в случае пиелонефрита, многих осложненных ИМП, гнойно-деструктивных заболеваний почек, уросепсисе решающее значение имеют сывороточные концентрации антибиотика. Предполагается, что концентрация антибиотика в моче имеет принципиальное значение только при неосложненных формах ИМП. В связи с этим в 2007 г. Британское общество по химиотерапии (BSAC) пересмотрело рекомендации по интерпретации чувствительности микроорганизмов, выделенных при ИМП (таблица 2).
Очевидно, что решение обсуждаемой проблемы впереди. Можно предположить, что для определения того, как будет меняться эффективность антибиотиков при росте резистентности уропатогенов в популяции, необходимо проведение соответствующих когортных исследований, подобных описанным выше.
Таким образом, особое место при выборе антимикробных препаратов у пациентов с ИМП занимает оценка уровня резистентности основных уропатогенов, что позволяет исключить из числа препаратов выбора антибиотики, к которым отмечается высокий уровень резистентности. В России к таким препаратам относятся ампициллин, амоксициллин, ко-тримоксазол, нитроксолин. Для ко-тримоксазола (триметоприма) установлена зависимость между уровнем резистентности уропатогенов и эффективностью терапии, для других препаратов, применяемых при ИМП, такая зависимость не изучалась. Для сравнения эффективности антимикробных препаратов целесообразно использовать результаты рандомизированных клинических исследований, систематические обзоры и мета-анализы.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.