Особенности клинического течения и консервативного лечения хронического тонзиллита на современном этапе
- Аннотация
- Статья
- Ссылки
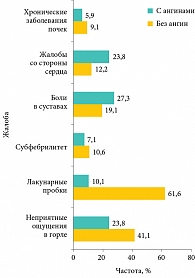
Для выяснения особенностей клинического течения ХТ в современных условиях мы проанализировали истории болезни 806 больных с ХТ, обратившихся в наш институт за консультацией. Оказалось, что только 1/5 больных (20,8%) имели в анамнезе ангины, причем больше 2 раз в году ангины встречались у 106 человек (13,2% от общего числа больных ХТ), 1–2 раза в год – у 56 (6,9%) и менее 1 раза – у 6 (0,7%). Мы разделили всех больных с ХТ на две группы: 168 больных с рецидивирующими ангинами (20,8%) и 638 больных с безангинной формой (79,2%). Данные по частоте их жалоб приведены на рисунке 1.
Как мы видим, в группе с рецидивирующими ангинами статистически значимо чаще встречаются боли в суставах и жалобы со стороны сердца, но реже беспокоят субфебрилитет, заболевания почек и лакунарные пробки по сравнению с безангинной формой ХТ. Неприятные ощущения в горле почти постоянного характера практически в 2 раза чаще беспокоят больных с безангинной формой ХТ. В группе с ХТ с ангинами неприятные ощущения в горле встречаются всего у 23,8% больных, как правило, в период между ангинами горло их не беспокоит. Обследование у кардиолога и ревматолога не выявило какой-либо органической патологии со стороны внутренних органов и систем, то есть указанные жалобы со стороны сердца и суставов были обусловлены функциональными изменениями.
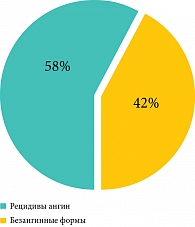
Анализ историй болезни 100 больных, госпитализированных с диагнозом «паратонзиллярный абсцесс» (то есть больных с осложнениями ХТ), показал, что 12% больных с паратонзиллярными абсцессами никогда в жизни не болели ангинами, 46% имели однократные ангины (либо ангины в детстве) и только 42% больных имели повторные ангины в анамнезе, причем у 12% из них ангины были частыми – более 2 раз в год (рис. 2). Эти данные подтверждают стертость клинической картины в течении ХТ. Только 42% больных с паратонзиллярными абсцессами имели классическую картину ХТ, сопровождающуюся рецидивами ангин. У остальных 58% больных паратонзиллярные абсцессы возникли на фоне вялотекущего ХТ (периодические боли в горле без повышения температуры, пробки в лакунах и т.д.). Только у 14% больных ангина предшествовала паратонзиллярному абсцессу или сопровождала его.
Таким образом, в настоящее время наиболее характерна безангинная форма ХТ, которая, по нашим данным, имеет место в 79,2% случаев данного заболевания. Безангинная форма ХТ характеризуется стертым началом, болезненными ощущениями в горле, выделением лакунарных пробок с неприятным запахом, различными функциональными расстройствами со стороны внутренних органов и систем. Тем не менее такая стертая форма заболевания может приводить к серьезным осложнениям, что четко прослеживается на примере больных с паратонзиллярными абсцессами.
В изменившихся условиях требуют пересмотра некоторые положения, касающиеся лечения ХТ, и прежде всего антибактериальной терапии. До сих пор среди оториноларингологов бытует мнение, что системная антибактериальная терапия при ХТ может применяться только при обострениях, то есть ангинах [1]. Однако преобладание в последние годы безангинной формы ХТ автоматически отсекает в лечении этих больных такой важный раздел, как системная антибактериальная терапия. Как известно, ХТ является полиэтиологичным заболеванием, то есть его могут вызвать не один, а множество микроорганизмов. Среди патогенов при ХТ наиболее часто обнаруживают стрептококки, стафилококки, пневмококки, палочку Пфейфера, моракселлу, аденовирусы, вирус Эпштейна – Барр, коксакивирусы, вирус герпеса, различные анаэробы, микоплазмы, хламидии, грибы [2–5]. Однако наиболее доказанной в этиологии ХТ и наиболее опасной в плане развития осложнений является роль бета-гемолитического стрептококка группы А (ГСА) [6, 7].
Для диагностики стрептококковой инфекции у больных ХТ наиболее часто используют микробиологические и иммунологические исследования. Микробиологические исследования включают посев и идентификацию культуры микроорганизмов. Иммунологическая диагностика стрептококковых инфекций, чаще всего в общеклинических лабораториях, ограничивается определением титра антител к стрептолизину О и гиалуронидазе. Истинные инфекции, вызванные стрептококком группы А, всегда вызывают специфический иммунный ответ – значительное повышение титра антител, по крайней мере к одному из внеклеточных стрептококковых антигенов [8]. Эти серологические реакции можно использовать для дифференцировки истинной инфекции и состояния носительства [9]. Определение антител к стрептолизину О и другим экстрацеллюлярным энзимам в диагностике стрептококковых заболеваний имеет то преимущество, что они выявляются в чувствительных и специфических реакциях нейтрализации энзимов и не дают перекрестных реакций. Возрастание титра начинается обычно вскоре после возникновения инфекции – через 1–2 недели; максимальный титр антистрептолизина О (АСЛ-О), как правило, регистрируется через 3–5 недель от начала заболевания [10], возврат к нормальным величинам происходит через 2–6 месяцев. Однако прием антибиотиков в острую фазу инфекции значительно снижает выраженность иммунного ответа, и подъем титра антител может быть гораздо меньше [10].
Наши исследования сыворотки крови у 3754 больных ХТ показали, что у 37,03% этих пациентов содержание АСЛ-О в ней повышено. Поскольку АСЛ-О представляет собой антитела распознавания антигена, а не элиминации, полученные данные свидетельствуют о том, что эти больные незадолго до обследования перенесли острую стрептококковую инфекцию или страдают ее хронической формой. Проанализировав данные анамнеза, мы обнаружили, что только у 7,3% пациентов с повышенным содержанием АСЛ-О в анамнезе имелись ангины. У остальных пациентов не было выраженной симптоматики острой стрептококковой инфекции, то есть они либо перенесли стрептококковую инфекцию в стертой форме, либо ГСА персистирует в организме. Результаты нашего исследования перекликаются с данными M.E. Pichichero [11], который обнаружил, что только 20–30% пациентов имеют классическую клиническую картину стрептококкового фаринготонзиллита. Большая часть фарингеальных инфекций, подтвержденных значительным повышением титра антистрептококковых антител, может характеризоваться весьма умеренной клинической симптоматикой или даже бессимптомным течением. Несмотря на это, они ассоциируются с риском поздних негнойных осложнений, таких как гломерулонефрит и ревматизм.
Результаты микробиологических исследований материала из глотки и лакун не всегда коррелировали с содержанием АСЛ-О. При ХТ частота обнаружения ГСА микробиологическими методами, по данным разных авторов, колеблется от 15 до 50% и зависит от времени года: так, наиболее часто ГСА определяется в небных миндалинах в холодное время года. Кроме того, по данным А. Ramirez [12], частота его обнаружения зависит от формы ХТ, поскольку наиболее часто ГСА встречается при рецидивах ангин.
По нашим данным, частота выделения ГСА из глотки у больных ХТ зависит, кроме вышеперечисленных, еще от трех факторов.
- Выделение стрептококков затруднено в тех случаях, когда в материале из глотки наряду с ними встречаются гемолитические стафилококки (Staphylococcus aureus), которые отличаются бурным ростом и буквально «забивают» колонии стрептококков.
- Культуральными методами не выделяются стрептококки, персистирующие внутриклеточно. Для их выделения нужны специальные микробиологические методы исследования. Несмотря на то что ГСА известен как экстрацеллюлярный патоген, он продуцирует и многочисленные инвазивные факторы, позволяющие проникать в тонзиллярные эпителиальные клетки [13]. А. Osterlund [14] обнаружил, что небные миндалины у детей с рецидивирующим тонзиллитом содержат стрептококки, находящиеся внутри клеток, и предположил, что этот лимфоидный орган может быть резервуаром для рецидивирующих инфекций. В этом случае ГСА доступен не всем антибиотикам и не может быть диагностирован обычными культуральными методами.
- Фактор характерен для нашей страны. У нас в большинстве лабораторий для посева микроорганизмов используются питательные среды с добавлением донорской крови (вместо эритроцитов барана). Донорская кровь может содержать антитела к ГСА, которые препятствуют росту указанных микроорганизмов. При проведении микробиологических исследований с использованием питательных сред с эритроцитами барана, а также специальных методов для выявления внутриклеточных микроорганизмов мы обнаружили бета-гемолитические стрептококки в глотке у 46,0% больных ХТ.
Как известно, стрептококковая инфекция является одной из самых опасных в плане развития осложнений со стороны внутренних органов и систем. Данное положение обосновывает необходимость системной антибактериальной терапии у больных ХТ при выявлении у них стрептококковой инфекции независимо от наличия ангин. Для лечения всех форм заболеваний, вызванных ГСА, обычно применяют препараты пенициллина, к которому сохраняется высокая чувствительность микроба. Однако на практике мы нередко наблюдаем отсутствие эффекта от природных и синтетических пенициллинов. Это обусловлено рядом причин, среди которых мы выделяем две основные.
- У большинства больных ХТ бета-гемолитические стрептококки встречаются в ассоциации с золотистым стафилококком (в 56,5% случаев). Поэтому ГСА, чувствительный к бета-лактамам in vitro, будет устойчив к указанной группе антибактериальных препаратов in vivo в связи с тем, что ассоциированный с ним золотистый стафилококк вырабатывает бета-лактамазу [15, 16], инактивирующую действие пенициллинов.
- Причиной неудач антибактериальной терапии может являться внутриклеточная персистенция стрептококков. Этим пациентам показано лечение антибиотиками, действующими на внутриклеточные формы микроорганизмов.
С учетом указанных особенностей антибактериальный препарат для лечения стрептококковой инфекции при ХТ должен обладать как способностью воздействовать на копатогенную флору (золотистый стафилококк), так и способностью проникать внутрь клеток. Этим требованиям удовлетворяют антибактериальные препараты группы макролидов [16]. Кларитромицин (Клацид), производимый фирмой Abbott Laboratories, обладает рядом выгодных преимуществ, выделяющих его среди других новых макролидов (диритромицина, рокситромицина, азитромицина). Он превосходит другие макролиды по своей активности против метициллин-чувствительных стафилококков, стрептококков, гемофильной палочки, моракселлы и легионеллы (основных возбудителей инфекций дыхательных путей) [17]. Не следует забывать, что при лечении инфекционного процесса антибиотики действуют не только на непосредственных возбудителей, но и на все чувствительные микроорганизмы микрофлоры. Длительное действие препарата способствует развитию резистентности, особенно если концентрации антибиотика на слизистых оболочках долго держатся на субингибиторном уровне [18]. Новые макролиды (азитромицин и кларитромицин) быстро достигают высоких концентраций в тканях. Но при этом после окончания курса лечения азитромицин, имеющий очень длительный период полувыведения (50–100 часов), в течение 4–6 недель присутствует в тканях в концентрациях, которые ниже минимальной ингибирующей и выше минимально активной. То есть препарат еще действует на бактерии и убирает чувствительные формы, но его концентрации не хватает для того, чтобы убить бактерии, которые генетически предрасположены к развитию устойчивости. В отличие от азитромицина, концентрации кларитромицина по окончании лечения быстро, в течение нескольких часов, падают ниже минимально активного порога, и препарат перестает действовать на микрофлору и индуцировать развитие резистентности [18].
Кроме того, следует отметить противовоспалительное и иммуномодулирующее действие кларитромицина за счет повышения им активности Т-киллеров, накапливания в нейтрофилах и макрофагах и усиления их фагоцитарной активности, а также миграции в очаг воспаления. Кроме того, кларитромицин влияет на окислительные реакции в фагоцитах и способствует их дегрануляции. Повышение активности фагоцитов имеет особое значение при лечении ХТ, так как многочисленными исследованиями показано, что наиболее часто при ХТ встречаются изменения фагоцитарной активности нейтрофилов. Противовоспалительный эффект кларитромицина связывают с повышением продукции противовоспалительного цитокина (интерлейкина-10) моноцитами, уменьшением выработки провоспалительных цитокинов моноцитами (интерлейкина-1, TNFα) и лимфоцитами (интерлейкина-2), снижением образования медиаторов воспаления – простагландинов, лейкотриенов и тромбоксанов. Противовоспалительное действие проявляется даже при субтерапевтических концентрациях и сравнимо с эффектом нестероидных противовоспалительных средств. В настоящее время в компании Abbott Laboratories разработана медленно всасывающаяся таблетированная форма кларитромицина (модифицированного высвобождения) по 500 мг, чтобы больные могли принимать антибактериальную терапию только раз в день, с целью добиться их большей приверженности терапии. Длительность курса антибактериальной терапии с целью эрадикации стрептококка, согласно рекомендациям ВОЗ, должна быть не менее 10 дней. Наши наблюдения показали, что адекватная системная антибактериальная терапия кларитромицином дает положительный эффект (как клинический, так и иммунологический) примерно в 70% случаев, что позволяет наблюдать за больным, отсрочив тонзиллэктомию. Повторные жалобы больного и выявление повышенных титров АСЛ-О требуют тонзиллэктомии.
В заключение отметим следующее. Стрептококковая инфекция встречается более чем у 1/3 больных ХТ. Клиническая симптоматика ее стертая и характеризуется отсутствием ангин. При выявлении стрептококковой инфекции микробиологическими и/или серологическими методами у больных ХТ показана системная антибактериальная терапия. Выбор антибактериального препарата должен базироваться на данных о наличии в лакунах небных миндали золотистого стафилококка (более чем у половины больных) и внутриклеточной персистенции бета-гемолитических стрептококков в ткани небных миндалин больных ХТ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.