Состояние врожденного и адаптивного иммунитета у пациенток с послеродовым эндометритом
- Аннотация
- Статья
- Ссылки
- English
Цель – определить особенности системного иммунитета у пациенток с ПЭ средней степени тяжести после самопроизвольных и абдоминальных родов с учетом различных вариантов микробных ассоциаций.
Материал и методы. На клинических базах Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого в период 2021–2023 гг. был проведен проспективный анализ показателей системного иммунитета в венозной крови 180 пациенток позднего послеродового периода. Иммунологические исследования проводились на цитофлуориметре Cytomics FC 500 с источником излучения в виде аргонового лазера с длиной волны 488 нм и твердотельным лазером с длиной волны 633 нм, а также на биохимическом анализаторе Sapphire 400. Статистический анализ осуществлялся в программе IBM SPSS STATISTICS с применением стандартных методик.
Результаты. В группе родильниц с ПЭ сочетанной этиологии в отличие от родильниц с ПЭ только бактериальной этиологии был повышен уровень лимфоцитов, СD3+45+Т-лимфоцитов, CD3+CD8+ цитотоксических лимфоцитов, CD3-CD16+56 NK-лимфоцитов. У родильниц с ПЭ смешанной этиологии после оперативных родов (в отличие от пациенток с ПЭ после самопроизвольных родов) определяются более высокие показатели лейкоцитов, лимфоцитов, СD3+45+Т-лимфоцитов, CD3-CD16+56 NK-лимфоцитов, CD3+CD8+ цитотоксических лимфоцитов, а также более высокий уровень С-реактивного белка (p < 0,05).
Заключение. Несомненно, проблема ведения пациенток с ПЭ крайне актуальна, причем клинически хуже прогноз у женщин после оперативного родоразрешения, поскольку операция ассоциируется не только с высоким риском контаминации раны, но и с факторами, снижающими как локальный, так и системный иммунитет. Полиэтиологичность патогенных агентов и иммунологические особенности макроорганизма в пуэрперии требуют дополнительной коррекции патогенетической терапии, а также включения в схемы лечения иммуномодулирующих препаратов.
Цель – определить особенности системного иммунитета у пациенток с ПЭ средней степени тяжести после самопроизвольных и абдоминальных родов с учетом различных вариантов микробных ассоциаций.
Материал и методы. На клинических базах Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого в период 2021–2023 гг. был проведен проспективный анализ показателей системного иммунитета в венозной крови 180 пациенток позднего послеродового периода. Иммунологические исследования проводились на цитофлуориметре Cytomics FC 500 с источником излучения в виде аргонового лазера с длиной волны 488 нм и твердотельным лазером с длиной волны 633 нм, а также на биохимическом анализаторе Sapphire 400. Статистический анализ осуществлялся в программе IBM SPSS STATISTICS с применением стандартных методик.
Результаты. В группе родильниц с ПЭ сочетанной этиологии в отличие от родильниц с ПЭ только бактериальной этиологии был повышен уровень лимфоцитов, СD3+45+Т-лимфоцитов, CD3+CD8+ цитотоксических лимфоцитов, CD3-CD16+56 NK-лимфоцитов. У родильниц с ПЭ смешанной этиологии после оперативных родов (в отличие от пациенток с ПЭ после самопроизвольных родов) определяются более высокие показатели лейкоцитов, лимфоцитов, СD3+45+Т-лимфоцитов, CD3-CD16+56 NK-лимфоцитов, CD3+CD8+ цитотоксических лимфоцитов, а также более высокий уровень С-реактивного белка (p < 0,05).
Заключение. Несомненно, проблема ведения пациенток с ПЭ крайне актуальна, причем клинически хуже прогноз у женщин после оперативного родоразрешения, поскольку операция ассоциируется не только с высоким риском контаминации раны, но и с факторами, снижающими как локальный, так и системный иммунитет. Полиэтиологичность патогенных агентов и иммунологические особенности макроорганизма в пуэрперии требуют дополнительной коррекции патогенетической терапии, а также включения в схемы лечения иммуномодулирующих препаратов.



Гнойно-воспалительные заболевания (ГВЗ) послеродового периода (ПП) не демонстрируют тенденции к снижению и в общей структуре осложнений пуэрперия могут достигать 18–20% [1–3]. Лидирующую позицию среди ГВЗ ПП занимает послеродовый эндометрит (ПЭ), причем в группах риска после абдоминальных родов его частота иногда достигает 25%, а в случае экстренного оперативного родоразрешения – 45% [2].
В связи с увеличением частоты выполнения абдоминального родоразрешения операция кесарева сечения (КС) считается определяющим фактором риска повышения частоты ГВЗ ПП. Несмотря на совершенствование методик, внедрение превентивных методов антибиотикопрофилактики и применение современного шовного материала, собственно оперативное вмешательство со вскрытием полости матки является заведомой угрозой контаминирования. По данным ряда исследований, в 25% КС необоснованно. В свою очередь сформировавшийся рубец на матке далеко не всегда обоснованное показание к оперативному родоразрешению [3–7].
Одними из самых грозных осложнений абдоминальных родов являются акушерский перитонит и сепсис. Несмотря на то что частота таких осложнений не превышает 2%, именно на эти случаи приходится максимальное число летальных исходов (15–40%) [8, 9].
Несомненно, своевременная диагностика и терапия – залог благополучного исхода с возможным сохранением репродуктивной функции при наличии условий: верифицированном и санированном первичном очаге инфекции (матка), непрогрессирующей полиорганной недостаточности, отсутствии клиники шока, наличии эффекта от системной консервативной терапии [9, 10]. Однако следует понимать, что тяжесть ГВЗ ПП и септических осложнений напрямую зависит не только от общесоматического состояния больной, хирургической ситуации, но и от состояния локального и системного иммунитета родильницы [9, 10].
Залог успешного течения послеродового периода закладывается во время имплантации. Так, на фоне нормально протекающей беременности изменяются механизмы взаимодействия между компартментами врожденного и адаптивного иммунитета. При этом факторы естественного иммунитета играют ведущую руль в иммунологической адаптации беременной [11]. Система врожденного иммунитета включает в себя эпителиальный барьер, гуморальные факторы (систему комплемента, лизоцим, растворимые белки – сурфактанты, дефензины, лизоцим и др.), клеточные элементы (естественные киллеры, макрофаги, дендритные клетки, нейтрофилы и др.) [12].
Типичный иммунный ответ инициируется клетками системы врожденного иммунитета, которая реагирует на экзогенные и эндогенные стимулы быстрее, чем система приобретенного (адаптивного) иммунитета [13–15]. В дальнейшем происходит активация провоспалительных цитокинов, что приводит к увеличению проницаемости сосудов, обеспечивая миграцию лейкоцитов и моноцитов из кровеносного русла в очаги воспаления [15]. Указанные процессы реализуются благодаря синтезу хемокинов активированными клетками врожденного иммунитета, а именно эпителиальными и дендритными клетками, нейтрофилами. Впоследствии наблюдается дифференцировка моноцитов в макрофаги, которые осуществляют фагоцитоз и элиминацию клеток, подвергшихся апоптозу [16]. Активированные макрофаги и дендритные клетки также являются антигенпрезентирующими клетками для клеток адаптивного иммунитета. При контакте с подвергшимися апоптозу клетками макрофаги способны выделять противовоспалительные цитокины: трансформирующий фактор роста бета и интерлейкин 10, ограничивающие очаг воспаления и индуцирующие репарацию тканей [17–19]. NK-клетки (натуральные киллеры), попадающие в очаг воспаления позже, чем макрофаги, обладают цитолитической и иммуномодулирующей активностью [17–19]. Таким образом, система врожденного иммунитета первой распознает патогены и обеспечивает адекватный иммунный ответ. В случае ее нормального функционирования воспалительный процесс способен к самоограничению и разрешается без избыточного повреждения тканей. При избыточной или недостаточной реакции системы врожденного иммунитета на патоген возникает неконтролируемое хроническое воспаление со значительным повреждением тканей. В результате развиваются тяжелые гнойно-воспалительные и септические состояния с высоким риском летального исхода [20].
Уже на ранних сроках беременности увеличивается число фагоцитов (гранулоцитов и моноцитов), усиливаются фагоцитоз, генерация активных форм кислорода [21–25]. При возникновении риска инфекционного осложнения активируются полиморфноядерные фагоциты, которые используют сходные с макрофагами механизмы бактерицидного действия с увеличением связывания и поглощения микроорганизмов в присутствии опсонизирующих факторов (антител и фрагментов комплемента) [26–30].
Таким образом, поддержание иммунологического баланса за счет взаимодействия макроорганизма беременной, плода, плаценты и компонентов врожденного и адаптивного иммунитета обеспечивает устойчивость к инфекционным агентам на протяжении не только периода беременности, родов, но и всего ПП.
Определяющим фактором в иммунном ответе является инициирующий агент. Доказано существование классических форм ответа на вирусную и бактериальную инфекцию. При вирусном поражении в состоянии иммунной системы наиболее часто имеют место более низкие по сравнению с бактериальной инфекцией уровни лейкоцитов, высокий лимфоцитоз, Т-клеточный иммунодефицит, в стадии обострения – высокие показатели NK- и T-NK-клеток. Содержание С-реактивного белка (СРБ) остается в пределах нормы или незначительно ее превышает. При этом ведущую роль в иммунном ответе играет длительный характер воздействия вируса, что зачастую сопровождается повышением уровня иммуноглобулина (Ig) G.
Ответ иммунной системы на бактериальные агенты, как правило, характеризует острый процесс, при этом иммунограммы демонстрируют высокий лейкоцитоз при низкой концентрации лимфоцитов, повышение уровня нейтрофилов, особенно за счет сегментоядерных форм. Количество Т-лимфоцитов (CD3+) может быть в пределах нормы или несколько превышать ее, количество NK-клеток не изменяется или незначительно снижается. При этом определяются высокие уровни СРБ и циркулирующих иммунных комплексов. У больных с бактериальным поражением повышаются уровни IgM, IgA и IgG. Однако зачастую у родильниц с гнойно-воспалительными осложнениями пуэрперия имеют место агенты микст-инфекций, что может отражаться на показателях иммунограммы и влиять на эффективность терапии.
Ввиду актуальности вопросов своевременной диагностики, лечения и профилактики послеродовых гнойно-воспалительных осложнений, особенно тяжелых септических форм, целью исследования стало изучение особенностей системного иммунитета у женщин с ПЭ.
Несмотря на то что по данной проблеме проводились как отечественные, так и зарубежные исследования, некоторые вопросы, касающиеся патогенеза и закономерностей иммунного ответа, остаются открытыми.
Цель – определить особенности системного иммунитета у пациенток с ПЭ средней степени тяжести после самопроизвольных и абдоминальных родов с учетом различных вариантов микробных ассоциаций.
Материал и методы
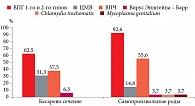
На клинических базах Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого в период 2021–2023 гг. был проведен проспективный анализ показателей системного иммунитета в венозной крови 180 пациенток позднего ПП. Из них – 50 женщин с неосложненным течением пуэрперия, 80 – с ПЭ средней степени тяжести, в частности 50 пациенток с ПЭ и сопутствующими вирусными инфекциями и 30 родильниц с ПЭ без сопутствующей вирусной нагрузки (рис. 1).
Микроорганизмы индентифицировали до вида методом MALDI-ToF масс-спектрометрии на аппарате Vitek MS (bioMérieux, Франция). Чувствительность к антибиотикам определяли диско-диффузионным методом на агаре Мюллера – Хинтона и автоматическим методом на микробиологическом анализаторе Vitek-2 compact (bioMérieux, Франция). Результаты интерпретировали в соответствии с текущей на момент тестирования выделенного изолята версией экспертных правил определения чувствительности Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST).
Разделение пациенток на группы проводили после получения результатов анализов ПЦР на определение вирусов папилломы человека (ВПЧ), простого герпеса (ВПГ) 1-го, 2-го и 6-го типов, Эпштейна – Барр, цитомегаловируса (ЦМВ).
Критериями включения были репродуктивный возраст, ПП до 28 суток включительно, диагноз средней формы ПЭ, самопроизвольные роды (СР) или роды путем операции КС.
Критерии исключения из исследования: поздний ПП (29–42-е сутки), легкая форма ПЭ, акушерский перитонит, акушерский сепсис, вагинит, воспалительные заболевания придатков матки, диагностированные инфекции, передаваемые половым путем, в том числе в ПП, новая коронавирусная инфекция во время беременности и в ПП в течение 21-й недели после родоразрешения.
Забор крови в группах исследования выполняли на 8–10-е сутки ПП.
Статистический анализ осуществляли с использованием программы IBM SPSS STATISTICS. Необходимый объем выборки определяли табличным методом. Нормальность распределения оценивали с помощью вычисления критерия Колмогорова – Смирнова с поправкой Лиллиефорса с уровнем критической значимости р > 0,05. В этом случае распределение признака считалось подчиняющимся закону нормального распределения. Описательная статистика представлена в виде качественных данных в процентах. Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (М) и стандартное отклонение (SD). При распределении признаков, отличающемся от нормального, описательную статистику представляли в виде медианы (Me) и интерквартильного интервала (Q1; Q3). Для сравнения трех и более независимых групп по одному количественному признаку в отсутствие нормального распределения применяли ранговый анализ вариаций по Краскелу – Уоллису. Для выявленных статистически значимых различий проводили апостериорный анализ или попарное сравнение групп с помощью критерия Манна – Уитни с поправкой Бонферрони для уточнения того, между какими именно группами имеются статистически значимые различия. Дизайн исследования представлен на рис. 2.
Результаты
Средний возраст женщин с ПЭ в группе СР составил 28 (25; 32,8) лет, после КС – 30 (25; 33) лет. При оценке клинико-анамнестических данных отмечалось, что в группе оперативных родов у 16 (24,6%) из 65 пациенток диагностирована анемия 1-й степени, в группе после СР – у 13 (20%) пациенток из 65 (p = 0,032). Пациентки всех групп были сопоставимы по основным параметрам репродуктивного и общесоматического статуса (p > 0,05). При этом у женщин с ПЭ после СР жалобы появлялись на 9-е (6; 13,2) сутки ПП. В частности, болезненность матки отмечалась у 15 (37,5%) пациенток из 40, кровянистые выделения из половых путей – у 12 (30%), гноевидные выделения – у 8 (20%) из 40 пациенток. В среднем выписка проходила на 19-е (16,3; 24) сутки ПП. При этом общее количество проведенных койко-дней составило 10 (8; 11).
У родильниц с ПЭ после КС срок гестации составил 40 (39; 41) недель и был сопоставим с таковым в группе сравнения (р = 0,18). При этом жалобы появлялись на 8-е (6; 12,8) сутки ПП. В частности, на болезненность матки указывали 16 (40%) пациенток из 40, на кровянистые выделения из половых путей – 19 (47,5%), на гноевидные – 9 (22,5%) пациенток из 40. Выписка в данной группе проходила на сутки позже – 20-е (17; 24,2), – чем в группе сравнения. Общее количество дней госпитализации составило 10 (9; 13).
При оценке сопутствующих инфекционных агентов отмечалось, что у женщин с ПЭ как после СР, так и после КС (по сравнению со здоровыми родильницами) чаще определялись активные формы ВПГ 1-го и 2-го типов (соответственно у 63 (78,8%) и 59 (73,8%) пациенток из 80), а также ВПЧ (соответственно у 14 (17,5%) и 22 (27,5%) пациенток из 80). При этом в 75% случаев диагностирована его клинически значимая концентрация (104 и более абсолютных копий ДНК/105 эпителиальных клеток). Следует отметить, что среди женщин после абдоминального родоразрешения в 2 (5%) случаях из 40 показанием к проведению операции КС было обострение генитального герпеса. При анализе данных анамнеза у трех родильниц с ЦМВ из 40, по данным ПЦР, ранее диагностировали этот вирус. В 1 (4,8%) случае из 21 беременность осложнилась маловодием, в 2 (9,5%) – многоводием. У одной пациентки после КС и ПЭ имелось указание на наличие ВИЧ и хронического вирусного гепатита С.
При определении перечня инфекционных агентов за основу были взяты клинические рекомендации «Послеродовые инфекционные осложнения» (2024), «Клинические рекомендации по диагностике и лечению заболеваний, сопровождающихся патологическими выделениями из половых путей женщин» (2019), «Хламидийная инфекция» (2021), «Нормальная беременность» (2024), «Клинические рекомендации ЕАУ-2023 по инфекциям мочевых путей».
Наиболее частыми показаниями к выполнению операции КС во всех группах исследования были рубец на матке после абдоминальных родов в анамнезе – 19 (29,2%) пациенток из 65 и незрелость родовых путей – 14 (21,5%) пациенток из 65. Преждевременный разрыв плодных оболочек зарегистрирован в каждом пятом случае – у 26 (20%) пациенток из 130. В одном случае в послеоперационном периоде диагностировали осложнение в виде абсцесса послеоперационной раны на передней брюшной стенке, в связи с чем пациентку перевели в гнойно-септический центр Краевой клинической больницы. Пациентки всех групп сравнения по данным параметрам были сопоставимы (р > 0,05).
Необходимо отметить, что удовлетворительное состояние в группах родильниц с ПЭ при поступлении отмечалось лишь у 30 (37,5%) из 80, состояние средней тяжести – у 49 (61,3%), тяжелое – у одной родильницы. При этом у пациенток с ПЭ после операции КС состояние средней степени тяжести наблюдалось значимо чаще, чем у женщин после СР, – у 63,3 и 37,1% соответственно (p = 0,023).
С учетом того, что в среднем клинические проявления ПЭ наступали на 8-е (6; 13) сутки ПП, забор крови в группе сравнения у здоровых женщин пуэрперального периода проводился на 8–10-е сутки ПП после планового осмотра акушером-гинекологом женской консультации. Транспортировка крови в ЦНИЛ осуществлялась в вакуумной пробирке с активатором свертывания и вакуумной пробирке с К2ЭДТА.
Иммунологические исследования выполнялись на цитофлуориметре Cytomics FC 500 с источником излучения в виде аргонового лазера с длиной волны 488 нм и твердотельным лазером с длиной волны 633 нм, а также на биохимическом анализаторе Sapphire 400.
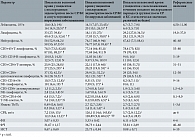
При анализе полученных данных установлено, что у пациенток с ПЭ по сравнению со здоровыми родильницами отмечались статистически значимые различия в полученных результатах – высокие уровни лейкоцитов, нейтрофилов и СРБ (p < 0,05) (табл. 1 и 2).
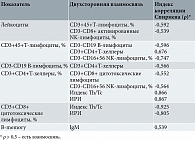
Наличие вирусных инфекций существенно влияет на показатели иммунограммы. Так, в группе родильниц с ПЭ сочетанной этиологии в отличие от родильниц с ПЭ только бактериальной этиологии был повышен уровень лимфоцитов, СD3+45+Т-лимфоцитов, CD3+CD8+ цитотоксических лимфоцитов, CD3-CD16+56 NK-лимфоцитов. При оценке показателей гуморального иммунитета в группе родильниц с ПЭ смешанной этиологии отмечались несколько повышенные уровни IgG (18,7 (8,68; 21,39) г/л), тогда как у пациенток с ПЭ бактериальной этиологии – более высокие значения IgM (3,56 (2,31; 5,56) г/л) (см. табл. 2). Это указывало на наличие острой или обострение хронической формы ряда инфекций.
Метод родоразрешения вносит определенные коррективы в работу клеточного и гуморального иммунитета. Так, у родильниц с ПЭ смешанной этиологии после оперативных родов (в отличие от пациенток с ПЭ после СР) определялись более высокие показатели лейкоцитов, лимфоцитов, СD3+45+Т-лимфоцитов, CD3-CD16+56 NK-лимфоцитов, CD3+CD8+ цитотоксических лимфоцитов, СРБ (p < 0,05).
У родильниц с ПЭ бактериальной этиологии после операции КС по сравнению с родильницами после СР уровень лейкоцитов был несколько выше (p < 0,05).
При проведении корреляционного анализа и оценки основных, наиболее часто исследуемых иммунологических параметров у женщин с ПЭ с сопутствующими вирусными инфекциями выявлены следующие взаимосвязи: обратная связь значения лейкоцитов с лимфоцитами (-0,592), с процентом CD3-CD8+ активированных NK-лимфоцитов (-0,539). В то же время в группе родильниц с ПЭ бактериальной этиологии высокие значения лейкоцитов прямо коррелировали с уровнем СРБ (0,696) и были обратно пропорциональны проценту СD3+45+Т-лимфоцитов (-0,613) и иммунорегуляторному индексу (-0,571). При этом следует отметить, что в группе смешанной этиологии послеродового эндометрита встречается намного больше прямых и обратных взаимосвязей с различными иммунологическими параметрами, чем в группе родильниц с ПЭ бактериальной этиологии (табл. 3 и 4).
Таким образом, в отличие от чисто бактериальной этиологии смешанный микробно-вирусный характер ПЭ ассоциируется с вовлечением в воспалительный процесс значимо большего количества звеньев адаптивного и врожденного иммунитета. Однако влияние бактериальных эндотоксинов сопровождается более выраженными изменениями в иммунном статусе, особенно за счет лейкоцитоза, лимфопении, снижения количества Т-хелперов при преобладающих значениях цитотоксических лимфоцитов.
Кроме того, оперативное родоразрешение вносит определенный вклад в работу адаптивного и врожденного иммунитета за счет как повышения, так и снижения параметров клеточного иммунитета. Это, несомненно, влияет на течение и прогноз не только гнойно-воспалительных, но и септических осложнений пуэрперия.
У женщин с ПЭ отмечается угнетение компонентов врожденного иммунитета за счет снижения NK-клеток. Следует отметить, что содержание лимфоцитов у больных этой группы повышено, в том числе за счет В-звена и Т-хелперов.
Сохраняющийся вторичный транзиторный иммунодефицит в первые десять суток ПП, углубление иммунодепрессии родильниц на фоне гнойно-септических заболеваний свидетельствуют о необходимости мобилизации у них защитных сил организма за счет воздействия на определенные звенья иммунной системы и общую систему гомеостаза.
Работа выполнена на базе центральной научно-исследовательской лаборатории Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого в рамках государственного задания НИОКТР в ЕГИСУ № 122040600142-6 по теме «Новые стандарты лечения гнойно-воспалительных послеродовых заболеваний матки с применением микробиологического тестирования актуальных возбудителей» сроком реализации в период 2022–2024 гг.
D.Ye. Galkina, PhD, D.V. Okladnikov, PhD, Ye.V. Okladnikovа, PhD, T.A. Makarenko, PhD, Prof., Ye.N. Bochanova, PhD, I.P. Iskra, PhD
V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
Central Scientific Research Laboratory of the Krasnoyarsk State Medical University
Contact person: Darya Ye. Galkina, dashsemch@mail.ru
Introduction. The most common in the general structure of purulent-inflammatory complications of the postpartum period is postpartum endometritis (PE), the percentage of which reaches maximum values in the group of patients after surgical delivery. Also, the leading role in the outcome of the disease is given to the peculiarities of the resistance of microbiological pathogens and the coordinated work of the local and systemic immunity of the pregnant woman and the maternity hospital.
Purpose to determine the characteristics of systemic immunity in patients with moderate PE after spontaneous and abdominal labor, taking into account various variants of microbial associations.
Material and methods. a prospective analysis of systemic immunity indicators in the venous blood of 180 patients of the late postpartum period was performed at the clinical bases of V.F. Voino-Yasenetsky Krasnoyarsk State Medical University in the period from 2021–2023. Immunological studies were carried out on a Cytomics FC 500 cytofluorimeter with a radiation source in the form of an argon laser with a wavelength of 488 nm and a solid-state laser with a wavelength of 633 nm and on a Sapphire 400 biochemical analyzer. The statistical analysis was performed using the IBM SPSS STATISTICS program using standard techniques.
Results. In the group of maternity hospitals with PE of combined etiology, in contrast to maternity hospitals with PE only of bacterial etiology, the percentage of lymphocytes, CD3+45+T lymphocytes, CD3+CD8+ сytotoxic lymphocytes, CD3-CD16+56 NK lymphocytes was increased. In women with PE of mixed etiology after operative delivery (unlike a subgroup of patients with PE after CP), higher rates of leukocytes, lymphocytes, CD3+45+T lymphocytes, CD3-CD16+56 NK lymphocytes, CD3+CD8+ cytotoxic lymphocytes, a higher rate of CRP are determined (p < 0.05).
Conclusion. Undoubtedly, the problem of managing patients with PE is extremely relevant, and the prognosis for women after surgical delivery is clinically worse, due to the fact that surgery is not only a high risk of wound contamination, but also a factor that reduces both local and systemic immunity. Polyethologicity of pathogenic agents and immunological features of the macroorganism in the puerperium requires additional correction of pathogenetic therapy, as well as the inclusion of immunomodulatory drugs in treatment regimens.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.