Особенности проведения внутривенной иммунотерапии в неврологической клинике
- Аннотация
- Статья
- Ссылки
- English
Внутривенная иммунотерапия, будучи неоспоримым методом лечения ряда аутоиммунных заболеваний нервной системы, уже прочно заняла свое место в протоколах ведения данной категории пациентов [1]. Эффективность внутривенной иммунотерапии (с высоким уровнем доказательности) подтверждена при таких нозологиях, как синдром Гийена-Барре, хроническая воспалительная демиелинизирующая полиневропатия, мультифокальная моторная невропатия, обострения миастении гравис и миастенические кризы. Внутривенная иммунотерапия при большинстве из этих состояний (синдроме Гийена-Барре, хронической воспалительной демиелинизирующей полиневропатии, миастении гравис) дает сравнимый с плазмаферезом результат, что было установлено в ходе рандомизированных сравнительных исследований [2–4]. Однако есть ситуации, когда введение внутривенных иммуноглобулинов (ВВИГ) является единственно доказанным эффективным методом лечения, например при мультифокальной моторной невропатии [5]. При изолированно моторной форме хронической воспалительной демиелинизирующей полиневропатии применение данного метода заметно увеличивает шансы на улучшение состояния.
В случаях, когда плазмаферез провести невозможно ввиду технических трудностей (необходимость транспортировки тяжелого пациента в специализированное отделение), а также при наличии противопоказаний или высоких рисков побочных эффектов внутривенная иммунотерапия становится единственным способом предотвращения жизнеопасных осложнений. В первую очередь речь идет о таких ограничивающих проведение экстракорпорального метода лечения состояниях, как эрозивно-язвенное поражение желудочно-кишечного тракта, обострение геморроя, менструация, тромбоцитопения, анемия. В этих случаях существует риск развития кровотечений на фоне введения больших доз гепарина (до 25 000–30 000 Ед), необходимых для осуществления самой процедуры забора крови, центрифугирования и возврата. Кроме того, по мнению экспертов Европейской федерации неврологических обществ, внутривенная иммунотерапия из соображений безопасности должна рассматриваться в качестве лечения первой линии во время беременности, а также у пожилых и ослабленных пациентов и детей [1]. Все вышеизложенное подтверждает актуальность подробного освещения вопросов проведения внутривенной иммунотерапии.
По данным Научного центра неврологии, опыт назначения ВВИГ имеется в половине участвующих в опросе неврологических отделений российских лечебно-профилактических учреждений, однако в каждом втором случае выбор препарата оказывается ошибочным. В этой связи целесообразно остановиться на вопросе выбора препаратов более подробно, поскольку во многом именно это и определяет эффективность и обеспечивает безопасность лечения.
Главные условия выбора препарата для иммунотерапии – это содержание иммуноглобулинов (Ig) класса G не менее 95%, минимальное содержание в препарате IgА и вирусная безопасность. Учитывая то, что для лечения аутоиммунных заболеваний нервной системы используется только высокодозная терапия, важным требованием является отсутствие ограничений по разовой и суточной дозе, а также максимально допустимая скорость введения, которая обеспечит возможность введения всего необходимого количества препарата в течение дня. На выбор препарата также влияют форма выпуска (лиофилизат для приготовления раствора или раствор, готовый для внутривенных инфузий), расфасовка, условия хранения и используемый стабилизатор.
Для обзора существующих на рынке ВВИГ, зарегистрированных в России, нами проведен анализ государственного реестра лекарственных средств. При введении в строке поиска «иммуноглобулин человека нормальный» было найдено 63 записи. После исключения препаратов с недействительным регистрационным удостоверением, а также форм для перорального приема и внутримышечного введения осталось 14 лекарственных средств (табл. 1). Все эти препараты представляют собой белковую фракцию, содержащую широкий спектр антител, полученных из плазмы крови доноров, проверенных на содержание антител к вирусам иммунодефицита человека типа 1 и 2, гепатита С, поверхностному антигену вируса гепатита В, то есть имеют достаточный уровень вирусной безопасности.
Анализ концентрации IgG показал следующее: в инструкциях к препаратам Габриглобин-IgG, Имбиоглобулин, Иммуновенин и Иммуноглобулин человека нормальный не содержится четких сведений о концентрации IgG, что не позволяет рекомендовать их для лечения пациентов с аутоиммунными заболеваниями нервной системы ввиду невозможности расчета терапевтической дозы. Для этих же препаратов отсутствует крайне важная информация о содержании IgA, от которой напрямую зависит безопасность пациента. Известно, что содержание у пациента антител к IgA – одна из причин анафилактических реакций на фоне внутривенной иммунотерапии, которые могут наблюдаться при первичных иммунодефицитах с селективной или неселективной гипоглобулинемией (IgA). В этой связи обязательно проводить исследование уровня IgA у пациентов перед введением препаратов, содержащих этот класс иммуноглобулинов, или если их содержание не прописано в инструкции. Второй причиной наличия у пациента антител к IgA являются повторные инфузии препаратов, содержащих IgA, к которым, в частности, относится Пентаглобин. Данный препарат занял отдельную нишу в интенсивной терапии – лечение тяжелых бактериальных инфекций (в комбинации с антибиотиками). Из-за достаточно высокого содержания IgA (6 мг в 1 мл), а также недостаточной концентрации IgG (38 мг, 76%) Пентаглобин не должен применяться в лечении аутоиммунных заболеваний.
Анализируя возможность проведения высокодозной терапии, следует отметить, что такие препараты, как Иммуновенин, Иммуноглобулин человека нормальный, Габриглобин (иммуноглобулин человека нормальный) не могут быть использованы для высокодозной терапии из-за ограничения разовой дозы. В инструкциях по применению в качестве максимальной указана доза от 25 до 50 мл для взрослых, не более 25 мл для детей, то есть больному в сутки разрешено вводить не более 2,5 г белка, что делает проведение высокодозной терапии этими препаратами невыполнимой задачей. Таким образом, в настоящее время лечение аутоиммунных заболеваний нервной системы можно с максимальной долей уверенности и безопасности проводить следующими препаратами: Октагам, Октагам 10%, Гамунекс, Гамунекс-С, Привиджен, Интратект, Интраглобин, Флебогамма 5%, И.Г.Вена.
При дальнейшем выборе должны учитываться такие обеспечивающие безопасность пациента аспекты, как концентрация, стабилизатор и допустимая максимальная скорость введения. Как видно из таблицы 2, существуют две разновидности растворов: 5%- и 10%-ные. Следует подчеркнуть, что форма выпуска и концентрация ВВИГ не влияют на эффективность и безопасность проводимой иммунотерапии. Комплексному анализу 10%-ных растворов препаратов IgG был посвящен ряд работ, показавших высокую степень их эффективности, безопасности и переносимости [6, 7, 8]. Не было выявлено никакой разницы между лиофилизатом и раствором для инфузий [9], между препаратами разной концентрации и разных производителей [10]. Однако необходимо отметить некоторые преимущества 10%-ных растворов по сравнению с 5%-ными, которые позволяют делать выбор в их пользу. Главное отличие более концентрированных растворов состоит в меньшем общем объеме вводимой жидкости. Это особенно актуально для высокодозной терапии и имеет решающее значение в педиатрической практике, у беременных, пациентов с сердечно-сосудистой, почечной патологией и в других случаях, требующих ограничения объема инфузий. У данной категории пациентов предпочтительны именно 10%-ные растворы препаратов нормального иммуноглобулина человека.
Важным аспектом является перечень показаний к применению того или иного ВВИГ, который лечащий врач не может не принимать во внимание. В инструкциях к этой группе препаратов аутоиммунные заболевания нервной системы встречаются нечасто. Так, синдром Гийена-Барре значится в инструкции к препаратам Октагам, Октагам 10%, Флебогамма 5%, Интратект, Гамунекс и Привиджен, хроническая воспалительная демиелинизирующая полиневропатия – к препаратам Гамунекс и Привиджен. Все остальные аутоиммунные неврологические заболевания относятся к категории off-label use (использование вне официально утвержденного перечня показаний).
Для включения в перечень показаний новой нозологии фармацевтическая компания должна доказать эффективность производимого ею препарата при данном заболевании в ходе широкомасштабных многоцентровых контролируемых клинических исследований, что является времязатратным, трудоемким и дорогостоящим мероприятием. В этой связи в клинической практике часто принимаются к сведению результаты исследований с использованием разных препаратов при одних и тех же нозологиях. При этом целесообразно обращать внимание на основное действующее вещество рассматриваемых лекарственных препаратов и учитывать тот факт, что не существует заметной разницы в эффективности, безопасности и переносимости между препаратами, сходными между собой по составу основного действующего вещества (IgG), содержанию IgA и разрешенными для введения больших суточных доз. Такая практика широко распространена за рубежом – до 30% лекарственных средств назначаются вне официальных показаний [11].
В нашей стране вопрос назначения лечения регламентируется приказом Минздравсоцразвития России от 23 марта 2012 г. № 252н. Следует отметить: все ВВИГ, зарегистрированные в России, включены в список ЖНВЛП. В настоящее время (декабрь 2014 г.) отсутствуют стандарты специализированной медицинской помощи, касающиеся аутоиммунных заболеваний нервной и нервно-мышечной системы (www.rosminzdrav.ru/ministry/61/22/stranitsa-979/stranitsa-983). Это значительно осложняет практическую работу с данной категорией больных, но не ограничивает повседневную работу врача-клинициста, имеющего дело с пациентами, в том числе требующими назначения внутривенной иммунотерапии. В связи с этим приведенные ниже аспекты, касающиеся расчета дозы и схемы введения препарата, не теряют актуальности.
Наличие мальтозы в отдельных ВВИГ (Октагам, Октагам 10%, Гамунекс и др.) влияет на показатели уровня сахара в крови, определяемые глюкометром. Этот факт необходимо учитывать при анализе лабораторных данных больного, особенно если он страдает сахарным диабетом. Для оценки истинного уровня глюкозы в крови пациента, находящегося на внутривенной иммунотерапии препаратами, содержащими мальтозу, а также для коррекции уровня гликемии сахароснижающими препаратами и инсулином должны использоваться только тест-полоски, не чувствительные к мальтозе (например, Акку-Чек Перформа). В противном случае существует риск случайно спровоцировать у пациента развитие гипогликемии.
При применении препаратов Гамунекс и Привиджен требуется иметь в виду характерный для этих препаратов повышенный риск гемолиза [12]. В некоторых случаях возможно развитие связанной с гемолизом почечной недостаточности. Соответственно, если принято решение об использовании препаратов Гамунекс или Привиджен, необходимо тщательно следить за уровнем гемоглобина и билирубина, количеством эритроцитов, а также осуществлять дополнительный контроль за функцией почек.
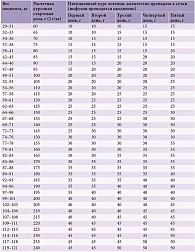
Принципы внутривенной иммунотерапии при всех аутоиммунных заболеваниях нервной системы одинаковы. При состояниях, требующих однократного курса лечения, таких как синдром Гийена-Барре, миастенический криз, препарат вводится в курсовой дозе 2 г/кг массы тела пациента. Такая же доза назначается в качестве стартовой (нагрузочной) при заболеваниях, требующих в дальнейшем повторных поддерживающих инфузий (хроническая воспалительная демиелинизирующая полиневропатия, мультифокальная моторная невропатия и др.), которые проводятся уже, как правило, в дозе 1 г/кг. Таким образом, для определения количества препарата для проведения стартовой терапии следует рассчитать курсовую дозу. С учетом вариантов расфасовки имеющихся на российском рынке препаратов ВВИГ (большинство из них по 5 и 10 г) полученную цифру требуется округлить в большую или меньшую сторону, сделав ее кратной пяти, после чего рассчитать количество флаконов (также в зависимости от содержащегося в одном флаконе количества граммов белка). Традиционно во взрослой практике расчетную курсовую дозу препарата делят на пять примерно равных частей и вводят внутривенно в течение пяти дней ежедневно. Расчетное количество препарата и приблизительные пятидневные схемы лечения приведены в таблице 3. Допустимы и другие схемы введения препарата (в течение двух или трех дней ежедневно), которые чаще используются в детской практике. Поддерживающие дозы ВВИГ (1 г/кг и менее) можно также вводить за два-три дня (ежедневно). На конечный выбор препарата для внутривенной иммунотерапии будет влиять также планируемое время инфузий, что напрямую зависит от дозы, концентрации препарата и максимально разрешенной скорости введения.
Максимально допустимая инструкцией скорость инфузии препарата – немаловажный фактор, что особенно актуально во взрослой практике, когда пациентам ежедневно вводится большое количество препарата (в среднем от 25 до 40 г). Как видно из таблицы 4, на сегодняшний день самая высокая допустимая скорость инфузии зарегистрирована для препаратов Октагам 10% и Привиджен. Суточная доза в 40 г может быть введена за 30 минут, тогда как для большинства других ВВИГ этот период времени увеличивается до четырех часов и более.
Перед началом терапии следует соблюдать еще одно важное условие. Если препарат хранился в холодильнике, то его необходимо довести до комнатной температуры (с помощью устройства для подогрева инфузионных растворов или оставить препарат при комнатной температуре на два-три часа). Для осуществления внутривенной инфузии достаточно иметь доступ к одной периферической вене и установить катетер иглу-бабочку. С целью соблюдения скорости введения, указанной в инструкции, целесообразно использовать инфузомат, однако допустимо введение и с помощью обычной капельницы, так как скорость инфузии препарата можно устанавливать в каплях/минуту (Интраглобин, И.Г.Вена).
Важно, что для осуществления внутривенной высокодозной терапии не требуется специальной квалификации врача и/или медицинской сестры или особых условий (обычно проводится в палате). В первый день инфузии пациент должен находиться под особенно пристальным наблюдением врача с целью отслеживания первых признаков побочных реакций. В истории болезни рекомендуется отмечать номер и серию партии вводимого препарата на случай возникновения нежелательных явлений.
Вначале устанавливается минимальная скорость введения ВВИГ, через 15–30 минут скорость может быть увеличена, а при условии хорошей переносимости и отсутствия побочных эффектов – с шагом в 15–30 минут постепенно доведена до максимально допустимой. При удовлетворительной переносимости терапии в первые сутки в последующие дни инфузию можно начинать сразу с максимальной скорости, достигнутой накануне. Если пациент никогда не получал ВВИГ или получал очень давно, а также если назначенное ранее лекарственное средство было от другого производителя, наблюдение врача должно осуществляться в течение всего периода времени, пока проводится инфузия, и в течение одного часа после ее окончания. Если же больному недавно уже вводился данный лекарственный препарат, то продолжительность наблюдения врачом после окончания инфузии может ограничиться 20 минутами. В течение всего периода внутривенной иммунотерапии следует контролировать диурез (с целью выявления олигурии – первого признака развивающейся почечной недостаточности), по окончании курса лечения и по необходимости определять уровень креатинина в крови (табл. 5).
Крайне важным аспектом является безопасность внутривенной иммунотерапии, высокий уровень которой при соблюдении правил выбора препарата и регламента назначения схемы лечения был подтвержден рядом клинических испытаний на разных категориях больных. Это положение подтверждается и собственными данными: из 120 инфузий, выполненных за последние три года, побочные эффекты наблюдались достаточно редко. Чаще всего (15%) регистрировались головные боли, купируемые пероральными или парентеральными нестероидными противовоспалительными препаратами и/или парацетамолом. Гораздо реже (5%) на фоне внутривенных инфузий наблюдалось возникновение парестезий, неприятных ощущений в области стоп (исчезли через пять дней самостоятельно). Ни в одном случае не было зарегистрировано серьезных побочных эффектов. Хорошая переносимость лечения позволила полностью завершить курс лечения в 100% случаев.
Внутривенная иммунотерапия за последние десять лет стала действительно эффективным и достаточно безопасным способом лечения ранее считавшихся некурабельными состояний. В отечественной неврологической практике этот метод занял прочные позиции. Залогом эффективности и безопасности введения ВВИГ является соблюдение ряда условий по выбору препаратов, расчету дозы, определению оптимальной схемы введения. Представленная в статье информация позволит клиницистам обоснованно назначать внутривенную иммунотерапию, обезопасит пациентов от возможных побочных эффектов.
Specific Features of Performing Intravenous Immunotherapy in Neurology Clinic
N.A. Suponeva, M.A. Piradov
Research Center of Neurology
Contact person: Natalia Aleksandrovna Suponeva, nasu2709@mail.ru
Here, we discuss main rules for selecting drugs as well as calculating theirs dosages and regimens for performing high-dose immunotherapy upon autoimmune diseases of nervous system. We present informative tables prepared in convenient way for practical use. In detail, we highlight characteristics of the drugs available on the Russian market, and elucidate their benefits and pitfalls.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.