количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
От первых исследований до инновационных технологий в контроле сахарного диабета
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №2 (22)
- Аннотация
- Статья
- Ссылки
За последние несколько лет отношение к применению инсулина у пациентов с сахарным диабетом (СД) 2 типа изменилось коренным образом: от подхода, предполагающего назначение инсулинотерапии на последнем этапе лечения, когда все другие возможности исчерпаны, до парадигмы, согласно которой базальный инсулин следует вводить уже на первом этапе интенсификации терапии. Доказано, что ранняя диагностика СД 2 типа и своевременное начало инсулинотерапии играют важную роль в решении проблемы контроля, улучшения течения заболевания и предотвращения развития его осложнений. Обсуждению контролируемых рисков и преимуществ ранней инсулинотерапии при СД 2 типа было посвящено одно из пленарных заседаний IX Московского городского съезда эндокринологов «Эндокринология столицы – 2013» (Москва, 28–30 марта 2013 г.), прошедшее под председательством главного эндокринолога Департамента здравоохранения г. Москвы, д. м. н., профессора Михаила Борисовича АНЦИФЕРОВА.

Профессор Г.Р. Галстян

Рис. 1. Смертность и макрососудистые риски в зависимости от уровня глюкозы плазмы натощак
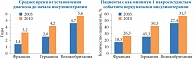
Рис. 2. Частота сосудистых осложнений СД и время начала инсулинотерапии
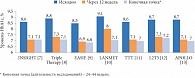
Рис. 3. Контроль уровня HbA1c в исследованиях, в которых инсулинотерапия была начата инсулином гларгин
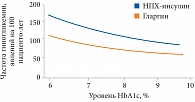
Рис. 4. Частота гипогликемии на фоне терапии инсулином гларгин и инсулином НПХ у пациентов с СД 2 типа (данные метаанализа 11 исследований)

Рис. 5. Влияние терапии инсулином гларгин на частоту гипогликемии и массу тела в зависимости от исходной терапии ПССП (данные объединенного анализа 11 исследований)

Профессор М. Ханефельд
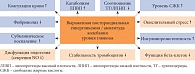
Рис. 6. Патофизиологические последствия дисгликемии
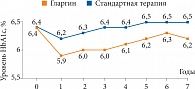
Рис. 7. Стабильность гликемического контроля на фоне терапии инсулином гларгин (данные исследования ORIGIN)

Рис. 8. Активная стратегия гликемического контроля, направленная на предотвращение прогрессирования СД 2 типа и развитие осложнений

Профессор А.М. Мкртумян
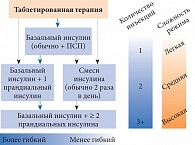
Рис. 9. Последовательность стратегии инсулинизации при СД 2 типа

Рис. 10. Эффективность инсулина глулизин при его добавлении к инсулину гларгин в режиме «базал +» у пациентов с СД 2 типа
Профессор Г.Р. Галстян.
Своевременное назначение базального инсулина: от исследований к клиническим рекомендациям
Существуют разные точки зрения на оптимальные сроки назначения инсулинотерапии, но в главном специалисты единодушны: врач должен в максимальном объеме использовать все возможности современной медицины.Своевременное назначение базального инсулина: от исследований к клиническим рекомендациям
Как отметил в начале своего выступления д. м. н., профессор Гагик Радикович ГАЛСТЯН (ФГБУ «Эндокринологический научный центр» Минздрава России, Москва), назначением базального инсулина контролируется, прежде всего, уровень гликемии натощак. Это важнейший показатель, тесно связанный со смертностью от сердечно-сосудистых заболеваний. Даже умеренное повышение уровня глюкозы плазмы натощак (выше 5,6 ммоль/л) увеличивает риск смерти в 1,5–2 раза, что влияет на жизненный прогноз пациентов с СД 2 типа (рис. 1)(1, 2).
Развитие осложнений СД 2 типа связано также с еще одной проблемой, остро стоящей во всем мире: у многих пациентов заболевание выявляется поздно, и они на протяжении долгого времени не получают необходимого лечения. Но и больным, получающим противодиабетическое лечение, далеко не всегда удается достичь целевых значений уровня гликемии. Применительно к СД 2 типа работает правило «пятидесяти процентов», согласно которому из 100 человек, страдающих этим заболеванием, только 50% поставлен диагноз. Из пятидесяти пациентов с диагностированным СД лишь 50% получают адекватное лечение. Из получающих адекватное лечение 25 пациентов только 50% достигают цели лечения. Среди них только у 50% при помощи лечения удается добиться реальной профилактики микро- и макрососудистых осложнений СД. Таким образом, важнейшей цели терапии удается достичь у 5–7% больных СД 2 типа.
Существуют данные, указывающие на то, что увеличение сроков инициации инсулинотерапии коррелирует с повышением частоты сосудистых осложнений (рис. 2)(3).
Именно поэтому назначение базального инсулина в дополнение к метформину для интенсификации терапии при недостижении терапевтических целей на монотерапии метформином включено в большинство международных рекомендаций. Более того, на протяжении последних лет, когда появление новых сахароснижающих препаратов влекло за собой изменение алгоритмов ведения пациентов с СД 2 типа, место базального инсулина в этих схемах оставалось неизменным (например, совместные рекомендации Американской диабетической ассоциации (American Diabetes Association, ADA) и Европейской ассоциации по изучению сахарного диабета (European Association for the study of diabetes, EASD) 2006(4), 2009(5) и 2012(6) гг.). Согласно новейшему документу ADA/EASD (2012), комбинация метформина и базального инсулина обладает самой высокой эффективностью по сравнению с добавлением к метформину препарата сульфонилмочевины (ПСМ), или тиазолидиндиона, или ингибитора дипептидилпептидазы 4-го типа (ДПП-4), или агониста глюкагоноподобного пептида 1 (ГПП-1). Однако в документе отмечено, что инсулинотерапия сопряжена с повышением риска развития гипогликемии и увеличением массы тела. Кроме того, стоимость инсулинотерапии напрямую зависит от режима введения и выбора препарата(6).
Каково же соотношение «польза/риск» и в каких случаях показано назначение базального инсулина?
В ходе многочисленных исследований была доказана целесообразность и высокая эффективность назначения базального инсулина гларгин в дополнение к пероральным сахароснижающим препаратам (ПССП) у пациентов с уровнем гликемии 8–9%. Благодаря этой терапевтической стратегии целевые значения гликированного гемоглобина (HbA1c < 7%) достигаются в течение 12 недель после начала лечения. Применение базального инсулина гларгин позволяет удерживать достигнутый уровень HbA1c на протяжении длительного времени (рис. 3)(7–13).
Кроме того, анализ данных 2193 пациентов, в течение 24 недель получавших инсулин гларгин с титрацией дозы на базовой терапии ПССП, показал, что чем ниже исходный уровень HbA1c, тем у большего количества пациентов удается достичь целевого уровня HbA1c. Почти 75% пациентов с исходным уровнем HbA1c < 8% достигли целевого уровня HbA1c < 7% по сравнению с 34% пациентов с исходным уровнем HbA1c ≥ 9,5%. При этом частота гипогликемии на фоне терапии инсулином гларгин была одинаковой независимо от исходного уровня HbA1c(14).
Объединенный анализ данных 11 исследований, в которых у 2171 пациента с неудовлетворительным гликемическим контролем на монотерапии ПССП, комбинации двух ПССП, монотерапии ПСМ, на комбинации «метформин + ПСМ» или на монотерапии метформином изучали эффективность терапии инсулином гларгин в течение 24 недель, показал, что исходный уровень HbA1c снизился на 1,8, 1,7, 1,7, 1,7 и 2,0% соответственно, а целевого уровня HbA1c < 7% достигли 54,7, 52,7, 50,4, 56,4 и 68,1% пациентов соответственно. Таким образом, наиболее эффективной в отношении гликемического контроля является комбинация «метформин + базальный инсулин»(15).
Тем не менее и врачи, и пациенты настороженно относятся к ранней инсулинотерапии при СД 2 типа. Одно из предубеждений связано со страхом увеличения массы тела. Однако, по мнению докладчика, увеличение массы тела определяется в основном степенью декомпенсации СД 2 типа: на фоне инсулинотерапии при снижении уровня HbA1c на 1% масса тела увеличивается в среднем на 2 кг. И чем раньше инсулинотерапия будет начата, тем меньше будет ожидаемый набор веса(16). С клинической точки зрения более значимым риском инсулинотерапии представляется развитие гипогликемических состояний, поскольку именно они ассоциируются с сердечно-сосудистыми осложнениями и смертью. В этой связи следует иметь в виду, что современные базальные инсулины коренным образом отличаются от препаратов инсулина длительного действия (нейтральный протамин Хагедорна, НПХ), позволяя достичь целевого уровня HbA1c с минимальным риском развития гипогликемии (рис. 4)(17).
При добавлении инсулина гларгин к терапии нашедшими широкое применение в клинической практике ПСМ риск развития гипогликемических состояний выше, чем у пациентов, получающих комбинацию «метформин + инсулин гларгин». Статистически значимых различий в отношении изменения массы тела между группами терапии не наблюдалось, а прибавка массы тела в 1,6 кг клинического значения не имеет (рис. 5)(15).
Недавно проведенный объединенный анализ частоты гипогликемических событий в 5 рандомизированных клинических исследованиях, в которых базальный инсулин (гларгин) в течение 24 недель добавляли к терапии метформином (n = 607), показал, что большинство пациентов (62%) достигли целевого уровня HbA1c < 7% (исходный уровень HbA1c 8,7%) при низкой частоте гипогликемии: 12% пациентов при уровне глюкозы плазмы крови < 3,9 ммоль/л пережили 0,7 эпизода ночной гипогликемии на 1 пациента в год и 5,5% с уровнем глюкозы плазмы < 3,1 ммоль/л – 0,3 эпизода ночной гипогликемии на 1 пациента в год. При этом только 1,7% пациентов пережили 0,05 эпизодов на 1 пациента в год тяжелой гипогликемии (уровень глюкозы плазмы < 2 ммоль/л, требовалась помощь третьего лица). В ходе данного анализа удалось установить очень важную в практическом аспекте закономерность: эпизоды ночной гипогликемии начинают возникать после 50 дней от начала инсулинотерапии, а значит, именно в этот критичный для пациента период врач должен усилить контроль(18).
Еще одним значимым преимуществом раннего назначения инсулинотерапии является ее способность замедлять скорость функционального снижения активности бета-клеток поджелудочной железы. Своевременно начатая инсулинотерапия позволяет не только быстро снять глюкозотоксичность и достичь ремиссии заболевания, но и в определенной степени улучшить эндосекреторную функцию поджелудочной железы. Так, в ходе исследования, в котором 382 пациентам с впервые выявленным СД 2 типа в стадии декомпенсации (уровень HbA1c 9,5–9,8%) проводили интенсивную инсулинотерапию в режиме непрерывного подкожного введения или многократных инъекций, установлено: 97,1% и 95,2% пациентов достигли целевого уровня гликемии за 4 и 5,6 дня терапии соответственно по сравнению с 83,5% за 9,3 дня в группе пациентов, получавших ПССП. При этом через 1 год наблюдения (в течение этого периода пациенты не получали противодиабетической терапии, соблюдая рекомендации по изменению образа жизни и режима питания) ремиссии СД удалось достичь 51,1% и 44,9% пациентов после инсулинотерапии соответственно против 26,7% пациентов, получавших ПССП (p = 0,0012)(19).
Положительное влияние инсулинотерапии на стабильность течения СД 2 типа было подтверждено и в реальной клинической практике. В ходе продленной фазы наблюдательного исследования (9 месяцев наблюдения были продлены до 32 месяцев), в котором 1915 пациентов с СД 2 типа (включая российскую когорту пациентов) получали инсулин гларгин в дополнение к терапии ПССП, было показано, что достигнутый в течение первых 9 месяцев уровень HbA1c < 7% (исходный уровень HbA1c 8,6%) сохранился в течение всего периода наблюдения(20).
Эффективность ранней инсулинотерапии в профилактике развития СД 2 типа была продемонстрирована в исследовании ORIGIN (Outcome Reduction with an Initial Glargine INtervention), в которое вошли 12 537 пациентов из 40 стран в возрасте старше 50 лет с предиабетом или ранним СД 2 типа и высоким сердечно-сосудистым риском. В основной группе участники получали сочетание инсулина гларгин (Лантус) с препаратом омега-3 (полиненасыщенные жирные кислоты) либо с плацебо, а в контрольной – стандартную сахароснижающую терапию с препаратами омега-3 или плацебо. За 6,2 года исследования свыше 11% пациентов контрольной группы были вынуждены начать инсулинотерапию, поскольку традиционное лечение не позволило достичь приемлемого контроля гликемии. И наоборот, раннее назначение инсулинотерапии позволило снизить прогрессирование предиабета в СД 2 типа. Так, у пациентов, получавших инсулин гларгин, вероятность развития СД 2 типа была на 28% ниже, чем у пациентов, получавших стандартную терапию: после первого орального теста на толерантность к глюкозе СД был диагностирован у 24,7% пациентов из группы инсулина гларгин и у 31,2% пациентов из группы стандартной терапии (отношение рисков (ОР) 0,72, 95% доверительный интервал (ДИ) 0,58–0,91, p = 0,006)(21).
Таким образом, ранний интенсивный контроль с помощью инсулина может поддерживать и улучшать функцию бета-клеток и снижать инсулинорезистентность. Раннее применение комбинации базального инсулина с метформином ассоциировано с хорошим гликемическим контролем на фоне низких показателей частоты гипогликемии и прибавки массы тела. Развивающееся на фоне ранней инсулинотерапии базальным инсулином состояние функционального покоя бета-клеток уменьшает потребность в эскалации терапии СД 2 типа и снижает общую стоимость лечения, что важно как с медицинской, так и с фармакоэкономической точки зрения.
Профессор М. Ханефельд
Профессор М. Ханефельд
Оценка рисков и преимуществ использования базальных инсулинов в клинической практике: баланс гликемического контроля и риска гипогликемии
Аспекту безопасности инсулинотерапии с применением базального инсулина было посвящено выступление директора Центра клинических исследований Дрезденского технического университета (Германия) профессора Маркольфа ХАНЕФЕЛЬДА (Markolf Hanefeld, Centre for Clinical Studies at the Technical University in Dresden, Germany).
Суточные колебания уровня глюкозы плазмы у здорового человека находятся в чрезвычайно узком диапазоне 4,5–7,8 ммоль/л. Для поддержания состояния эугликемии требуется слаженная работа самых разных органов и систем человеческого организма. Первыми признаками, указывающими на наличие нарушений углеводного обмена при развитии СД, являются нарушение гомеостаза глюкозы и постпрандиальная гипергликемия. При этом создаются благоприятные условия для развития окислительного стресса, повышается риск сердечно-сосудистых заболеваний.
Постпрандиальную гипергликемию сегодня принято рассматривать как отдельную проблему, возникающую у пациентов с СД 2 типа. Именно поэтому определение уровня гликемии через два часа после нагрузки глюкозой во многих странах мира является таким же рутинным исследованием, назначаемым больным СД 2 типа, как определение гликемии натощак или уровня HbA1c. Неконтролируемые колебания уровня глюкозы (гипергликемия – гипогликемия) вызывают повреждения бета-клеток поджелудочной железы и сосудистой стенки, что, в свою очередь, приводит к развитию целого ряда системных патологических процессов в организме человека (рис. 6).
Метаанализ данных 5 проспективных рандомизированных исследований, в которых в общей сложности приняли участие 33 040 больных СД 2 типа, показал, что терапевтическая тактика интенсивного гликемического контроля по сравнению со стандартным подходом позволяет на 17% уменьшить риск развития несмертельного инфаркта миокарда, однако на общую смертность пациентов с СД не влияет(22). Сердечно-сосудистая безопасность сахароснижающей терапии изучалась в нескольких широкомасштабных исследованиях: ACCORD, VADT, ADVANCE, ORIGIN. Однако только в исследовании ORIGIN терапевтической целью было снижение уровня глюкозы крови натощак ≤ 5,3 ммоль/л. Кроме того, впервые влияние раннего назначения инсулина гларгин на сердечно-сосудистые исходы (включая смерть от сердечно-сосудистых заболеваний) оценивалось у пациентов с предиабетом или СД 2 типа на ранней стадии(23). В ходе исследования ORIGIN было установлено, что достижение целевых значений глюкозы натощак не оказывало влияния на сердечно-сосудистые исходы (частота несмертельного инфаркта и несмертельного инсульта). Таким образом, была показана безопасность применения базального инсулина в отношении влияния на развитие сердечно-сосудистых событий (в том числе у пациентов с заболеваниями сердечно-сосудистой системы в анамнезе). Результаты исследования ORIGIN также показали безопасность терапии инсулином гларгин в отношении риска развития злокачественных опухолей (ОР 1,0, 95% ДИ 0,88–1,13, p = 0,97) и риска смерти от онкологических заболеваний (ОР 0,94, 95% ДИ 0,77–1,15, p = 0,52). Исследование ORIGIN предоставило некоторые новые данные, указывающие на наличие профилактического действия инсулинотерапии в отношении микрососудистых осложнений СД 2 типа.
В ходе исследования ORIGIN также было показано, что раннее назначение инсулина гларгин позволяет соблюсти баланс между эффективностью контроля гликемии и риском развития гипогликемии. При этом инсулин гларгин оказался эффективнее, чем стандартная терапия, в отношении контроля уровня HbA1c (рис. 7)(21).
Приверженность лечению у пациентов, получавших инсулин гларгин, оставалась чрезвычайно высокой на протяжении всего периода проведения исследования: к концу 7-го года инсулин продолжали принимать 83,6% пациентов, при этом доза инсулина оставалась постоянной на протяжении всего периода исследования (0,31 МЕ/кг в 1-й год терапии, 0,36 – во 2-й, 0,38 – в 3-й, 0,39 – в 4-й и 5-й, 0,40 – в 6-й и 0,41 – в 7-й).
В группе пациентов, получавших инсулин гларгин, эпизоды тяжелой гипогликемии регистрировались относительно редко, что объясняется как безопасностью самого препарата, так и ранним началом инсулинотерапии(21). Важность этого наблюдения становится ясной в контексте другого авторитетного исследования, недавно проведенного R.G. McCoy и соавт. (2012). Оно показало, что увеличение частоты эпизодов тяжелой гипогликемии коррелирует с увеличением смертности пациентов с СД(22).
Результаты исследования, проведенного при участии M. Hanefeld (работа подана в журнал Diabetes Care), показали, что существует связь между количеством желудочковых экстрасистол и амплитудой колебания уровня глюкозы (MAGE) и длительностью состояния гипогликемии (ниже 3,1 ммоль/л). Наибольший риск возникновения желудочкой аритмии возникает при средней амплитуде колебания уровня глюкозы в диапазоне < 4,02 и > 5,61 ммоль/л и длительности гипогликемии (< 3,1 ммоль/л) дольше 35 минут(23).
Особенно чувствительны к гипогликемии пациенты с СД и сердечно-сосудистыми заболеваниями. Как правило, это больные старшей (> 70 лет) возрастной группы, нередко страдающие вегетативной кардиальной нейропатией, гипокалиемией и другими сопутствующими заболеваниями, получающие инсулинотерапию в комбинации с ПСМ. Такие пациенты нуждаются в назначении наиболее безопасного в отношении риска развития гипогликемии базального инсулина, например инсулина гларгин.
Профессор М. Ханефельд привел данные собственного исследования EARLY (2012), в котором изучали эффективность, целесообразность и безопасность раннего назначения базального инсулина (гларгин) в условиях клинической практики у пациентов (n = 1438) с СД 2 типа в стадии декомпенсации на монотерапии метформином в максимальных терапевтических дозах в течение не менее 3 месяцев. Через 24 недели терапии уровень HbA1c снизился с 8,7% до 7,4% (p < 0,001), а глюкозы крови натощак – с 10,1 до 7,2 ммоль/л (p < 0,001). За время инсулинотерапии у 2,45% пациентов была зарегистрирована симптоматическая гипогликемия, при этом тяжелая гипогликемия была отмечена у 0,07%, а ночная – у 0,65% пациентов. Масса тела в среднем снизилась на 1 кг. Результаты исследования, проведенного в условиях реальной клинической практики, позволили сделать авторам вывод о том, что добавление инсулина гларгин к метформину в максимальных терапевтических дозах, которые способен переносить пациент, на раннем этапе является рациональной комбинацией и может приостановить прогрессирование СД 2 типа(24).
Безопасность инсулина гларгин по сравнению с инсулином НПХ доказана результатами метаанализа, включившего данные долговременных (продолжительностью > 5 лет) исследований: риск ночной гипогликемии снижается в 2 раза при использовании инсулина гларгин по сравнению с НПХ-инсулином(25). В исследовании, проведенном в условиях повседневной клинической практики, было показано, что последующая интенсификация инсулинотерапии (до базально-болюсного режима) требовалась меньшему количеству пациентов, у которых к ПССП был добавлен инсулин гларгин, по сравнению с пациентами, получавшими комбинацию «ПССП + НПХ-инсулин». Так, на базально-болюсный режим инсулинотерапии все пациенты, получавшие НПХ-инсулин, перешли через 6,5 лет, а пациенты, получавшие инсулин гларгин, на 1,75 года позже(26).
Сравнение инсулина гларгин и инсулина детемир при добавлении к ПССП продемонстрировало сопоставимую эффективность этих препаратов – через 52 недели терапии уровень HbA1c снизился на 1,5%. Однако все пациенты из группы инсулина гларгин получали инсулинотерапию 1 раз в сутки, в то время как 55% пациентов из группы инсулина детемир понадобились инъекции инсулина 2 раза в сутки, причем вторая инъекция была им назначена уже в первые 12 недель терапии. Соответственно, среднесуточная доза инсулина гларгин составила 0,44 МЕ/кг, а инсулина детемир – 0,78 МЕ/кг(27).
Инсулин гларгин характеризуется более высоким профилем безопасности в отношении риска гипогликемий по сравнению со смешанными инсулинами, что было показано в ходе исследования, в котором пациентам с СД 2 типа (n = 371), ранее не получавшим инсулинотерапии и не достигшим целевого уровня гликемии на терапии метформином в сочетании с ПСМ, добавили к пероральной сахароснижающей терапии инсулин гларгин 1 раз в сутки или перевели на смешанный инсулин 2 раза в сутки (30% обычного и 70% НПХ-инсулина). Частота эпизодов гипогликемии на 1 пациента в год составила 4,07 в группе «глимепирид + инсулин гларгин» и 9,87 в группе приема смешанного инсулина (p < 0,0001), в том числе частота подтвержденных ночных эпизодов гипогликемии (глюкоза плазмы крови < 3,3 ммоль/л) – 0,51 против 1,04 соответственно (p = 0,0449)(28). В группе пациентов старше 65 лет был показан не только более благоприятный профиль безопасности, но и более высокая эффективность режима «ПССП + инсулин гларгин 1 р/сут» по сравнению с режимом «смешанный инсулин 2 р/сут»: 55,2% пациентов против 30,2% (p = 0,006) соответственно достигли целевого уровня HbA1c без эпизодов ночной гипогликемии(29).
По данным наблюдательного исследования, в котором анализировались причины перевода пациента (по решению врача) с терапии смешанным инсулином на режим «ПССП + инсулин гларгин 1 р/сут», 68,8% пациентов не могли достичь компенсации заболевания на смешанном инсулине, 55,6% высказывали желание иметь более свободный образ жизни, 23,5% испытывали частую гипогликемию, 37,1% хотели иметь возможность отказаться от перекусов. Перевод на терапию «ПССП + инсулин гларгин» позволил в течение 12 недель снизить уровень HbA1c до 7,2% (∆-1,1) и уменьшить массу тела на 1,5 кг (p ≤ 0,001)(30).
Профессор М. Ханефельд привел данные исследований, в которых изучали инсулин гларгин в сравнении с новым инсулином деглудек, в которых была установлена сопоставимая эффективность обоих препаратов в отношении снижения глюкозы плазмы натощак и HbA1c, а также сопоставимый профиль безопасности в отношении развития гипогликемии, как при СД 1 типа, так и при СД 2 типа(31, 32).
В заключение своего выступления профессор М. Ханефельд отметил, что сегодня в эндокринологическом сообществе прослеживается тенденция к смене парадигмы консервативной коррекции дисгликемии на интенсивную, позволяющую максимально долго удерживать целевые значения HbA1c (рис. 8). Своевременное начало инсулинотерапии сопровождается меньшей частотой развития нежелательных явлений, более полноценным поддержанием гомеостаза глюкозы и уменьшением потребности в комбинированной терапии. При этом выбор в пользу базального инсулина гларгин – самого изученного по параметрам эффективности и безопасности базального инсулина – обеспечивает комфортную для пациента и безопасную возможность раннего начала инсулинотерапии.
Профессор А.М. Мкртумян
Профессор А.М. Мкртумян
Индивидуальный подход к интенсификации инсулинотерапии: современные тенденции
Назначение инсулина пациентам, страдающим СД 2 типа, неизбежно. Прежде всего, это обусловлено постоянным снижением функции бета-клеток, происходящим при сахарном диабете несмотря на проводимое лечение. Как следует интенсифицировать инсулинотерапию, в каком режиме и какими препаратами – ответы на эти и другие вопросы индивидуализации инсулинотерапии дал в своем выступлении д. м. н., заведующий кафедрой эндокринологии и диабетологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова, профессор Ашот Мусаелович МКРТУМЯН.
Поскольку диагноз СД 2 типа нередко ставится с запозданием, снижение функции бета-клеток может начаться задолго до старта противодиабетической терапии. А значит, особенно важно, чтобы переход на экзогенный инсулин был осуществлен своевременно, поскольку сохранение остаточной массы поджелудочной железы является одной из важнейших стратегических задач терапии СД 2 типа.
Еще 15 лет назад эндокринологи с недоверием относились к идее назначения инсулина пациентам, страдающим СД 2 типа. Однако сегодня ясно, что инсулинотерапия как метод лечения этого заболевания обладает огромным преимуществом: она влияет на основные патофизиологические аспекты СД 2 типа. Использование инсулинотерапии позволяет замедлить уменьшение массы поджелудочной железы и снижение функции бета-клеток, что обеспечивает более стабильное течение СД. А это, в свою очередь, является мощным фактором профилактики сосудистых осложнений диабета.
Для соблюдения одного из основных принципов лечения – безопасности – перевод пациента на инсулинотерапию должен быть постепенным. На сегодняшний день существуют две основные стратегии такого перехода (рис. 9).
После того как к ПССП был добавлен базальный инсулин, у эндокринолога есть две возможности дальнейшей интенсификации терапии: более гибкий базально-болюсный подход, предполагающий введение как базального, так и прандиального инсулина, и менее гибкий, в рамках которого пациент получает смесь инсулинов, обычно 2 раза в сутки. Несмотря на то что первый подход предполагает большее количество инъекций, он обладает целым рядом преимуществ.
Применение базального инсулина позволяет снизить уровень гликемии натощак, однако он недостаточно влияет на экскурсию глюкозы, которая на фоне инъекций базального инсулина уменьшается, но остается довольно высокой. Для борьбы с постпрандиальной гипергликемией используется болюсный режим введения инсулина 1 раз в сутки. Время введения болюса должно быть привязано ко времени основного приема пищи, поскольку именно этот прием пищи является причиной главного прандиального пика. Такой режим введения базального и «короткого» инсулинов позволяет улучшить 24-часовой гликемический контроль и достичь целевых значений HbA1c, что подтверждено рядом клинических исследований. Так, объединенный анализ данных 4 исследований (713 пациентов с СД 2 типа длительностью 11 лет), в которых пациентам, не достигшим компенсации на ПССП, был добавлен инсулин гларгин с последующим добавлением инсулина глулизин 1 р/сут во время еды, показал существенное снижение уровня HbA1c и постпрандиальной гликемии через 6 месяцев инсулинотерапии в базально-болюсном режиме: 7,6% против 7,1% (p < 0,001) и 10,8 ммоль/л против 7,8 ммоль/л соответственно. Добавление инсулина глулизин к инсулину гларгин уже через 6 месяцев позволило более чем в 2 раза увеличить количество пациентов, достигших целевого уровня HbA1c < 7% (рис. 10)(33).
Основное преимущество базально-болюсного режима инсулинотерапии перед использованием смешанных инсулинов обусловлено его гибкостью. Введение инсулина ультракороткого действия непосредственно перед основным приемом пищи позволяет максимально точно имитировать действие эндогенного инсулина и избежать опасных колебаний гликемии, которые возможны при применении режима инсулинотерапии смешанными инсулинами в случае несоблюдения строгого режима питания. Поскольку большинство пациентов не ведут, не могут или не хотят вести размеренный образ жизни и строго организовать свое питание, использование смешанных инсулинов сопряжено с повышенными рисками развития гипо- и гипергликемии. Кроме того, сочетание базального и ультракороткого инсулинов позволяет чаще достичь уровня HbA1c < 7% по сравнению с применением смешанных инсулинов 2 р/сут (24% пациентов в группе инсулина гларгин и инсулина глулизин против 14% в группе смешанного инсулина, содержащего 30% короткого и 70% НПХ-инсулина)(34).
В конце своего выступления профессор А.М. Мкртумян обрисовал возможности индивидуализации терапии у пациентов с СД 2 типа при введении новых, пока не признанных рациональными по причине недостаточной изученности комбинаций. Так, известно, что разные агонисты ГПП-1 в большей степени влияют либо на тощаковую, либо на прандиальную гликемию. Перспективной представляется комбинация базального инсулина, воздействующего на глюкозу плазмы натощак, с ликсисенатидом – агонистом ГПП-1, наиболее выраженно снижающим уровень прандиальной глюкозы плазмы. Хотя препарат ликсисенатид в нашей стране пока не зарегистрирован, по мнению профессора А.М. Мкртумяна, уже в скором будущем он займет свое место в арсенале препаратов для лечения СД 2 типа.
1. Emerging Risk Factors Collaboration. Diabetes mellitus, fasting glucose, and risk of cause-specific death // N. Engl. J. Med. 2011. Vol. 364. № 9. P. 829–841.
2. Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies // Lancet. 2010. Vol. 375. № 9733. P. 2215–2222.
3. Kostev K., Mergenthaler U. Time to insulin initiation, glucose control and occurrence of diabetes related complications in France, Germany and UK from 2005 to 2010 // Diabetologia. 2011. Vol. 54. № 1. Suppl. 1. P. S159.
4. Nathan D.M., Buse J.B., Davidson M.B. et al. Management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. 2006. Vol. 29. № 8. P. 1963–1972.
5. Nathan D.M., Buse J.B., Davidson M.B. et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. 2009. Vol. 32. № 1. P. 193–203.
6. Inzucchi S.E., Bergenstal R.M., Buse J.B. et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care. 2012. Vol. 35. № 6. P. 1364–1379.
7. Gerstein H.C., Yale J.F., Harris S.B. et al. A randomized trial of adding insulin glargine vs. avoidance of insulin in people with Type 2 diabetes on either no oral glucose-lowering agents or submaximal doses of metformin and/or sulphonylureas. The Canadian INSIGHT (Implementing New Strategies with Insulin Glargine for Hyperglycaemia Treatment) Study // Diabet. Med. 2006. Vol. 23. № 7. P. 736–742.
8. Rosenstock J., Sugimoto D., Strange P. et al. Triple therapy in type 2 diabetes: insulin glargine or rosiglitazone added to combination therapy of sulfonylurea plus metformin in insulin-naive patients // Diabetes Care. 2006. Vol. 29. № 3. P. 554–559.
9. Aschner P., Chan J., Owens D.R. et al. Insulin glargine versus sitagliptin in insulin-naive patients with type 2 diabetes mellitus uncontrolled on metformin (EASIE): a multicentre, randomised open-label trial // Lancet. 2012. Vol. 379. № 9833. P. 2262–2269.
10. Yki-Järvinen H., Kauppinen-Mäkelin R., Tiikkainen M. et al. Insulin glargine or NPH combined with metformin in type 2 diabetes: the LANMET study // Diabetologia. 2006. Vol. 49. № 3. P. 442–451.
11. Riddle M.C., Rosenstock J., Gerich J.; Insulin Glargine 4002 Study Investigators. The treat-to-target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients // Diabetes Care. 2003. Vol. 26. № 11. P. 3080–3086.
12. Swinnen S.G., Dain M.P., Aronson R. et al. A 24-week, randomized, treat-to-target trial comparing initiation of insulin glargine once-daily with insulin detemir twice-daily in patients with type 2 diabetes inadequately controlled on oral glucose-lowering drugs // Diabetes Care. 2010. Vol. 33. № 6. P. 1176–1178.
13. Bretzel R.G., Nuber U., Landgraf W. et al. Once-daily basal insulin glargine versus thrice-daily prandial insulin lispro in people with type 2 diabetes on oral hypoglycaemic agents (APOLLO): an open randomised controlled trial // Lancet. 2008. Vol. 371. № 9618. P. 1073–1084.
14. Riddle M., Vlajnic A., Zhou R. et al. Baseline A1C predicts the likelihood of reaching the 7.0% A1C target with structured titration of add-on insulin glargine: patient-level analysis of 12 studies in type 2 diabetes mellitus // Diabetes. 2009. Vol. 58. Suppl. 1. P. A125.
15. Fonseca V., Gill J., Zhou R., Leahy J. An analysis of early insulin glargine added to metformin with or without sulfonylurea: impact on glycaemic control and hypoglycaemia // Diabetes Obes. Metab. 2011. Vol. 13. № 9. P. 814–822.
16. Mäkimattila S., Nikkilä K., Yki-Järvinen H. Causes of weight gain during insulin therapy with and without metformin in patients with Type II diabetes mellitus // Diabetologia. 1999. Vol. 42. № 4. P. 406–412.
17. Mullins P., Sharplin P., Yki-Jarvinen H. et al. Negative binomial meta-regression analysis of combined glycosylated hemoglobin and hypoglycemia outcomes across eleven Phase III and IV studies of insulin glargine compared with neutral protamine Hagedorn insulin in type 1 and type 2 diabetes mellitus // Clin. Ther. 2007. Vol. 29. № 8. P. 1607–1619.
18. DeVries J.H., Meneghini L., Barnett A. et al. Pooled hypoglycemia event rates with insulin glargine added to metformin (IG-M) from Treat-to-Target Type 2 Diabetes Mellitus (T2DM) trials // Diabetes. 2012. Vol. 61. Suppl. 1. P. A553.
19. Weng J., Li Y., Xu W. et al. Effect of intensive insulin therapy on beta-cell function and glycaemic control in patients with newly diagnosed type 2 diabetes: a multicentre randomised parallel-group trial // Lancet. 2008. Vol. 371. № 9626. P. 1753–1760.
20. Schreiber S.A., Ferlinz K., Haak T. The long-term efficacy of insulin glargine plus oral antidiabetic agents in a 32-month observational study of everyday clinical practice // Diabetes Technol. Ther. 2008. Vol. 10. № 2. P. 121–127.
21. ORIGIN Trial Investigators. Basal insulin and cardiovascular and other outcomes in dysglycemia // N. Engl. J. Med. 2012. Vol. 367. № 4. P. 319–328.
22. Ray K.K., Seshasai S.R., Wijesuriya S. et al. Effect of intensive control of glucose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials // Lancet. 2009. Vol. 373. № 9677. P. 1765–1772.
23. Origin Trial Investigators. Rationale, design, and baseline characteristics for a large international trial of cardiovascular disease prevention in people with dysglycemia: the ORIGIN Trial (Outcome Reduction with an Initial Glargine Intervention) // Am. Heart J. 2008. Vol. 155. № 1. P. 26–32, 32.e1–6.
24. Hanefeld M., Fleischmann H., Landgraf W., Pistrosch F. EARLY-Studie: Frühe Basalinsulintherapie unter realen Bedingungen bei Typ-2-Diabetikern // Diabetes, Stoffwechsel und Herz. 2012. № 2. P. 91–97.
25. Home P.D., Fritsche A., Schinzel S. et al. Meta-analysis of individual patient data to assess the risk of hypoglycaemia in people with type 2 diabetes using NPH insulin or insulin glargine // Diabetes Obes. Metab. 2010. Vol. 12. № 9. P. 772–779.
26. Pfohl M., Dippel F.W., Kostev K. et al. Different persistence on initial basal supported oral therapy in Type 2 diabetics is associated with unequal distributions of insulin treatment regimens under real-life conditions in Germany // Int. J. Clin. Pharmacol. Ther. 2010. Vol. 48. № 11. P. 761–766.
27. Rosenstock J., Davies M., Home P.D. et al. A randomised, 52-week, treat-to-target trial comparing insulin detemir with insulin glargine when administered as add-on to glucose-lowering drugs in insulin-naive people with type 2 diabetes // Diabetologia. 2008. Vol. 51. № 3. P. 408–416.
28. Janka H.U., Plewe G., Riddle M.C. et al. Comparison of basal insulin added to oral agents versus twice-daily premixed insulin as initial insulin therapy for type 2 diabetes // Diabetes Care. 2005. Vol. 28. № 2. P. 254–259.
29. Janka H.U., Plewe G., Busch K. Combination of oral antidiabetic agents with basal insulin versus premixed insulin alone in randomized elderly patients with type 2 diabetes mellitus // J. Am. Geriatr. Soc. 2007. Vol. 55. № 2. P. 182–188.
30. Hammer H., Klinge A. Patients with type 2 diabetes inadequately controlled on premixed insulin: effect of initiating insulin glargine plus oral antidiabetic agents on glycaemic control in daily practice // Int. J. Clin. Pract. 2007. Vol. 61. № 12. P. 2009–2018.
31. Heller S., Buse J., Fisher M. et al. Insulin degludec, an ultra-longacting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 1 diabetes (BEGIN Basal-Bolus Type 1): a phase 3, randomised, open-label, treat-to-target non-inferiority trial // Lancet. 2012. Vol. 379. № 9825. P. 1489–1497.
32. Garber A.J., King A.B., Del Prato S. et al. Insulin degludec, an ultra-longacting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 2 diabetes (BEGIN Basal-Bolus Type 2): a phase 3, randomised, open-label, treat-to-target non-inferiority trial // Lancet. 2012. Vol. 379. № 9825. P. 1498–1507.
33. Del Prato S., Lankisch M., Lin J. et al. Efficacy and safety of a basal-plus regimen of insulin glargine plus insulin glulisine in patients with Type 2 diabetes: a pooled analysis of 4 clinical trials // Diabetes. 2012. Vol. 61. Suppl. 1. P. A297.
34. Riddle M.C., Vlajnic A., Jones B.A., Rosenstock J. Comparison of 3 intensifi ed insulin regimens added to oral therapy for Type 2 diabetes: twice-daily aspart premixed vs glargine plus 1 prandial glulisine or stepwise addition of glulisine to glargine // Diabetes. 2011. Vol. 60. Suppl. 1. P. A113.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.