Ремоделирование левого предсердия у пациентов, перенесших острый коронарный синдром, в зависимости от формы сопутствующей фибрилляции предсердий
- Аннотация
- Статья
- Ссылки
- English
Цель. Сравнительный анализ параметров левого предсердия (ЛП) при рутинной ЭхоКГ и спекл-трекинг ЭхоКГ у пациентов с ишемической болезнью сердца (ИБС) и ФП, перенесших ОКС, в зависимости от формы ФП.
Материал и методы. В одномоментное когортное исследование включены 93 пациента:
73 – с пароксизмальной формой ФП (медиана возраста 68,0 [62,5; 76,0] года, 63% мужчин)
и 20 – с постоянной формой ФП (медиана возраста 71,0 [62,5; 77,0] года, 60% мужчин). Всем пациентам проведена рутинная ЭхоКГ и спекл-трекинг ЭхоКГ, а затем выполнен сравнительный анализ показателей в группах с пароксизмальной и постоянной ФП (1-я и 2-я группы соответственно).
Результаты. Медиана индекса объема ЛП в 1-й группе составила 31,81 [27,52; 38,05] мл/м2, во 2-й группе – 49,18 [40,48; 55,3] мл/м2 (р < 0,001).
Усредненный пиковый стрейн ЛП был статистически значимо ниже у пациентов 2-й группы, чем 1-й (5,58 [4,69; 7,49] и 20,23 [13,98; 25,85] % соответственно, р < 0,001 ), также как и скорость пикового стрейна ЛП (1,00 [0,8; 1,31] и 2,28 [1,76; 2,89] с-1 соответственно, р < 0,001). Индекс жесткости ЛП оказался выше у пациентов 2-й группы, а индекс растяжимости ЛП – у пациентов 1-й группы (для обоих сравнений р < 0,001).
Заключение. Для пациентов, перенесших ОКС, с постоянной формой сопутствующей ФП характерны более высокие линейные и объемные параметры ЛП и более низкие пиковый стрейн ЛП и его скорость, чем для больных с пароксизмальной формой ФП.
Цель. Сравнительный анализ параметров левого предсердия (ЛП) при рутинной ЭхоКГ и спекл-трекинг ЭхоКГ у пациентов с ишемической болезнью сердца (ИБС) и ФП, перенесших ОКС, в зависимости от формы ФП.
Материал и методы. В одномоментное когортное исследование включены 93 пациента:
73 – с пароксизмальной формой ФП (медиана возраста 68,0 [62,5; 76,0] года, 63% мужчин)
и 20 – с постоянной формой ФП (медиана возраста 71,0 [62,5; 77,0] года, 60% мужчин). Всем пациентам проведена рутинная ЭхоКГ и спекл-трекинг ЭхоКГ, а затем выполнен сравнительный анализ показателей в группах с пароксизмальной и постоянной ФП (1-я и 2-я группы соответственно).
Результаты. Медиана индекса объема ЛП в 1-й группе составила 31,81 [27,52; 38,05] мл/м2, во 2-й группе – 49,18 [40,48; 55,3] мл/м2 (р < 0,001).
Усредненный пиковый стрейн ЛП был статистически значимо ниже у пациентов 2-й группы, чем 1-й (5,58 [4,69; 7,49] и 20,23 [13,98; 25,85] % соответственно, р < 0,001 ), также как и скорость пикового стрейна ЛП (1,00 [0,8; 1,31] и 2,28 [1,76; 2,89] с-1 соответственно, р < 0,001). Индекс жесткости ЛП оказался выше у пациентов 2-й группы, а индекс растяжимости ЛП – у пациентов 1-й группы (для обоих сравнений р < 0,001).
Заключение. Для пациентов, перенесших ОКС, с постоянной формой сопутствующей ФП характерны более высокие линейные и объемные параметры ЛП и более низкие пиковый стрейн ЛП и его скорость, чем для больных с пароксизмальной формой ФП.

Введение
Фибрилляция предсердий (ФП) – это наджелудочковая аритмия, характеризующаяся несогласованной деполяризацией предсердий и имеющая широкую распространенность (от 1 до 4% от общей численности населения) [1]. ФП, помимо низкого качества жизни и высокой смертности, ассоциирована с развитием других сердечно-сосудистых заболеваний, таких как инсульт и тромбоэмболические осложнения, дисфункция левого желудочка (ЛЖ), хроническая сердечная недостаточность [2]. Сопутствующая ишемическая болезнь сердца (ИБС) способствует прогрессированию ФП и повышает риски тромбоэмболических событий [3]. Распространенность ИБС среди пациентов с ФП варьирует от 17 до 46,5% [3], а частота острого коронарного синдрома (ОКС) среди пациентов с ФП в 2 раза выше, чем в общей популяции [4]. И наоборот, пациенты, перенесшие инфаркт миокарда (ИМ), подвержены более высокому риску развития ФП: это связано с повышением давления наполнения ЛЖ, жесткостью и ригидностью его стенок после ИМ, что ведет к ремоделированию левого предсердия (ЛП) [5].
Трансторакальная эхокардиография (ЭхоКГ) является важным, доступным и неинвазивным методом обследования кардиологических пациентов. При рутинной ЭхоКГ оценка рисков неблагоприятных исходов основывается на структуре ЛП, при этом наиболее значимым считают такой показатель, как объем ЛП, индексированный по площади поверхности тела (индекс объема ЛП), который является предиктором развития и прогрессирования ФП [6]. В настоящий момент стандартные показатели дополняются более ранними маркерами повышенного риска развития неблагоприятных событий – это пиковый стрейн ЛП и его скорость, измеренные с помощью двумерной спекл-трекинг ЭхоКГ [7]. Использование данных показателей способствует улучшению диагностики, повышают предикторную ценность метода и позволяет разработать эффективные программы ведения пациентов с ФП: полагают, что широкое использование этих маркеров в клинической практике может улучшить результаты лечения и обеспечить социально-экономическую выгоду для здравоохранения [2].
Особенно актуальным становится изучение параметров, характеризующих структуру и функцию ЛП, в контексте прогноза как у пациентов с ФП, так и у больных, перенесших ОКС [8–13]. Оценка пикового стрейна ЛП продемонстрировала потенциал в прогнозировании прогрессирования ФП [8] и риска инсульта [9], более того, предполагается, что включение данного показателя в шкалу CHA2DS2-VASc может повысить ее прогностическую эффективность [10]. У пациентов после перенесенного ИМ снижение резервуарной функции ЛП, оцениваемое по пиковому стрейну ЛП, ассоциировано с худшими клиническими исходами, включая смертность от всех причин [11–13]. Однако данные о структурно-функциональных особенностях ЛП, изученных с помощью спекл-трекинг ЭхоКГ, у коморбидных пациентов, страдающих ФП и перенесших ОКС, ограниченны.
Исходя из вышеизложенного, цель настоящего исследования – сравнительный анализ параметров ЛП при рутинной ЭхоКГ и спекл-трекинг ЭхоКГ у пациентов с ФП, перенесших ОКС, в зависимости от формы ФП.
Материал и методы
Протокол настоящего исследования был одобрен Этическим комитетом ФГБОУ ДПО РМАНПО Минздрава России (протокол № 10 заседания от 18 сентября 2023 г.).
Дизайн исследования – одномоментное когортное.
Критерии включения: пациенты обоего пола 18 лет и старше с ФП, перенесшие ОКС не менее трех месяцев назад и находящиеся на двойной антитромботической терапии (апиксабан или ривароксабан + антиагрегант).
Критерии невключения: возраст < 18 лет; беременность; лактация; пациенты с протезированными клапанами или митральным стенозом средней/тяжелой степени; скорость клубочковой фильтрации (CКФ) < 15 мл/мин/1,73 м² по формуле CKD-EPI и/или клиренс креатинина по формуле Кокрофта – Голта < 15 мл/мин; клинически значимое кровотечение на момент включения; ОКС в течение предшествующих трех месяцев; состояния, сопровождающиеся существенным повышением риска геморрагических событий; наличие определенных сопутствующих заболеваний и состояний (системные заболевания соединительной ткани, заболевания крови, влияющие на гемостаз, онкологические заболевания, выраженная печеночная недостаточность (класс В и С по шкале Чайлда – Пью)); тяжелые психические расстройства; повышенная чувствительность к клопидогрелу, ацетилсалициловой кислоте, тикагрелору, прасугрелу, ривароксабану, апиксабану; прием варфарина или дабигатрана.
Согласно вышеперечисленным критериям включения/невключения, в исследовании участвовали 93 пациента, в том числе 73 человека – с пароксизмальной ФП (группа 1) и 20 человек – с постоянной формой ФП (группа 2).
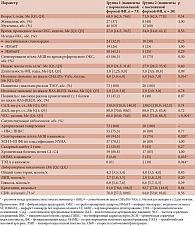
Проведен анализ клинико-демографических характеристик, сопутствующих заболеваний, данных лабораторных методов исследования и медикаментозной терапии в двух группах в зависимости от формы ФП (табл. 1).
В группе больных с пароксизмальной ФП (у всех пациентов синусовый ритм на момент осмотра) медиана возраста составила 68,0 [62,5; 76,0] года, а в группе пациентов с постоянной ФП – 71,0 [62,5; 77,0] года (различия между группами статистически незначимы). Группы были сопоставимы по полу (р > 0,05). Пациенты с постоянной ФП имели более высокий балл по шкале CHA2DS2-VASc (6,0 [4,0; 7,0] балла в 1-й группе и 4,0 [3,0; 6,0] балла во 2-й группе, р = 0,016). Частота сердечных сокращений у пациентов с пароксизмальной ФП оказалась статистически значимо ниже (р = 0,008), чем у пациентов с постоянной ФП (табл. 1). В этой связи необходимо упомянуть, что между группами не было обнаружено статистически значимых различий в частоте приема ритмурежающих или антиаритмических препаратов. Единственным cтатистически значимым отличием в медикаментозной терапии стал прием сахароснижающих препаратов из группы ингибиторов натрий-глюкозного котранспортера 2-го типа: 5 (6,8%) пациентов в группе с пароксизмальной ФП и 5 (25,0%) пациентов в группе с постоянной ФП (р = 0,035).
При сравнении групп по сопутствующим заболеваниям выявлены статистически значимые различия частоты проведения стентирования и/или аортокоронарного шунтирования в анамнезе: 94,5% пациентов в группе с пароксизмальной ФП и 75,0% пациентов в группе с постоянной ФП (р = 0,020) (табл. 1). Среди сопутствующих заболеваний у пациентов с постоянной ФП статистически значимо чаще встречались острое нарушение мозгового кровообращения в анамнезе (25,0% пациентов с постоянной ФП и 6,8% пациентов с пароксизмальной ФП, р = 0,035) и тромбоэмболия легочной артерии (10,0% пациентов с постоянной ФП и 0% среди пациентов с пароксизмальной ФП, р = 0,044) (табл. 1).
Рутинную ЭхоКГ и спекл-трекинг ЭхоКГ проводили при помощи ультразвукового сканера Philips Epic7 (Philips Ultrasound, USA) и широкополосного секторного датчика S5-1 (1–5 МГц) по стандартной методике [14–18], измерение и трактовку показателей выполняли в соответствии с рекомендациями ведущих зарубежных профессиональных сообществ [14–18].
При анализе стрейна ЛП оценивался только пиковый стрейн (характеризует фазу резервуара ЛП), усредненный из четырехкамерной и двухкамерной позиций, синхронизация расчета стрейна проводилась по зубцу R электрокардиограммы с использованием программного алгоритма для оценки стрейна ЛЖ, по аналогии с другими исследованиями [2, 19]. Индекс жесткости ЛП рассчитан как отношение E/е' к стрейну ЛП, где Е – скорость пика Е трансмитрального кровотока (м/с); e' – усредненная скорость пиков e' левого атриовентрикулярного кольца (м/с) [20]. Индекс растяжимости ЛП был рассчитан как отношение разницы максимального и минимального объемов ЛП к минимальному объему ЛП (мл) [21].
Статистическая обработка данных выполнена с использованием программы IBM SPSS Statistics Base 27.0. Нормальность распределения количественных переменных оценивали с помощью критерия Шапиро – Уилка. Все количественные данные представлены в виде медианы с указанием 25-го и 75-го процентилей, качественные показатели – в виде абсолютных значений и соответствующих им частот в процентах. Значения р рассчитаны с помощью критерия χ2/точного критерия Фишера для категориальных переменных, а для количественных переменных – с помощью t-критерия Стьюдента при нормальном (параметрическом) распределении и с помощью критерия Манна – Уитни для независимых выборок при ненормальном (непараметрическом) распределении. Различия между группами считались статистически значимыми при p < 0,05.
Результаты
Результаты сравнительного анализа структурно-функциональных характеристик ЛП по группам в зависимости от формы ФП представлены в табл. 2. При анализе линейных размеров ЛП выявлено, что у пациентов с постоянной формой ФП переднезадний размер ЛП оказался статистически значимо больше (р = 0,001), количество пациентов с переднезадним размером ЛП > 4 cм – 85,0% во 2-й группе и 56,2% в 1-й группе (р = 0,020).
Объемные характеристики ЛП также были больше у пациентов с постоянной формой ФП (для всех сравнений р < 0,001) (табл. 2): медиана индекса объема ЛП в 1-й группе составила 31,81 [27,52; 38,05] мл/м2, а во 2-й группе – 49,18 [40,48; 55,3] мл/м2. При этом индекс объема ЛП был выше нормы у 95% пациентов с постоянной формой ФП и лишь у 41% пациентов с пароксизмальной формой ФП (табл. 2).
Усредненный пиковый стрейн ЛП был статистически значимо ниже у пациентов с постоянной формой ФП, чем у пациентов с пароксизмальной формой ФП (р < 0,001), также как и скорость пикового стрейна ЛП (р < 0,001) (табл. 2).
Индекс жесткости ЛП оказался статистически значимо выше у пациентов с постоянной формой ФП, а индекс растяжимости ЛП – в группе с пароксизмальной формой ФП (для обоих сравнений р < 0,001) (табл. 2).
Обсуждение
Как было установлено в ранее проведенных исследованиях, степень фибротических изменений прогрессирует по мере ухудшения течения ФП (перехода пароксизмальной ФП в постоянную форму) [22–24], что находит свое отражение в соответствующих изменениях эхокардиографических параметров. Например, D. Gupta и соавт. в субанализе исследования ENGAGE AF-TIMI 48 оценивали данные рутинной ЭхоКГ у 971 пациента, которые имели перенесенный ИМ в анамнезе и сопутствующую ФП (средний возраст 73 [65; 79] года, 66% мужчин). В зависимости от формы ФП когорта была поделена на три группы: с пароксизмальной ФП (33%), персистирующей ФП (21%), постоянной ФП (46%). Полученные результаты свидетельствуют о том, что индекс объема ЛП возрастал по мере прогрессирования ФП (28 [24; 35], 32 [26; 38] и 35 [30; 43] мл/м2 соответственно, p < 0,001), а индекс растяжимости снижался (0,74 [0,53; 0,96], 0,61 [0,46; 0,79], 0,53 [0,38; 0,76] соответственно, p < 0,001) [22]. Это согласуется с результатами рутинной ЭхоКГ, полученными в нашей работе.
В исследовании S. Kuppahally и соавт. (n = 55, средний возраст участников 61,2 ± 14,2 года, 67% мужчин) у пациентов с персистирующей ФП (56% пациентов) по сравнению с пациентами с пароксизмальной ФП (44% пациентов) выявлена статистически значимо более высокая степень фиброза ЛП (22 ± 17% против 14 ± 9%, р = 0,04), по данным диффузно-взвешенной магнитно-резонансной томографии сердца, а также статистически значимо более низкие показатели среднесептального (27 ± 14% против 38 ± 16%, р = 0,01) и среднелатерального стрейна ЛП (35 ± 16% против 45 ± 14%, р = 0,03), по данным спекл-трекинг ЭхоКГ. С помощью многомерной поэтапной регрессии было показано, что среднесептальный стрейн ЛП (r = -0,5, р = 0,006) и его скорость (r = -0,4, р = 0,01) выступали предикторами фиброза ЛП независимо от других эхокардиографических параметров (переднезадний размер ЛП, индекс объема ЛП, индекс растяжимости ЛП, Е/е') и ритма во время визуализации [23].
В отечественном исследовании И. Орловой и соавт. также проводили оценку эхокардиографических параметров ЛП в группах с различными формами ФП: 1-я группа – 70 пациентов с пароксизмальной формой (медиана возраста 73,0 [64,75; 76,5] года, 30% мужчин) и 2-я группа – 54 пациента с постоянной или персистирующей формой (медиана возраста – 78,5 [68,0; 83,0] года, 39% мужчин). Выявлено, что во 2-й группе по сравнению с 1-й были статистически значимо больше линейные и объемные параметры ЛП (р < 0,001 для всех сравнений): переднезадний размер ЛП (4,6 и 4,0 см соответственно), максимальный объем ЛП (60,4 и 35,4 мл соответственно), индекс объема ЛП (44 и 35,4 мл/м2 соответственно) и индекс жесткости ЛП (1,4 и 0,6 соответственно) [24]. В то же время пациенты 2-й группы имели статистически значимо меньшие (р < 0,001 для всех сравнений) значения ряда параметров спекл-трекинг ЭхоКГ: усредненный стрейн ЛП (6,1 и 18,3% соответственно), усредненную скорость стрейна ЛП (1,1 и 2,3 с-1 соответственно) и индекс растяжимости ЛП (0,4 и 0,9 соответственно) [24]. К сожалению, в описании вышеприведенных исследований нет данных о частоте сопутствующей ИБС или наличия ИМ в анамнезе [23, 24]. Однако, несмотря на различия в дизайне, эти данные соответствуют результатам нашего исследования, в котором принимали участие пациенты с ФП и перенесенным ОКС.
В другом небольшом исследовании (n = 58) пациенты с ФП были разделены на три группы в зависимости от формы ФП: 16 пациентов – с пароксизмальной, 14 – с персистирующей и 28 – с постоянной формой ФП; среди них с ИМ в анамнезе – 12%, 15% и 0% пациентов соответственно (р = 0,12). Пациенты с пароксизмальной ФП имели более высокие значения пикового стрейна ЛП (15,7 ± 12,0%) по сравнению с пациентами с персистирующей (4,3 ± 7,9%) и постоянной (5,8 ± 7,8%) формами ФП (р = 0,003) [19]. Полученные нами и другими исследователями результаты отражают прогрессирующее ремоделирование и дисфункцию ЛП по мере ухудшения течения ФП: перехода пароксизмальной формы в персистирующую и постоянную формы [19, 22–24].
В когорте пациентов с ИБС также проводят оценку пикового стрейна ЛП, как в отношении риска развития/прогрессирования ФП, так и в отношении других клинических исходов [25–28]. Так, в исследовании A. Svartstein и соавт. 303 пациента (средний возраст 62,0 ± 11,5 года, 77% мужчин) с ИМ с подъемом сегмента ST (ИМпST) наблюдались в течение 5,6 [5,0–6,1] года, исход оценивался как развитие ФП. В результате было обнаружено, что пиковый стрейн ЛП являлся независимым предиктором возникновения ФП у пациентов с перенесенным ИМпST (отношение рисков (ОР) 0,9; 95%-ный доверительный интервал (ДИ) 0,9–1,9; p = 0,006); у пациентов с развитием ФП за период наблюдения отмечены статистически значимо более низкие значения стрейна ЛП по сравнению с пациентами без ФП (24,1 ± 12,4% и 33,4 ± 15,0% соответственно, р = 0,011) [25]. В многомерных моделях (совокупно учитывающих пол, возраст, глобальный продольный стрейн ЛЖ, индекс объема ЛП, фракцию выброса ЛЖ, E/е') пиковый стрейн ЛП оставался статистически значимым независимым предиктором развития ФП (р < 0,05) [25]. В нашем же исследовании все пациенты, перенесшие ОКС, уже имели ФП, однако мы установили, что чем устойчивее аритмия (постоянная форма ФП), тем хуже показатели ЭхоКГ, то есть худшие значения пикового стрейна ЛП отражали клиническую тяжесть течения ФП.
Схожие результаты получены в проспективном исследовании L. Caunite и соавт. при наблюдении за 1238 пациентами (средний возраст 60 ± 12 лет, 75% мужчин) с перенесенным ИМпST. Отмечено, что в течение 23 месяцев периода наблюдения у 7,4% пациентов развилась ФП. Интересно, что распространенность повышенного индекса объема ЛП была одинаковой в группе с наличием и отсутствием ФП, а снижение пикового стрейна ЛП (пороговое значение 23%) у пациентов с развитием ФП за период наблюдения встречалось в 1,5 раза чаще (72% против 48%, p < 0,001). При многомерном регрессионном анализе Кокса (с поправкой на возраст, курение, наличие сопутствующей хронической обструктивной болезни легких, уровень тропонина Т, СКФ, конечно-диастолический объем ЛЖ, толщину межжелудочковой перегородки, глобальный продольный стрейн ЛЖ, индекс объема ЛП, Е/е', индекс массы миокарда ЛЖ, систолическое давление в легочной артерии) пиковый стрейн ЛП оставался статистически значимым предиктором возникновения ФП (ОР 0,97; 95% ДИ 0,94–0,99; p = 0,025) [27].
Кроме того, по данным D. Modin и соавт., значения индекса растяжимости ЛП также являются предиктором возникновения ФП после ИМпST (ОР 1,14; 95% ДИ 1,14–1,23; р < 0,001) и дополняют прогностическую значимость модели, в которой использовались ранее установленные предикторы ФП (возраст, пол, сахарный диабет, гипертоническая болезнь, уровень тропонина I, глобальный продольный стрейн ЛЖ, Е/е') [6].
В исследовании А.И. Кочеткова и соавт. сравнивались структурно-функциональные параметры ЛП (по данным рутинной и cпекл-трекинг ЭхоКГ) в группе пациентов с ИБС и ФП (n = 54, средний возраст 64,0 [60,5; 71,3] года, 80% мужчин) и с ИБС без сопутствующей ФП (n = 54, средний возраст 69,0 [61,8; 73,3] года, 80% мужчин). Согласно полученным результатам, при наличии сопутствующей ФП у пациентов с ИБС имеют место статистически значимо большие линейные и объемные характеристики ЛП, а значения параметров спекл-трекинг ЭхоКГ (стрейн ЛП и его скорость, индекс жесткости ЛП) указывают на более высокую жесткость миокарда ЛП в этой подгруппе пациентов в сравнении с пациентами с ИБС без ФП (р < 0,05) [28].
Структурно-функциональному ремоделированию ЛП у пациентов с ФП и ИБС способствуют несколько патофизиологических механизмов:
расширение ЛП вследствие многих осложнений после ОКС (сердечная недостаточность, диастолическая дисфункция, митральная регургитация) приводит к растяжению и гибели кардиомиоцитов, которые заменяются фибробластами, что влияет на электрическую активность ЛП;
у пациентов с ФП, перенесших ИМ, как правило, имеет место замедление внутрипредсердной проводимости, вероятно обусловленное изменениями в белках щелевых контактов, эта неоднородность проводимости ЛП обуславливает механизм re-entry (повторного входа импульса) и играет важную роль в формировании и поддержании ФП;
ишемия миокарда вызывает локальное асептическое воспаление (повышение уровня классических факторов воспаления, таких как С-реактивный белок и интерлейкин 6), которое в свою очередь приводит к системному воспалению, распространению процессов фиброзирования и возникновению ФП [29].
В нашем исследовании не проводилась оценка влияния эхокардиографических параметров ЛП на прогноз, хотя некоторые авторы выявляют прогностическую значимость пикового стрейна ЛП у пациентов после перенесенного ОКС [30]. Так, в исследовании, в котором принимали участие 378 пациентов с перенесенным ОКС (средний возраст 64 года, 76% мужчин, медиана периода наблюдения 5,7 [4,7–6,9] года, анамнез ФП авторами не уточнен), по результатам многофакторного анализа, снижение пикового стрейна ЛП ассоциировано со смертностью от всех причин (ОР 1,04; 95% ДИ 1,01–1,06; p = 0,002) [30].
Изученные нами параметры ЛП как прогностические маркеры находят применение и в рамках стратификации риска тромбоэмолических осложнений у пациентов с ФП [9, 31, 32]. Так, у пациентов с кардиоэмболическим инсультом были выявлены повышенные значения индекса объема ЛП [31]. Кроме того, среди 656 пациентов с ишемическим инсультом снижение пикового стрейна ЛП было в большей степени ассоциировано с возникновением ишемического инсульта неясной этиологии (скорректированный относительный риск (сОтнР) 1,9; 95% ДИ 1,3–3,0; p = 0,002) и выявлением эпизодов ФП (сОтнР 2,5; 95% ДИ 1,1–6,2; p = 0,043), чем у пациентов с ишемическим инсультом некардиоэмболического типа [32]. Поэтому количественное определение стрейна ЛП у пациентов с ишемическим инсультом неясной этиологии может улучшить стратификацию риска кардиоэмболических осложнений и стратегию вторичной профилактики [32]. В ретроспективном исследовании J. Shih и соавт. у пациентов с постоянной ФП (n = 66) пиковый стрейн ЛП и его скорость были статистически значимо ассоциированы с повышенным риском развития инсульта [9].
Заключение
Настоящее исследование подчеркивает важность анализа эхокардиографических параметров левого предсердия (в том числе параметров спекл-трекинг ЭхоКГ) у пациентов с ишемической болезнью сердца и фибрилляцией предсердий после перенесенного острого коронарного синдрома. Более высокие объемные параметры левого предсердия и более низкие пиковый стрейн левого предсердия и его скорость характерны для пациентов с постоянной формой фибрилляции предсердий в сравнении с пациентами с пароксизмальной формой. Индекс объема левого предсердия и пиковый стрейн левого предсердия косвенно свидетельствуют о степени распространенности процесса фиброзирования миокарда левого предсердия. Опираясь на эти показатели, согласно литературным данным, можно прогнозировать исходы, в частности риск развития ишемического инсульта. Необходимы дальнейшие исследования в когорте коморбидных пациентов с фибрилляцией предсердий и ишемической болезнью сердца ввиду повышенных тромбоэмболических рисков и ухудшения прогноза.
A.I. Kochetkov, A.V. Dubinina, N.E. Gavrilova, E.V. Shin, Z.S. Shogenov, T.Yu. Vedenikin, O.D. Ostroumova
Russian Medical Academy of Continuous Professional Education, Moscow
Scandinavian Health Center, Moscow
Moscow State Clinical Hospital named after V.V. Veresaev
Contact person: Olga D. Ostroumova, ostroumova.olga@mail.ru
In patients with atrial fibrillation (AF), acute coronary syndrome (ACS) is twice as common as in the general population. Transthoracic echocardiography (TTE) is a non-invasive and available method for diagnosing structural and functional changes in the myocardium, and the speckle-tracking TTE technique allows them to be detected at an earlier stage.
Aim. A comparative analysis of the parameters of the left atrium (LA) during routine and speckle-tracking TTE in patients with coronary artery disease (CAD) and AF who underwent ACS, depending on the stage of AF.
Material and methods. A single-stage cohort study included 93 patients: 73 with paroxysmal AF (median age 68.0 [62.5; 76.0] years, 63% of men) and 20 with permanent AF (71.0 [62.5; 77.0] years, 60% of men). All patients underwent routine and speckle tracking ТТЕ, and then a comparative analysis of the parameters was performed in groups with paroxysmal and persistent AF (groups 1 and 2, respectively).
Results. The median LA volume index in group 1 was 31.81 [27.52; 38.05] ml/m2, in group 2 – 49.18 [40.48; 55.3] ml/m2 (p < 0.001). The average peak LA strain was significantly lower in patients of group 2 than in group 1 (5.58 [4.69; 7.49] and 20.23 [13.98; 25.85] %, respectively, p < 0.001), as well as the peak LA strain rate (1.00 [0.8; 1.31] and 2.28 [1.76; 2.89] c-1, respectively, p < 0.001). The LA stiffness index was higher in patients of group 2, and the LA extensibility index was higher in group 1 (for both comparisons, p < 0.001).
Conclusion. Higher linear and volumetric LA parameters and lower peak LA strain and its rate are characteristic of the permanent AF compared with the paroxysmal AF in patients with history of ACS.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.