Оценка серии клинических случаев лечения диссеминированной BRAF-мутированной меланомы кожи комбинированной иммуно-таргетной терапией
- Аннотация
- Статья
- Ссылки
- English
Целью данной работы являются проведение анализа использования комбинированной ИТТ в различных линиях лечения, оценка эффективности и токсичности проводимых режимов. Сравнительный анализ используемых схем не проводился ввиду недостаточной выборки случаев для статистической обработки.
Результаты. Наиболее эффективное, с точки зрения частоты объективного ответа (ЧОО), назначение тройной комбинации отмечено в первой линии терапии. Объективный ответ составил 80%: 60% – частичный регресс и 20% – полный ответ. Стабилизация заболевания представлена в 20%. Во второй, третьей, пятой и восьмой линиях комбинированной ИТТ стабилизация заболевания составила 100%. На фоне комбинированной ИТТ были зафиксированы следующие побочные эффекты: иммунноопосредованный гепатит 4-й степени (n = 2; 15%), артериальная гипертензия 3-й степени (n = 1; 7,5%), пирексия 2-й степени (n = 2; 15%) и тиреоидит 1-й степени (n = 1; 7,5%). Выраженность нежелательных явлений, наблюдаемых при лечении тройной комбинацией, была ассоциирована с высокой эффективностью терапии.
Целью данной работы являются проведение анализа использования комбинированной ИТТ в различных линиях лечения, оценка эффективности и токсичности проводимых режимов. Сравнительный анализ используемых схем не проводился ввиду недостаточной выборки случаев для статистической обработки.
Результаты. Наиболее эффективное, с точки зрения частоты объективного ответа (ЧОО), назначение тройной комбинации отмечено в первой линии терапии. Объективный ответ составил 80%: 60% – частичный регресс и 20% – полный ответ. Стабилизация заболевания представлена в 20%. Во второй, третьей, пятой и восьмой линиях комбинированной ИТТ стабилизация заболевания составила 100%. На фоне комбинированной ИТТ были зафиксированы следующие побочные эффекты: иммунноопосредованный гепатит 4-й степени (n = 2; 15%), артериальная гипертензия 3-й степени (n = 1; 7,5%), пирексия 2-й степени (n = 2; 15%) и тиреоидит 1-й степени (n = 1; 7,5%). Выраженность нежелательных явлений, наблюдаемых при лечении тройной комбинацией, была ассоциирована с высокой эффективностью терапии.





Меланома является одной из наиболее агрессивных форм злокачественных опухолей кожи и одной из ведущих причин смерти от онкологических заболеваний из-за агрессивного течения, раннего метастазирования с поражением жизненно-важных органов. Согласно отчету Всемирной организации здравоохранения, в структуре заболеваемости злокачественных новообразований на 2023 г. в России меланома кожи составляет 1,7% и 2,2% среди мужского и женского населения соответственно. Прирост заболеваемости с 2013 по 2023 г. составил 34,11%. При этом, за последние 10 лет наблюдается снижение показателей смертности на 12,43%, связанное со значительными успехами в понимании молекулярных механизмов канцерогенеза этой опухоли [1]. Основную роль в патогенезе играет сигнальный путь MAPK (RAS-RAF-MEK-ERK), который гиперактивирован до 80% случаев за счет мутантного белка гена BRAF. Мутантный белок вызывает не только гиперактивацию каскада сигнального пути MAPK и пролиферацию клеток меланомы, но и увеличение жизнеспособности опухоли, регулируя экспрессию и функционирование проапоптотических и антиапоптотических белков. Протоонкоген BRAF относится к семейству серин-треонинпротеинкиназ RAF, мутирует у 50–80% пациентов с кожной меланомой. Наиболее распространенная мутация – замена глутаминовой кислоты на валин в положении 600 (V600E), составляющая около 90% всех мутаций BRAF [2]. Благодаря выявлению мутации в гене BRAF в начале 21-го века наметился реальный прогресс в лечении пациентов с метастатической меланомой. Была разработана и успешно применена таргетная терапия (ТТ) ингибиторами тирозинкиназ.
В 2011 г. для лечения метастатической меланомы кожи был одобрен первый препарат, блокирующий BRAF-протеин – вемурафениб [3]. В последующем в практическое применение вошли препараты дабрафениб и энкорафениб. Первоначально для ТТ меланомы ингибиторы BRAF (вемурафениб, дабрафениб) использовались как самостоятельные агенты. В дальнейшем была выявлена способность опухолевых клеток меланомы к формированию резистентности к BRAF-ингибиторам, связанная с активацией альтернативного пути МЕК. В настоящее время во избежание формирования лекарственной резистентности при лечении метастатической меланомы ВRAF-ингибиторы комбинируют с препаратами, подавляющими проведение сигнала по альтернативному пути МЕК. Использование комбинаций ингибиторов BRAF/МЕК (дабрафениб + траметиниб, вемурафениб » кобиметиниб) привели к высокой частоте объективного ответа (ЧОО) до 70%. Но это преимущество ТТ не означает, что ответ на лечение будет длительным и рано или поздно наступит прогрессирование процесса.
Дальнейшее изучение канцерогенеза меланомы показало, что риск рецидива и прогрессирования заболевания напрямую зависит от способности иммунных клеток организма отвечать на рост злокачественного процесса. Факт открытия контрольных точек иммунного ответа, таких как PD-1/PDL-1/CTLA-4, стал важным пусковым моментом к разработке иммуноонкологических препаратов моноклональных антител, нацеленных на рецептор-лиганд программируемую смерть PD-1/PDL-1 (пембролизумаб, атезолизумаб, ниволумаб, спартализумаб) или цитотоксический Т-лимфоцитарный антиген 4 (CTLA-4) (ипилимумаб).
Явным преимуществом иммунотерапии по сравнению с ТТ стал более стойкий ответ и ингибирующее воздействие на рост меланомы, которое может сохраняться даже после прекращения приема препаратов. Однако самым большим недостатком является относительно низкая ЧОО, поскольку лишь небольшой процент людей реагирует на иммунотерапию.
Таким образом, учитывая преимущества использования каждого из этих двух терапевтических воздействий, была очевидна необходимость в разработке новых стратегий-комбинации таргетной и иммунотерапии.
На конференциях ASCO и ESMO в 2020 г. Gutzmer R. и соавторы представили результаты рандомизированного исследования III фазы IMspire150 [4, 5], посвященного эффективности тройной комбинации терапии. В исследование вошли пациенты с метастатической меланомой, ранее не получавшие терапию, с наличием мутации в гене BRAF. Также разрешалось включение пациентов с бессимптомными метастазами в головной мозг. Все больные получали вемурафениб в дозе 960 мг дважды в день и кобиметиниб в дозе 60 мг ежедневно на протяжении 28 дней. Пациенты контрольной группы продолжали получать вемурафениб в той же дозе дважды в день, а кобиметиниб — в прежней дозе ежедневно в течение трех недель с недельным перерывом и введением плацебо каждые две недели. Участники основной группы после 28-го дня начали получать вемурафениб в дозе 720 мг дважды в день и кобиметиниб по 60 мг ежедневно на протяжении трех недель с недельным перерывом, а также атезолизумаб в дозе 840 мг внутривенно каждые две недели. Лечение продолжалось до появления признаков прогрессирования заболевания или непереносимой токсичности. Основным критерием оценки эффективности была выживаемость без прогрессирования (ВБП), а вторичными конечными точками – ЧОО, его продолжительность, общая выживаемость (ОВ) и токсичность. При медиане наблюдения 19 месяцев ВБП составила 15,1 месяца в группе с атезолизумабом и 10,6 месяца в группе плацебо, что соответствует статистически значимому снижению относительного риска прогрессирования на 22% (ОР (отношение рисков) 0,78; p = 0,025). Положительный эффект атезолизумаба наблюдался во всех подгруппах пациентов. ЧОО была схожей и составила 66,3% и 65,0% соответственно, однако продолжительность ответа была значительно больше в группе с атезолизумабом (21,0 месяца против 12,6 месяца). Медиана ОВ составила 39,0 месяца (95%-ный доверительный интервал (ДИ) 29,9 – не поддается оценке) в группе атезолизумаба по сравнению с 25,8 месяца (22,0–34,6) в контрольной группе (ОР 0,84 (95% ДИ 0,66–1,06); p = 0,14). Таким образом, ОВ не была значительно улучшена при применении атезолизумаба, вемурафениба и кобиметиниба по сравнению с плацебо, вемурафенибом и кобиметинибом у пациентов с метастатической меланомой с положительной мутацией BRAF V600.
В декабре 2020 г. были опубликованы результаты двойного слепого рандомизированного плацебо-контролируемого исследования фазы II KEYNOTE-022, в котором была проведена оценка эффективности тройной комбинации пембролизумаба, дабрафениба и траметиниба по сравнению с дабрафенибом, траметинибом и плацебо. В исследование вошли 120 пациентов с метастатической меланомой, имеющие мутацию BRAF V600E/K, которые ранее не проходили лечение. Основной конечной точкой исследования являлась ВБП, тогда как вторичными конечными точками выступали ЧОО, продолжительность объективного ответа и ОВ [6].
На момент 36,6 месяца наблюдения медиана ВБП составила 16,9 месяца (95% ДИ 11,3–27,9) в группе тройной комбинированной терапии и 10,7 месяца (95% ДИ 7,2–16,8) в группе терапии ИТК (отношение рисков (ОР) 0,53; 95% ДИ 0,34–0,83). Через 24 месяца ВБП составила 41,0% (95% ДИ 27,4–54,2) для ИТК и 16,3% (95% ДИ 8,1–27,1) для таргетной терапии iBRAF/MEK. Медиана продолжительности объективного ответа составила 25,1 месяца (95% ДИ 14,1– не достигнута) в группе комбинированной тройной терапии и 12,1 месяца (95% ДИ 6,0–15,7) в группе терапии ИТК. Медиана ОВ для группы комбинированной тройной терапии не была достигнута, тогда как в группе ИТК она составила 26,3 месяца (ОР 0,64; 95% ДИ 0,38–1,06). Через 24 месяца ОВ составила 63,0% (95% ДИ 49,4–73,9) для ИТТ-комбинации и 51,7% (95% ДИ 38,4–63,4) для терапии BRAF/MEK-ингибиторами. Побочные эффекты 3–4-й степеней, связанные с лечением, наблюдались у 35 (58%) пациентов в исследуемой группе и у 15 (25%) пациентов в контрольной группе.
В данном исследовании комбинация пембролизумаба, дабрафениба и траметиниба значительно улучшила ВБП, продолжительность объективного ответа и ОВ у пациентов с метастатической меланомой с мутацией BRAF по сравнению с комбинированной ТТ, хотя статистическая значимость этого улучшения не была достигнута. Тем не менее медиана ВБП оказалась выше в группе тройной комбинации.
В мае 2022 г. опубликованы результаты исследования III фазы по эффективности тройной комбинации — COMBI-i, в котором сравнивали терапию спартализумабом в сочетании с дабрафенибом и траметинибом против группы плацебо плюс дабрафениб и траметиниб у пациентов с нерезектабельной или метастатической меланомой с мутацией BRAF V600. Основной конечной точкой была ВБП, а ключевой вторичной — ОВ [7].
В ходе наблюдения медиана ВБП составила 16,2 месяца (95% ДИ 12,7–23,9) в изучаемой группе и 12,0 месяца (95% ДИ 10,2–15,4) в группе плацебо + дабрафениб + траметиниб (ОР 0,82; 95% ДИ 0,66–1,03; p = 0,042). ЧОО составила 69% (183 из 267 пациентов) против 64% (170 из 265 пациентов) соответственно. Побочные эффекты были зарегистрированы у 55% (146 из 267) пациентов в группе спартализумаб + дабрафениб + траметиниб и у 33% (88 из 264) в группе плацебо + дабрафениб + траметиниб. Как и в исследовании KEYNOTE-022, данное исследование не достигло своей первичной конечной точки. Будущие исследования могут выявить субпопуляции пациентов, которые могут получить выгоду от данной комбинации препаратов; однако спартализумаб на данный момент не зарегистрирован для лечения диссеминированной BRAF-мутированной меланомы кожи [7].
Несмотря на наличие исследований тройной комбинации ИТТ при метастатической BRAF-мутированной меланоме, вопрос эффективности этого вида терапии во второй и последующих линиях лечения остается недостаточно изученным [8].
Целью данной работы является проведение анализа серии клинических случаев пациентов с диссеминированной меланомой кожи, получивших ИТТ в различных линиях лечения, для оценки эффективности (ЧОО и длительности лечения на фоне ИТТ) и токсичности проводимого лечения.
Материал и методы
Исследование основано на ретроспективном анализе 13 историй болезни пациентов с диссеминированной меланомой кожи, которые находились в клиниках Санкт-Петербургского городского клинического онкологического диспансера (n = 10) и клинике «Скандинавия» (n = 3) с 2020 по 2024 г.
В табл. 1 представлена общая характеристика больных, вошедших в исследование. Как видно из таблицы, средний возраст пациентов составил 47 лет (ДИ 95% (29-65)). 93,3% (n = 12) имели удовлетворительный общий соматический статус (значение ECOG 0–1). Количество женщин и мужчин было примерно одинаковым и составило 54% и 46% соответственно. Более половины больных имели референсные значения маркера лактатдегидрогеназы (ЛДГ) – 53,8% (n = 7). Кодон мутации BRAF V600E был определен у 76,9% пациентов (n = 10), в то время как кодон мутации BRAF V600R выявлен только в 7,7% (n = 1), в 15,4% (n = 2) кодон мутации BRAF V600 не был зафиксирован в медицинской документации. У большей части пациентов – 61,5% (n = 8) не было выявлено метастатического интракраниального поражения. У 31% больных (n = 4) больных определялось наличие более трех сайтов метастазирования. Наиболее часто встречающимся сайтом метастазирования у пациентов с метастатической меланомой с мутацией в гене BRAF являлось поражение отдаленных лимфатических узлов, которое выявлено у 84,6% пациентов (n = 11), а также кожи и мягких тканей (69,2%, n = 9), а наиболее редким сайтом вторичного поражения были кости (15,4%, n = 2). ТТ предшествовала проведению тройной комбинированной терапии в 53,8% случаев (n = 7), иммунная терапия – в 46,1% (n = 6), а цитостатическая – в 23,1% (n = 3). У 38,5% (n = 5) ИТТ проводилась в первой линии терапии диссеминированной BRAF-мутированной меланомы кожи и предшествующих терапевтических опций нет.
Исходя из представленных данных в табл. 2, комбинация атезолизумаб + вемурафениб + кобиметиниб была проведена у 76,9% (n = 10) в первой, второй, пятой и восьмой линиях лечения, комбинированная терапия пембролизумаб + дабрафениб + траметиниб использовалась у 15,4% (n = 2) во второй и третьей линиях, а также тройная комбинированная терапия спартализумаб + дабрафениб + траметиниб проведена только у одного пациента в первой линии лечения диссеминированной BRAF-мутированной меланомы кожи.
Оценка токсичности лечения на фоне ИТТ определялась с помощью шкалы общих критериев терминологии для неблагоприятных событий – Common Terminology Criteries for Adversial Events (CTCAE 5.0).
Оценка эффективности проводимого лечения проводилась с использованием критериев оценки ответа солидных опухолей RECIST 1.1 (Response Evaluation Criteria In Solid Tumors).
Результаты и обсуждение
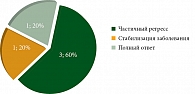
У пациентов, получивших лечение ИТТ в первой линии, эффективность лечения была значительно выше по сравнению с больными, у которых тройная комбинированная терапия проведена во второй, третьей, пятой и восьмой линиях лечения. Таким образом, частота ответов при лечении тройной ИТТ в первой линии составила: 60% – частичный регресс, 20% – полный ответ и 20% – стабилизация опухолевого процесса. Частота контроля над заболеванием (ЧКЗ) составила 40%. Во второй, третьей, пятой и восьмой линиях терапии ингибиторов контрольных точек иммунного ответа (ИКТИ) и ингибиторов тирозинкиназ (ИТК) у всех больных отмечена только стабилизация заболевания (рис. 1, 2).
Как видно из рис. 3, в группе больных с проведением ИТТ в первой линии наблюдается большая длительность лечения в сравнении с пациентами, у которых имелось в анамнезе предшествующее лечение ИКТИ или цитостатическими препаратами. Таким образом, длительность проведения ИТТ выше у пациентов в первой линии лечения метастатической меланомы с мутацией в гене.
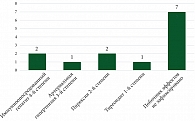
На фоне ИТТ отмечались следующие побочные эффекты (рис. 4):
иммунноопосредованный гепатит 4-й степени (n = 2; 15%), артериальная гипертензия 3-й степени (n = 1; 7,5%), пирексия 2-й степени (n = 2; 15%), тиреоидит 1-й степени (n = 1; 7,5%). Стоит отметить, что у 46,6% пациентов во время проведения ИТТ побочных эффектов не зафиксировано.
Клинический случай
Предлагаем рассмотреть клинический случай с проведением комбинированной ИТТ в первой линии диссеминированной BRAF-мутированной меланомы кожи.
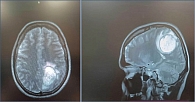
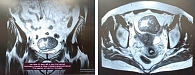
Пациент Т., женщина, 40 лет, считает себя больной с 2020 г., когда впервые обратила внимание на образование кожи на задней поверхности шеи справа. 08.09.2020 было выполнено широкое иссечение меланомы кожи головы и шеи с реконструктивно-пластическим компонентом (местными тканями). Гистологическое исследование (ГИ) от 24.08.2020: поверхностно распространяющаяся эпителиоидноклеточная меланома кожи с умеренной лимфоидной инфильтрацией, небольшим количеством пигмента, до 5 митозов в 1 мм2, толщиной по Бреслоу 1,8 мм, глубиной инвазии по Кларку IV, без достоверных признаков лимфоваскулярной инвазии, края резекции вне опухоли. Послеоперационный диагноз: меланома кожи задней поверхности шеи справа сT2N0M0/pT2аN0M0 стадия IB. Молекулярно-генетическое исследование (МГИ) выявило мутацию V600E в 600 кодоне гена BRAF. Пациентка динамически наблюдалась до июля 2024 г., когда появились жалобы на головокружение, дезориентацию в пространстве. По данным магнитно-резонансной томографии (МРТ) от 03.08.2024 определяется опухоль левой теменной доли с четкими ровными контурами с наличием кровоизлияний неизвестной давности размера 5,4 х 5,0 х 4,2 см; аналогичные образования найдены в левой теменной доле вдоль фалькса размерами 2,6 х 1,1 см, в полюсе левой височной доли – 0,9 х 0,6 см, в задних отделах левой височной доли – до 1,7 х 2,2 см. На МРТ картина объемных образований левой теменной области, левой височной доли, левой теменно-височной области с признаками масс-эффекта (рис. 5, 6). 12.08.24 выполнена краниотомия в теменной области слева.
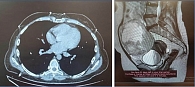
Проведены микрохирургическое удаление опухоли левой теменной доли слева с применением нейрофизиологического мониторинга, ГИ метастазов меланомы в головной мозг. По данным инструментальных обследований от 28.08.2024 выявлено прогрессирование заболевания в виде метастатического поражения легких, лимфатических узлов средостения, яичников, брюшины (рис. 7, 8).
Онкологическим консилиумом от 04.09.24 была рекомендована тактика лечения: проведение стереотаксической лучевой терапии на метастатические очаги в головном мозге; проведение лекарственной терапии в режиме тройной комбинации – вемурафениб 960 мг два раза в сутки + кобиметиниб 60 мг один раз в сутки + атезолизумаб 1200 мг один раз в три недели. Таргетная терапия в виде приема ингибиторов тирозинкиназ начата 18.09.24. Осложнением на фоне проведения терапии BRAF/MEK-ингибиторов была кожная токсичность 1-й степени. С 26.09.24 по 02.10.24 проведено пять сеансов стереотаксической лучевой терапии в режиме гипофракционирования на ложе удаленного метастаза в левой теменной доле.
С 09.10.24 начато проведение ИКТИ препаратом атезолизумаб 1200 мг на фоне приема ИТК. Осложнением лечения на фоне комбинированной ИТТ являлся иммунноопосредованный гепатит 4-й степени. С целью лечения иммунноопосредованного нежелательного явления (иНЯ) пациентке проводилась иммуно-супрессивная терапия метилпреднизолоном в дозировке 2 мг/кг с постепенным снижением дозы глюкокортикостероидов (ГКС) на протяжении одного месяца. На фоне проводимого лечения отмечена положительная динамика в виде нормализации показателей ферментов печени, улучшения общего самочувствия пациентки. Возобновление ТТ начато после восстановления функции печени до референсных значений ферментов аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ).
По данным МРТ головного мозга от 12.12.24 наблюдается картина кистозно-глиозных послеоперационных изменений в левой теменной доле, накапливающих по периферии контрастный препарат; не исключается остаточная ткань образований. Кавернозная ангиома левой височной доли (рис. 9, 10, 11).
По данным позитронно-эмиссионной компьютерной томографии от 12.12.24 признаков патологической метаболически активной ткани не отмечается. Определены аметаболичные средней плотности образования правого яичника 79 на 55 мм аксиально (рис. 12, 13).
Выводы по клиническому случаю
- Назначение комбинированной ИТТ в первой линии через три месяца лечения привело к быстрому частичному ответу (полный метаболический ответ по метастазам в грудной клетке, брюшной полости, малом тазу, частичный ответ по очагам в головном мозге).
- В начале лечения был зафиксирован иммунноопосредованный гепатит 4-й степени (успешно купирован) и кожный зуд 1-й степени.
- Пациентка продолжает прием ТТ. В настоящее время терапия переносится удовлетворительно, без осложнений.
Заключение
ИТТ метастатической меланомы кожи открывает новые горизонты в лечении этого заболевания. С каждым годом появляются новые данные о механизмах действия препаратов, их комбинациях и способах преодоления устойчивости опухолей к терапии. Это дает надежду на более эффективные и персонализированные подходы к лечению меланомы, улучшает качество жизни и выживаемость пациентов.
A.V. Pudina, I.M. Itkin, N.Yu. Antimonik, S.I. Kutukova, R.V. Orlova
Saint Petersburg State University
City Clinical Oncology Dispensary, Saint Petersburg
Saint Petersburg State Medical University named after I.P. Pavlov
Contact person: Anastasia V. Pudina, Nastya.pudina@bk.ru
The article presents an analysis of the use of combined therapy with BRAF/MEK inhibitors and PD-1 checkpoint inhibitors in patients with metastatic cutaneous melanoma with a mutation in the BRAF gene. The analysis included 13 patients who received one of the combined targeted-immunotherapy regimens: atezolizumab + vemurafenib + cobimetinib, pembrolizumab + dabrafenib + trametinib and spartalizumab + dabrafenib + trametinib.
The aim of this study is to analyze the use of combined immuno-targeted therapy (ITT) in different lines of treatment, assessing the efficacy and toxicity of the administered regimens. A comparative analysis of the treatment regimens was not conducted due to insufficient case sampling for statistical processing.
Results. The most effective treatment, in terms of objective response rate (ORR), was observed with the triple combination in the first line of therapy. The objective response rate was 80%: 60% – partial response and 20% – complete response. Disease stabilization was reported at 20%. In the 2nd, 3rd, 5th, and 8th lines of combined ITT, disease stabilization was 100%. The following side effects were recorded during combined ITT: immune-mediated hepatitis grade 4 (n = 2; 15%), grade 3 hypertension (n = 1; 7.5%), grade 2 pyrexia (n = 2; 15%), and grade 1 thyroiditis (n = 1; 7.5%). The severity of adverse events observed during treatment with the triple combination was associated with high treatment efficacy. Keywords: immuno-targeted therapy, BRAF/MEK inhibitors, immune checkpoint inhibitors, metastatic BRAF-mutated cutaneous melanoma.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


