Ингибиторы иммунных контрольных точек в лечении меланомы без выявленного первичного очага: описание клинического случая
- Аннотация
- Статья
- Ссылки
- English
Введение
Меланома без выявленного первичного очага (меланома без ВПО), или мelanoma of unknown primary (MUP), является гетерогенным заболеванием и представлена морфологически подтвержденными метастазами одной или нескольких локализаций: лимфатические узлы, подкожная клетчатка, мягкие ткани, кожа, внутренние органы.
Широкий диапазон частоты встречаемости указанной патологии, обозначенный, по данным ряда авторов, в интервале от 1,2 до 31% [1–8], обусловлен совершенствованием технологий медицинской визуализации [9], связан со сложностями, присущими определению «меланома без ВПО/MUP», с различиями в объемах обследования и в интерпретации критериев исключения T. Dasgupta [10]. K. Kamposioras и соавт. в 2011 г. опубликовали результаты крупного систематического обзора и продемонстрировали истинную частоту встречаемости меланомы без ВПО, равную 3,2%, указав на то, что только в 16% рецензируемых статей и рефератов использовались оригинальные критерии исключения T. Dasgupta для постановки диагноза «меланома без ВПО» [9]. В 1963 г. T. Dasgupta и соавт. предложили четыре диагностических критерия исключения, позволяющие выявить меланому без ВПО [11]:
1) доказательства предыдущей экзентерации или энуклеации орбиты;
2) доказательства предшествующего иссечения кожи, электроиссечения, коагуляции или других хирургических манипуляций невусов, веснушек, родимого пятна, паронихий или дефектов кожи;
3) признаки метастатической меланомы в дренирующем лимфатическом узле с наличием рубца на коже в проекции бассейна этого лимфатического узла;
4) отсутствие неполного медицинского осмотра, в том числе офтальмологического, анального и генитального.
Меланома без ВПО чаще всего выявляется в лимфатических узлах (40–60% всех случаев) и поражает подмышечные, шейные, паховые, околоушные лимфатические узлы в 52,2, 32,7, 28,3 и 2,6% случаев соответственно [9, 12, 13]. У мужчин данное злокачественное новообразование наиболее часто связано с поражением подмышечных и шейных лимфатических узлов, тогда как у женщин – с поражением паховых лимфатических узлов [9].
Согласно восьмому изданию критериев стадирования Американского объединенного комитета по раку (American Joint Committee on Cancer – AJCC), у пациентов с метастазами меланомы в коже, подкожной клетчатке, мягких тканях и/или лимфатических узлах без ВПО диагностируется третья стадия заболевания, у пациентов с отдаленными метастазами, включая висцеральные метастазы, – четвертая стадия болезни [14].
Ряд исследований продемонстрировал лучшую выживаемость у пациентов с меланомой без ВПО третьей и четвертой стадий по сравнению с пациентами, имеющими меланому третьей и четвертой стадий с известным первичным очагом [1, 15–18]. Данный факт косвенным образом указывает на биологические различия между этими проявлениями болезни [19]. В 2021 г. D. Verver и соавт. сообщили о том, что при проведении сравнительного анализа у пациентов с меланомой без ВПО чаще выявлялось распространенное и метастатическое заболевание, ассоциированное с более низким функциональным статусом, высоким уровнем лактатдегидрогеназы и метастазами в центральной нервной системе [20]. Несмотря на выявленную закономерность, в скорректированном анализе общая выживаемость (ОВ) у больных с меланомой без ВПО была выше (относительный риск (ОР) 0,70 при 95%-ном доверительном интервале (ДИ) 0,58–0,85; р < 0,001) по сравнению с пациентами, имеющими распространенную и метастатическую меланому с известным первичным очагом [20], тогда как при проведении грубого анализа ОВ была сопоставимой. По мнению исследователей, данный факт указывает на то, что пациенты с меланомой без ВПО и больные меланомой с известным первичным очагом в равной степени получат пользу от терапии новыми препаратами (ингибиторами иммунных контрольных точек (ИИКТ), ингибиторами BRAF/MEK) [20]. Авторы акцентируют внимание на нецелесообразности отказа в назначении инновационной лекарственной терапии пациентам с поздней стадией меланомы без ВПО [20].
Ингибиторы иммунных контрольных точек в лечении меланомы без выявленного первичного очага
Иммуноопосредованный контроль над первичной опухолью у пациентов с меланомой без ВПО [21], ассоциированный с регрессией первичного очага, высокая частота мутаций V600K [22] теоретически могут указывать на высокий ожидаемый ответ от использования ИИКТ.
Результаты эффективности применения данной группы препаратов у пациентов с меланомой без ВПО в рандомизированных клинических исследованиях отдельно не сообщались.
В 2020 г. D. Verver и соавт. опубликовали результаты популяционного обсервационного исследования, посвященного изучению результатов лечения меланомы без ВПО в эпоху иммунотерапии и таргетной терапии в Нидерландах [19]. Исследователи оценили ОВ среди пациентов с третьей и четвертой стадиями меланомы без ВПО, используя общенациональную базу данных в период 2003–2016 гг. Популяция была разделена на группы в зависимости от того, в какой временной период пациенты получали современную противоопухолевую терапию. Для пациентов с третьей стадией меланомы, получавших терапию в интервале 2003–2010 гг., пятилетняя выживаемость составила 48,5% и 50,2% – для больных, лечившихся с 2011 по 2016 г. (р = 0,948). Авторы исследования продемонстрировали статистически достоверное увеличение ОВ с 4 до 11 месяцев в когорте пациентов с четвертой стадией меланомы без ВПО, у которых проводилась терапия ИИКТ и таргетными препаратами (p < 0,001). Мультипараметрический анализ факторов, влияющих на ОВ у данной категории больных, показал, что применение иммунотерапии в первой линии ассоциировано с более благоприятным прогнозом по сравнению с таргетной терапией – медиана ОВ при использовании иммунотерапии составила 18 месяцев и 8 месяцев – в случае применения таргетной терапии (p < 0,001) [19].
P. Del Fiore и соавт., проводя ретроспективное когортное исследование, проанализировали данные 127 (2,7%) пациентов с меланомой без ВПО, обращавшихся в два медицинских учреждения Северо-Восточной Италии с 1985 по 2018 г. [21]. При медиане наблюдения 32 месяца трехлетняя выживаемость без прогрессирования (ВБП) составила 54%, а трехлетняя ОВ – 62%. Наихудшие показатели ОВ и ВБП ассоциированы с более старшим возрастом (р = 0,0001 для ОВ, р = 0,008 для ВБП), четвертой стадией (р < 0,0001 для ОВ, р = 0,0001 для ВБП) и высоким индексом коморбидности Чарлсона (р < 0,0001 для ОВ, р = 0,01 для ВБП). Пациенты с наличием метастазов в лимфатических узлах без ВПО имели более продолжительные показатели ВБП (p = 0,001) и ОВ (p = 0,0008) по сравнению с больными, страдающими (под)кожными формами метастатической меланомы. Медиана размера поражения лимфатических узлов составляла 4 см независимо от стадии по AJCC – третьей или четвертой. Наиболее распространенным вариантом хирургического лечения являлась полная диссекция лимфатических узлов. Показатель ОВ пациентов, перенесших данное вмешательство, ассоциирован с количеством метастатических лимфатических узлов (ОР 1,06 (95% ДИ 1,01–1,11); р = 0,01) без существенной корреляции с числом удаленных лимфатических узлов (ОР 1,00 (95% ДИ 0,96–1,03); р = 0,79). У больных, получавших иммунотерапию, отмечены более высокие показатели выживаемости в отличие от таковых при использовании химио- и таргетной терапии. Согласно результатам данного исследования, типичный портрет пациента с меланомой без ВПО представлен больными мужского пола со средним возрастом 59 лет и наличием метастазов меланомы в лимфатические узлы без ВПО. Исследователи пришли к выводам о том, что полная диссекция лимфатических узлов и иммунотерапия (интерфероны, ИИКТ) были связаны с лучшими показателями выживаемости [21]. Ретроспективный характер данного одноцентрового исследования с длительным периодом включения и наблюдения, по мнению его авторов, связан с рядом существенных ограничений и искажений полученной информации: узкие границы возможности обобщения результатов и доступа к материалам для оценки мутационного статуса, гетерогенность лечения, современные лечебно-диагностические возможности, доступные в настоящее время как на этапе адъювантного лечения, так и в условиях терапии метастатических форм заболевания, могут нивелировать различия между меланомой без ВПО и меланомой с известным первичным очагом [21].
Анализ базы данных PubMed продемонстрировал ограниченное количество исследований по изучению использования ИИКТ при метастазах меланомы без ВПО, в том числе при метастазах меланомы в лимфатические узлы без ВПО [19, 23–25]. Результаты поиска сводились в основном к анализу информации, полученной из конкретных клиник, или к описанию отдельных клинических случаев [7, 19–21, 26, 27]. Пациенты с меланомой без ВПО, получающие иммунотерапию ИИКТ, вероятно, демонстрируют лучшие результаты лечения по сравнению с пациентами с меланомой с известным первичным очагом [23]. В 2019 г. T. Gambichler и соавт. опубликовали предварительные результаты эффективности ИИКТ у пациентов с меланомой без ВПО, продемонстрировав достижение контроля над заболеванием после начала иммунотерапии у 77,8% (7 из 9) пациентов против 40,6% (13 из 32) больных, имевших меланому с известным первичным очагом (р = 0,052) [24].
Описание клинического случая
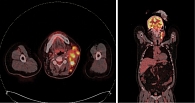
Пациент 1961 г. р. Дебют заболевания в 60 лет.
Основной диагноз: метастазы меланомы в лимфатические узлы шеи слева без ВПО. Мутации в генах BRAF и С-KIТ не выявлены.
Сопутствующий диагноз: артериальная гипертензия второй стадии третьей степени четвертого риска, НК – 0, ФК – 2, ожирение первой степени.
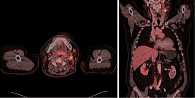
В феврале 2021 г. обратил внимание на появление опухолевидного образования в области левой половины шеи. Обследован челюстно-лицевым хирургом по месту жительства. Произведена инцизионная биопсия конгломерата лимфатических узлов шеи слева. Гистологическое исследование от 03.04.2021 – фиброзная строма с пигментом темно-коричневого цвета, микроскопическая группа мономорфных клеток эпителиоидной формы. Проведено иммуногистохимическое исследование: экспрессия S100, Melan A, HMB-45, выявлена экспрессия СК АЕ1/АЕ3, CD68 – морфологическая и иммуногистохимическая картина меланомы. Молекулярно-генетическое исследование: мутации в генах BRAF и С-KIТ не выявлены. На момент обращения в Тульский областной клинический онкологический диспансер состояние пациента удовлетворительное, ECOG –1, индекс Карновского – 90. Лабораторные анализы без клинически значимых отклонений. Status localis: в средней и верхней трети шеи слева с переходом на левую околоушную область пальпируется конгломерат фиксированных лимфатических узлов до 7,5 см в наибольшем измерении. Произведен поиск первичного очага – данных за наличие первичного очага не выявлено. При проведении позитронно-эмиссионной томографии, совмещенной с рентгеновской компьютерной томографией (ПЭТ/КТ), на момент скрининга от 16.04.2021 выявлен конгломерат верхних передних и задних яремных лимфатических узлов (IIa и IIb уровни) размером 48 × 72 × 66 мм (SUV 16,25) (рис. 1). Произведена оценка резектабельности опухолевого процесса: конгломерат метастатических узлов шеи слева фиксирован к бифуркации общей сонной артерии – опухолевый процесс признан нерезектабельным. Учитывая результаты молекулярно-генетического тестирования, ожидаемую продолжительность жизни пациента – более трех месяцев, наличие нерезектабельного опухолевого процесса, принято решение о назначении ИИКТ пролголимаба в стандартной зарегистрированной дозе. С 25.06.2021 начата иммунотерапия пролголимабом. Через две недели зафиксирован выраженный положительный эффект в виде частичного регресса. 09.07.2021 при пальпации определялся относительно смещаемый конгломерат лимфатических узлов в зоне бифуркации общей сонной артерии слева диаметром 40 мм. 09.07.2021 на ультразвуковом исследовании лимфатических узлов шеи визуализированы множественные увеличенные лимфатические узлы с диффузной резко сниженной эхогенностью, с потерей дифференцировки и изменением формы лимфатических узлов: VI уровень – 7 × 6 мм, III уровень – 15 × 10 мм, V уровень – 13 × 11 мм, IIb уровень – 28 × 10 мм, Ib уровень – 15 × 13 мм, одиночные аналогичного вида Iа уровня лимфоузлы справа до 10 × 6 мм. Через три месяца проведено контрольное обследование по ПЭТ/КТ, по результатам которого зафиксировано существенное уменьшение контрольного очага до 15 мм (в 4,8 раза) и снижение SUV до 13,8 (рис. 2). Терапия пролголимабом продолжена. Цикличность лечения прервана один раз по причине острого бронхита в декабре 2021 г., интервал между введениями препарата составил 33 дня. С 25.06.2021 по 15.07.2022 проведено 25 циклов иммунотерапии препаратом пролголимаб в дозе 1 мг/кг в/в один раз в две недели. Реализация частичного ответа продолжается. При пальпаторном исследовании шеи в июле 2022 г. в проекции бифуркации общей сонной артерии определялся плотно-эластичный лимфатический узел до 1,5 см в диаметре. При очередной ПЭТ/КТ 30.03.2022 на шее слева (IIa, IIb) визуализирован лимфатический узел размером 11 мм (SUV 11,0).
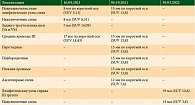
При оценке динамики по данным ПЭТ/КТ определены нетаргетные очаги (таблица).
Серьезных нежелательных явлений и отклонений лабораторных параметров во время лечения не отмечалось. В течение года лечения зафиксировано несколько эпизодов изменения массы тела с максимальной прибавкой 17 кг. Указанные изменения обусловлены образом жизни и алиментарными причинами. Лабораторных и клинических данных за наличие эндокринопатий не выявлено. Повторно проведен поиск первичного очага. Данных за наличие первичного очага не выявлено.
Выводы
Данный клинический случай демонстрирует быстрый, глубокий и стойкий частичный ответ на иммунотерапию пролголимабом у пациента с метастазами меланомы в лимфатические узлы шеи без ВПО с отсутствием мутации в гене BRAF V600.
Эффективность применения пролголимаба у пациентов с меланомой без ВПО требует дальнейшего изучения.
Целесообразно создание национальной базы данных больных с меланомой без ВПО, включая их биообразцы, для изучения патогенеза, биологических особенностей опухолевого процесса, разработки оптимального алгоритма диагностики и анализа результатов лечения.
Е.V. Каrabina
Tula Regional Clinical Oncological Dispensary
Contact person: Еlena V. Каrabina, kev-251@yandex.ru
This article is devoted to the review of information on the use of immune checkpoint inhibitors in the treatment of melanoma of unknown primary and the presentation of a clinical case demonstrating a rapid and deep response to prolgolimab in a patient with melanoma unknown primary with metastases in the neck lymph nodes and without mutation in the BRAF V600 gene.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.