количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Патогенетическое обоснование применения ноотропных препаратов у детей с гиперактивным мочевым пузырем
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" № 2 (16)
- Аннотация
- Статья
- Ссылки
- English
В обзоре приведены данные, касающиеся патогенеза гиперактивного мочевого пузыря у детей. Показано, что одним из важных звеньев патогенеза нейрогенной дисфункции мочевого пузыря является нарушение регуляции вегетативной нервной системы на любом ее уровне. Представлены данные об эффективности использования вегетотропных и ноотропных препаратов, в частности пантогама, для лечения гиперактивного мочевого пузыря.
В последнее время изучением нарушения уродинамики мочевого пузыря у детей занимаются не только детские урологи, но и нефрологи. Это связано прежде всего с высокой распространенностью нейрогенной дисфункции мочевого пузыря (НДМП), которая, по данным российских исследователей, составляет 6–15% [1–3]. По результатам многоцентрового исследования, проведенного экспертами Международного общества по проблеме недержания мочи у детей (International Children’s Continence Society – ICCS) в странах Северной Европы, это заболевание встречается у 17% детей 5–12 лет [4]. Среди нефрологических и урологических больных данный показатель достигает 50–60% [5, 6].
Термин «гиперактивный мочевой пузырь» (ГАМП), введенный Международным обществом по проблемам недержания мочи (International Continence Society – ICS) в 1997 г., широко использовался во взрослой урологической практике [7]. В детской урологии он применяется с 2004 г. [5, 8].
В 2006 г. ICCS, руководство Европейской ассоциации урологов (European Association of Urology – EAU), руководство Немецкого общества детской и подростковой психиатрии, психотерапии и психосоматики (Deutsche Gesellschaft für Kinder und Jugendpsychiatrie, Psychosomatik und Psychotherapie – DGKJP) представили рекомендации для врачей, содержащие унифицированные принципы классификации и диагностические критерии. Основными клиническими признаками ГАМП являются поллакиурия, императивные позывы к мочеиспусканию и императивное недержание мочи различной степени выраженности, частые и редкие мочеиспускания [9, 10]. Уродинамическое исследование показывает, что для гиперактивного мочевого пузыря характерны непроизвольные сокращения детрузора в фазе заполнения с амплитудой > 15 см водного столба [3].
Детрузор обладает адаптационными свойствами – способностью к сохранению низкого давления в полости мочевого пузыря при накоплении мочи, что обеспечивается функциональным состоянием симпатической и парасимпатической нервной систем и их взаимодействием с центральной нервной системой (ЦНС), и отсутствием незаторможенных сокращений. Важной функцией детрузора также является работа в условиях повышающегося внутрибрюшного давления. При этом мочеиспускание инициируется произвольным сокращением детрузора и может быть произвольно прервано, что характеризует детрузор как стабильный [3].
Мочевой пузырь считается норморефлекторным, если мочеиспускание возникает при нормальном объеме мочевого пузыря. Если непроизвольные мышечные сокращения мочевого пузыря возникают при его объеме меньше нормы и не поддаются волевым усилиям, то говорят о гиперрефлексии детрузора. Согласно рекомендациям ICS гиперактивность мочевого пузыря подразделяют на нейрогенную, когда у пациента имеется неврологическая патология, и идиопатическую, когда причина гиперактивности не ясна [9, 10].
Кроме того, вследствие нарушения нормальной уродинамики мочевого пузыря часто возникают осложнения, в том числе приводящие к развитию хронической почечной недостаточности и инвалидизации детей: пузырно-мочеточниковый рефлюкс, мегауретер, пиелонефрит, цистит [11, 12]. Из-за проблем с мочеиспусканием возникают нарушения психической и физической активности пациента, что затрудняет его социальную адаптацию в обществе. Как следствие – трудности в общении со сверстниками, отставание в учебе, конфликтные ситуации в семье. Все это свидетельствует о высокой социальной значимости проблемы [13, 14].
Таким образом, актуальность проблемы нарушений функции мочевого пузыря обусловлена не только снижением качества жизни детей, но и развитием осложнений, к которым приводит НДМП.
Патогенез НДМП сложен и до конца не изучен. Основная роль принадлежит регулирующему действию гипоталамо-гипофизарной системы. Большое значение имеют возрастные особенности темпов созревания симпатического и парасимпатического отделов вегетативной нервной системы, нестабильность метаболизма головного мозга, а также присущая детскому организму склонность к развитию генерализованных реакций в ответ на локальное раздражение, что определяет больший полиморфизм и выраженность синдрома у детей по сравнению со взрослыми. Нарушения вегетативной нервной системы приводят к разнообразным изменениям функций симпатической и парасимпатической систем с нарушением выделения медиаторов (норадреналина, ацетилхолина), гормонов коры надпочечников и других желез внутренней секреции, ряда биологически активных веществ (полипептидов, простагландинов), а также к нарушениям чувствительности сосудистых альфа- и бета-адренорецепторов [3, 15, 16].
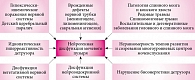
Ввиду сложности нервных механизмов, регулирующих функционирование мочевого пузыря, при различных травмах и заболеваниях нарушается регуляция мочевого пузыря. Изменение регуляции вегетативной нервной системы на любом ее уровне – одна из ведущих причин развития НДМП. Основные причины нейрогенной дисфункции мочевого пузыря представлены на рисунке.
У детей с расстройствами мочеиспускания одновременно развивается дисфункция висцеральных органов, приводящая к значительным морфофункциональным изменениям в желудочно-кишечном тракте, органах малого таза, ЦНС, системах кровообращения и обмена веществ [17].
Так, при обследовании 165 детей в возрасте от 5 до 15 лет (первично выявленных при плановом диспансерном осмотре в детских учреждениях г. Петрозаводска) с дисфункциональным мочеиспусканием и энкопрезом без органического поражения ЦНС был выявлен синдром вегетативных дисфункций. Результаты урологического обследования, дополненного регистрацией ритма спонтанных мочеиспусканий, показали наличие у всех детей синдрома ГАМП [18]. Формированию вегетососудистой дистонии во многом способствуют перинатальные поражения ЦНС, приводящие к церебральным сосудистым расстройствам, нарушению ликвородинамики, гидроцефалии, повреждению гипоталамуса и других отделов лимбико-ретикулярного комплекса. Повреждение центральных отделов вегетативной нервной системы вызывает эмоциональный дисбаланс, невротические и психотические нарушения у детей, неадекватные реакции на стрессовые ситуации, что также влияет на формирование и течение вегетососудистой дистонии [19, 20].
Эффективность ноотропных препаратов при нарушениях мочеиспускания у детей доказана в ряде исследований. Одним из ноотропных препаратов, часто применяемых при нарушениях мочеиспускания, является пантогам – кальциевая соль D(+)-пантоил-гамма-аминомасляной кислоты. Пантогам – естественный метаболит гамма-аминомасляной кислоты (ГАМК) в нервной ткани. Благодаря присутствию в молекуле пантогама пантоильного радикала препарат проникает через гематоэнцефалический барьер и оказывает выраженное действие на функциональную активность ЦНС. Его фармакологические эффекты обусловлены прямым влиянием на ГАМК-рецепторно-канальный комплекс, оказывающий также активирующее влияние на образование ацетилхолина. Сочетание мягкого психостимулирующего и умеренного седативного эффекта улучшает интегративные функции у детей, снижает волнение и тревожность, нормализует сон, способствует полноценному отдыху. У детей с нарушениями мочеиспускания положительный эффект обусловлен вегетотропной активностью препарата, его транквилизирующим действием, способностью повышать контроль подкорковых областей, стимулировать корковую деятельность и формировать условно-рефлекторные связи, а также действовать непосредственно на функцию сфинктера, влияя на ГАМК-рецепторы, расположенные в том числе и в мочевом пузыре [20, 21].
М.А. Мамаева и Л.П. Смирнова (1999) показали, что общая эффективность схемы лечения НДМП с использованием пантогама у детей составила 83,7% (против 53,2% в группе сравнения с применением холинолитиков – атропина, белладонны и др.), купирование энуреза отмечалось у 37,2% детей основной группы (6,4% в группе сравнения). Причем у детей старше 7 лет энурез купировался почти в половине случаев (47% в основной группе, 10,5% в группе сравнения). Кроме того, клиническая эффективность лечения сочеталась с улучшением уродинамических показателей [20, 22].
По данным Т.В. Отпущенниковой и И.В. Казанской (2006), препараты гопантеновой кислоты нормализуют вегетативные нарушения, улучшают церебральную гемодинамику, увеличивают эффективный объем мочевого пузыря, снижают число мочеиспусканий, частоту и выраженность императивных позывов и недержания мочи. В проведенном исследовании препарат принимали курсами по 250–500 мг (в зависимости от возраста) 3 раза в сутки в утренние и дневные часы в течение 60 дней. По окончании курса терапии у 91% больных отмечалась положительная динамика в виде редукции нервно-психических расстройств, таких как повышенная аффективная возбудимость, раздражительность, психомоторная расторможенность, агрессивность (p < 0,05). Средняя продолжительность ремиссии энуреза составила 97,3 ± 21,2 дня (до лечения 10,5 ± 3,8 дня) (p < 0,05) [20, 23].
В исследовании И.Е Алешина и Е. Ю. Зайцева (2014) показана эффективность применения гопантеновой кислоты в комплексной терапии больных с нейрогенной дисфункцией мочевого пузыря. Участники исследования принимали пантогам внутрь из расчета 25–50 мг/кг/сут курсами по 2 месяца в комплексе с витаминами группы B, PP, A и E в возрастных дозировках, седативные препараты растительного происхождения. Пациентам также были назначены физиопроцедуры. В контрольной группе дети получали седативные препараты, витаминотерапию. Им назначали лечебную физкультуру, массаж и физиолечение. При оценке динамики лечения через 48 недель в исследуемой группе отмечался прирост эффективного объема мочеиспускания на 46,13% от исходного уровня, что на 27,84% больше, чем в контрольной группе. Кроме того, в основной группе наблюдалось полное купирование энуреза в 38,5%, тогда как в контрольной группе этот показатель составлял 8,56%. Общая эффективность применения гопантеновой кислоты в комплексной терапии больных с НДМП составила 41,97%, в контрольной группе – 17,51% [24].
Таким образом, пантогам оказывает комплексное действие:
- повышает устойчивость головного мозга к гипоксии;
- стимулирует анаболические процессы в нейронах;
- сочетает умеренное седативное действие с мягким стимулирующим эффектом;
- уменьшает моторную возбудимость;
- активирует умственную и физическую работоспособность;
- обладает вегетотропной активностью;
- повышает контроль подкорковых областей;
- стимулирует корковую деятельность;
- способствует формированию условно-рефлекторных связей;
- действует непосредственно на функцию сфинктера, ГАМК-рецепторы мочевого пузыря;
- вызывает торможение патологически повышенного пузырного рефлекса и тонуса детрузора.
Исходя из этого препарат можно рекомендовать как в качестве монотерапии, так и в составе комплексной терапии синдрома ГАМП.
1. Вишневский Е.Л. Гиперактивный мочевой пузырь. Материалы пленума Российского общества урологов. Тюмень, 2005. С. 322–351.
2. Зоркин С.Н., Гусарова Т.Н., Борисова С.А. Нейрогенный мочевой пузырь у детей. Возможности фармакотерапии // Лечащий врач. 2009. № 1. С. 37–39.
3. Морозов С.Л. Современные представления о нейрогенной дисфункции мочевого пузыря // Российский вестник перинатологии и педиатрии. 2013. Т. 58. № 4. С. 24–29.
4. www.i-c-c-s.org.
5. Морозов С.Л., Гусева Н.Б., Длин В.В. Перспектива энерготропной терапии нейрогенной дисфункции мочевого пузыря // Российский вестник перинатологии и педиатрии. 2013. Т. 58. № 5. С. 35–38.
6. Вишневский Е.Л., Казанская И.В., Игнатьев P.O., Гусева Н.Б. Эффективность лечения гиперактивного мочевого пузыря у детей дриптаном // Врачебное сословие. 2005. № 4–5. С. 32–35.
7. Abrams Р.А., Wein A.J. Introduction: Overactive bladder and its treatments // Urology. 2000. Vol. 55. Suppl. 5A. P. S12.
8. Raes A., Hoebeke P., Segaert I. et al. Retrospective analysis of efficacy and tolerability of tolterodine in children with overactive bladder // Eur. Urol. 2004. Vol. 45. № 2. P. 240–244.
9. Neveus T., von Gontard A., Hoebeke P. et al. The standardization of terminology of lower urinary tract function in children and adolescents: report from the Standardisation Committee of the International Children's Continence Society // J. Urol. 2006. Vol. 176. № 1. P. 314–324.
10. Chase J., Austin P., Hoebeke P. et al. The management of dysfunctional voiding in children: a report from the Standardisation Committee of the International Children's Continence Society // J. Urol. 2010. Vol. 183. № 4. P. 1296–1302.
11. Морозов В.И., Ахунзянов А.А., Тахаутдинов Ш.К., Байбиков Р.С. Лечение нейрогенной дисфункции мочевого пузыря у детей (уронефрологические и неврологические аспекты) // Журнал неврологии и психиатрии им. С.С. Корсакова. 2005. № 7. С. 58–62.
12. Астапенко А.В., Лихачев С.А., Забродец Г.В. Нейрогенный мочевой пузырь: патогенез, классификация, клиника, диагностика, лечение // Белорусский медицинский журнал. 2002. № 2. С. 4–6.
13. Филин В.А., Кузнецова Н.И., Михеева И.Г. Детско-родительские отношения в семьях девочек с нейрогенной дисфункцией мочевого пузыря // Педиатрия. Журнал им. Г.Н. Сперанского. 2009. № 8. С. 18–22.
14. Fan Y.H., Lin A.T., Wu H.M. et al. Psychological profile of female patients with dysfunctional voiding // Urology. 2008. Vol. 71. № 4. P. 625–629.
15. Пугачев А.Г. Детская урология. М.: ГЭОТАР-Медиа, 2009.
16. Bauer S.B. Neurogenic bladder: etiology and assessment // Pediatr. Nephrol. 2008. Vol. 23. № 4. P. 541–551.
17. Морозов В.И. Сочетание дисфункции висцеральных органов у детей с нейрогенной дисфункцией мочевого пузыря // Педиатрия. Журнал им. Г.Н. Сперанского. 2007. Т. 86. № 6. С. 35–40.
18. Вишневский Е.Л., Лоран О.Б., Гусева Н.Б., Никитин С.С. Особенности нейрогуморальной регуляции у детей с сочетанными нарушениями функций тазовых органов // Урология. 2013. № 6. С. 90–96.
19. Сухотина Н.К., Крыжановская И.Л., Копелевич В.М. и др. Пантогам в клинике психических заболеваний детского возраста. М., 2000.
20. Сафонова И.А., Черникова И.В. Критерии диагностики и принципы терапии нейрогенного мочевого пузыря. Руководство для врачей. Ростов-на-Дону: Рост ГМУ, 2011.
21. Кузенкова Л.М., Маслова О.И., Тимофеева А.Г. и др. Ноотропная терапия в лечении энуреза у детей // Трудный пациент. 2005. Т. 5. № 10. С. 2–4.
22. Мамаева М.А., Смирнова Л.П. Нейрогенные дисфункции мочевого пузыря у детей // Terra medica nova. 1999. № 3. С. 31–34.
23. Отпущенникова Т.В., Казанская И.В. Современные методы лечения энуреза при нарушениях мочеиспускания у детей // Лечащий врач. 2009. № 5. С. 47–51.
24. Алешин И.В., Зайцев Ю.Е. Эффективность гопантеновой кислоты в комплексной терапии больных с нейрогенной дисфункцией мочевого пузыря // Медицинский совет. 2014. № 1. С. 88–91.
Pathogenetic substantiation of administering nootropics in children with overactive bladder
V.V. Dlin, S.L. Morozov, N.B. Guseva, E.I. Shabelnikova
Moscow Clinical and Research Institute of Pediatrics and Children's Surgery
Contact person: Sergey Leonidovich Morozov, mser@list.ru
The data regarding pathogenesis of overactive bladder in children are reviewed. It has been shown that dysregulation of vegetative nervous system at any level is considered to be one of the most important pathogenetic pathways of neurogenic bladder dysfunction. The data about efficacy of vegetotropic drugs and nootropics, in particular pantogam, in treatment of overactive bladder are presented.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.