Первичная меланома пищевода
- Аннотация
- Статья
- Ссылки
- English
Первичная меланома пищевода (ПМП) – крайне редкое злокачественное новообразование, развивающееся из меланоцитов базального слоя слизистой оболочки, на которое приходится 0,5% всех внекожных форм меланомы. Оценочная заболеваемость составляет 0,0036 случая на миллион в год [1]. В структуре злокачественных новообразований пищевода меланома не превышает 0,1–0,5% [2]. Частота встречаемости ПМП наиболее высока среди населения Японии и, возможно, коррелирует с повышенной распространенностью меланоза пищевода (МП) в указанной группе [3]. По всему миру было описано не более 400 случаев, большинство из которых представляют собой клинические наблюдения [4]. ПМП преимущественно встречается у мужчин (соотношение мужчин и женщин составляет примерно 1,6–2:1) в возрасте 60–70 лет, несколько чаще среди населения Японии [5]. Опухоль преимущественно локализуется в средней и нижней трети пищевода. Прогноз ПМП неблагоприятный, в большинстве случаев заболевание диагностируется на поздней стадии, на момент установления диагноза у 30–40% пациентов выявляются метастазы. По данным S. Gao и соавт., средняя выживаемость пациентов с ПМП составляет 18,1 месяца [6].
Этиология и теории патогенеза ПМП
В настоящее время связь между ПМП и известными канцерогенами, такими как алкоголь и табакокурение, не установлена, также не изучены фоновые заболевания и состояния, предшествующие развитию ПМП. В качестве последних рассматриваются само наличие у части пациентов единичных меланоцитов в слизистой пищевода и МП.
Первоначально возможность существования меланомы пищевода как первичной опухоли подвергалась сомнению, предполагалось, что она является вторичной и развивается в результате миграции патологических клеток из другой локализации, например из полости рта. В 1963 г. S. De La Pava и соавт. на основании изучения 100 образцов нормальной слизистой оболочки пищевода обнаружили, что в базальном слое в четырех случаях присутствуют меланобласты и меланоциты. Полученные результаты впервые обосновали потенциальную возможность развития ПМП [7]. В настоящее время известно, что меланоциты развиваются из эмбрионального дорзального нервного гребешка, откуда перемещаются в различные органы и ткани: эпидермис, дерму, центральную нервную систему, надпочечники, радужную оболочку глаза, внутреннее ухо, а также в глубокие слои слизистых оболочек дыхательных путей и желудочно-кишечного тракта, образуя субпопуляции меланоцитов с различным мутагенным потенциалом [8]. K. Ohashi и соавт. провели сравнительный анализ количества и распределения меланоцитов у пациентов с неизмененным пищеводом (65 человек) и при карциноме пищевода (127 человек). Меланоциты были выявлены в нижних отделах пищевода у 8% пациентов первой группы и 29,9% пациентов с карциномой пищевода, преимущественно в неизмененном эпителии вокруг новообразования [9].
Помимо единичных меланоцитов в ряде случаев выявляются скопления пигментных клеток – меланоз пищевода. МП – пролиферация неатипичных меланоцитов в базальном слое слизистой оболочки пищевода. При эндоскопическом скрининге в Японии и Индии МП был выявлен у 0,1 и 2,1% обследованных соответственно [10, 11]. По данным аутопсий, МП был выявлен у 4% в США и 7,7% в Японии [7].
МП, по некоторым данным, наблюдается у 7,7% здоровых людей [9], преимущественно у мужчин, и, как правило, в средней и нижней трети пищевода [12]. Гендерные характеристики и предпочтительная локализация МП соответствуют ПМП. Помимо указанных общих характеристик 25–30% ПМП сопровождаются МП [13, 14]. Эти данные указывают на то, что МП потенциально может рассматриваться в качестве предшественника ПМП. Однако до настоящего времени описано только два наблюдения, в которых удалось проследить развитие МП до ПМП [15]. В обоих случаях наблюдалось нарастание меланоза за период наблюдения. Предполагается, что прогрессивно нарастающий меланоз может считаться признаком злокачественного новообразования. По данным
T. Oshiro и соавт., развитие МП ассоциируется с хроническим эзофагитом, гиперпластическими изменениями и акантозом [16]. Так, установлено, что под действием кислого рефлюкса при гастроэзофагеальной рефлюксной болезни хроническое воспаление слизистой пищевода и гиперпластические изменения приводили к распространению меланоза, а соответственно и риску прогрессирования до ПМП [17].
Клиническая картина и диагностика ПМП
Клинические проявления ПМП на ранней стадии полностью отсутствуют, опухоль пищевода выявляется при эндоскопическом обследовании пациентов, предъявляющих жалобы на прогрессирующую дисфагию, одинофагию и гематемезис. Во всех описанных в литературе случаях диагноз ПМП был установлен на стадии, когда имелись множественные метастазы. Эндоскопическое исследование пищевода – основной метод, позволяющий выявить ПМП. При эзофагоскопии, в зависимости от размеров образования, можно обнаружить приподнятую, пигментированную опухоль, иногда с участками изъязвления. Пигментация новообразования является характерной чертой ПМП, которая может быть от фиолетового до коричневого цветов, встречаются также и беспигментные формы [1]. При выполнении эндоскопической ультрасонографии (ЭУС) преимущественно обнаруживается изогипоэхогенное образование [18].
Верификация диагноза ПМП возможна только при морфологическом исследовании, однако биопсия, полученная во время эндоскопии, не всегда информативна, так как более 50% первичных поражений ПМП локализуются в подслизистом слое [19]. В типичных случаях при исследовании биопсийного материала обнаруживаются гранулы меланина в опухолевых клетках, а также меланоциты в вышележащем эпителиальном слое. Окончательный морфологический диагноз основывается на результатах иммуногистохимического исследования. При ПМП обычно выявляется положительная антителоспецифическая цитоплазматическая реактивность к белкам HMB-45, S-100 и отрицательная реакция на цитокератин или карциноэмбриональный антиген [20]. Если в пищеводе обнаружена меланома, важно исключить вторичный характер поражения. Следовательно, диагноз ПМП может быть подтвержден только у пациентов без меланомы другой локализации по данным анамнеза и результатам обследования.
Лечение ПМП, возможности профилактики
Общепринятые подходы к лечению ПМП в настоящее время недостаточно разработаны. В большинстве случаев выполняется субтотальная резекция пищевода с пластикой желудочным стеблем (операция типа Льюиса), при этом пятилетняя выживаемость не превышает 40%, а общая выживаемость – 50–60%, адъювантная химиотерапия для больных ПМП не разработана [21–23].
Для лечения ПМП предпринимались попытки использования различных схем химиотерапии, включавших дакарбазин, цисплатин, темозоломид, однако полученные результаты недостаточно убедительны и в целом химиотерапия признана неэффективной [24].
В исследовании X. Wang и соавт. получен положительный эффект от применения иммунотерапии ингибиторами PD-1-рецепторов в виде увеличения выживаемости на 12,1 месяца в сравнении с группой пациентов, получавших химиотерапию [25]. Многообещающие результаты получены при применении таргетной терапии при наличии мутаций в локусах генов с-Kit, NRAS, BRAF [26]. В случае KIT-мутации при меланоме прямой кишки отмечен полный ответ на лечение иматинибом [27]. В целом у пациентов с метастатической меланомой с мутацией в гене с-Kit частота ответа на лечение иматинибом достигает 30% со средней выживаемостью без прогрессирования три-четыре месяца [28].
По данным D.R. Minor и соавт., из четырех пациентов на фоне лечения сунитинибом у одного была достигнута полная ремиссия в течение 15 месяцев, а у двух были частичные ответы (продолжительность 1 и 7 месяцев) [29].
Поскольку эффективное лечение ПМП в настоящее время не разработано, необходимо более тщательное наблюдение пациентов с МП, особенно в сочетании с эзофагитом или признаками разрастания участков пигментации.
Клиническое наблюдение
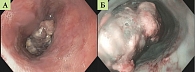
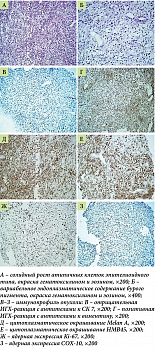
Пациент 85 лет обратился за медицинской помощью в связи с жалобами на прогрессирующее затруднение при глотании твердой пищи, эпизоды гематемезиса в течение последних двух месяцев, немотивированную потерю массы тела на 18 кг за шесть месяцев, дискомфорт и тупые боли в правой половине грудной клетки. При эндоскопическом исследовании на уровне 30–32 см от резцов выявлено критическое сужение просвета пищевода за счет неопластического роста. Новообразование располагалось на задней и левой стенках органа, визуализировалось на участке протяженностью 5–6 см, имело темно-коричневый цвет, тусклую, бугристую поверхность с умеренной контактной кровоточивостью (рис. 1). Обзорная микроскопия биопсийного материала выявила морфологические признаки злокачественной опухоли в виде солидного роста атипичных клеток с выраженным ядерным полиморфизмом и оптически пустой цитоплазмой. В отдельных полях зрения на большом увеличении отмечались очаговые скопления бурого пигмента в виде свободных гранул и внутриклеточных включений (рис. 2). Иммунофенотипирование опухоли проводили по результатам оценки экспрессии комплекса моноклональных антител (МКАТ). Наряду с негативной реакцией к цитокератину 7 (СК7) опухолевые клетки экспрессировали виментин и протеин S-100. В качестве панели специфических меланоцитарных маркеров были использованы МКАТ к Melan А, Melan K, HMB-45, SOX-10. В качестве прогностического маркера меланомы исследовали реакцию с Ki-67. Позитивная реакция выявлена в 60% клеток. По результатам прижизненного патологоанатомического исследования биопсийного материала с применением иммуногистохимического метода была верифицирована пигментная меланома.
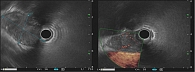
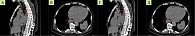
Обследование проведено в Тверском областном клиническом онкологическом диспансере. Исследование кожных покровов, слизистой полости рта, глаз не выявило подозрений на меланому. Стадирование заболевания выполнено по данным ультразвукового исследования периферических лимфатических узлов, ЭУС, мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки и брюшной полости. По данным ЭУС, установлено наличие инвазивного роста за пределы адвентиции пищевода с переходом на клетчатку средостения, медиастинальную плевру, доступный для измерения поперечный размер опухоли составил более 4 см (рис. 3). При выполнении МСКТ определено наличие местно-распространенной опухоли пищевода протяженностью 20 см, поперечными размерами 4,8 × 3,6 см с инвазией перикарда и медиастинальной плевры, наличием увеличенных до 1,5 см по короткой оси медиастинальных и эпигастральных лимфатических узлов, правосторонний гидроторакс с незначительным количеством жидкости (рис. 4). При ультразвуковом исследовании патологических изменений в надключичных, подмышечных, паховых лимфоузлах выявлено не было. На основании полученных данных пациенту установлен клинический диагноз: «злокачественное новообразование средней и нижней трети пищевода С15.4 – пигментная меланома 8720/39 сТ4аN1M0, стадия IVА» согласно классификации TNM злокачественных опухолей пищевода.
Мультидисциплинарным консилиумом определена тактика лечения: новообразование оценено как нерезектабельное, но в связи с эпизодами кровотечения из опухоли и нарастанием дисфагии установлены показания для симптоматического лечения – стентирование стенозированного участка пищевода покрытым саморасширяющимся стентом с последующим проведением анти-PD-1-иммунотерапии в течение 12 месяцев.
Заключение
Первичная меланома пищевода – чрезвычайно редкое злокачественное заболевание пищевода, диагностируемое, как правило, на поздней стадии и характеризующееся неблагоприятным прогнозом. В описанном нами клиническом наблюдении четко прослеживаются характерные для данного онкологического заболевания черты. Пациент – мужчина 85 лет обратился за медицинской помощью только при выраженных клинических проявлениях – дисфагии, одинофагии, гематемезисе. Проведенное обследование выявило местно-деструирующий рост опухоли с прорастанием в плевру и средостение на стадии метастатического поражения. Морфологическая верификация диагноза основывалась на иммуногистохимическом исследовании биоптата. На основе данных литературы и представленного клинического наблюдения, а также с учетом стадии заболевания принято решение о невозможности радикального лечения. Очевидно, при обтурации опухолью просвета пищевода улучшить качество жизни пациентов позволяет установка пищеводного стента посредством малотравматичных эндоскопических паллиативных вмешательств. Редкая встречаемость и агрессивность ПМП определяют необходимость детального клинико-морфологического изучения каждого случая, обобщения и тщательного анализа данных для определения факторов риска и фоновых заболеваний, разработки эффективных методов ранней диагностики и радикального лечения.
A.A. Sutyagin, S.V. Shchelochenkov, PhD, O.N. Guskova, PhD, T.D. Shchelochenkova, PhD, D.S. Bordin, PhD, Prof.
Tver Regional Clinical Oncological Dispensary
Tver State Medical University
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Sergey V. Shchelochenkov, workmedbox@gmail.com
Primary esophageal melanoma is an extremely rare malignancy with an estimated prevalence of 0.0036 cases per million per year. The prognosis of the disease is unfavorable, in 30-40% of patients metastases are detected at the time of diagnosis, generally accepted approaches to treatment are currently insufficiently developed. The article presents the review of the literature and describes the clinical case of a patient with primary esophageal melanoma.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.