Постинсультная плечевая артропатия
- Аннотация
- Статья
- Ссылки
- English
В работе приведены актуальные данные по формированию патогенных факторов, составляющих синдром постинсультной плечевой артропатии, описаны варианты клинического течения, методы диагностики, основные подходы к лечению и реабилитации больных.
Выделена роль современного хондропротектора Амбене Био в комплексном подходе к безопасному и эффективному лечению постинсультной плечевой артропатии. Рекомендовано его использование с целью пролонгированного уменьшения болевого синдрома, снижения интенсивности деструкции суставных тканей и восстановления поврежденных структур, а также с целью уменьшения риска полипрагмазии у коморбидных пациентов, в том числе с эндокринной патологией.
В работе приведены актуальные данные по формированию патогенных факторов, составляющих синдром постинсультной плечевой артропатии, описаны варианты клинического течения, методы диагностики, основные подходы к лечению и реабилитации больных.
Выделена роль современного хондропротектора Амбене Био в комплексном подходе к безопасному и эффективному лечению постинсультной плечевой артропатии. Рекомендовано его использование с целью пролонгированного уменьшения болевого синдрома, снижения интенсивности деструкции суставных тканей и восстановления поврежденных структур, а также с целью уменьшения риска полипрагмазии у коморбидных пациентов, в том числе с эндокринной патологией.
Введение
Постинсультная плечевая артропатия (ППА) – патогенетически сложный, многокомпонентный синдром, формирующийся после перенесенного инсульта и характеризующийся нарушением функции плечевого сустава паретичной руки с развитием боли. По разным данным, ППА диагностируется у 20–50% пациентов с последствиями нарушения мозгового кровообращения и чаще встречается при выраженном парезе или плегии в руке [1–3]. Помимо степени тяжести пареза к факторам риска ППА относятся возраст, женский пол, повышенный мышечный тонус, чувствительные нарушения, неглект, а также левосторонний гемипарез [4]. Хроническая болевая ППА приводит к снижению эффективности нейрореабилитации, ограничивает бытовую и профессиональную активность, нарушает сон и эмоциональный статус больных [5–9].
Пациенты с последствиями инсульта, как правило, вынуждены принимать комбинацию препаратов для контроля артериальной гипертензии, антиагреганты и/или антикоагулянты, статины, нередко препараты для контроля гликемии, поддержания тиреоидного статуса, антидепрессанты, противоэпилептические и др. В одном из исследований, посвященных полипрагмазии, было показано, что у 94% лиц с последствиями инсульта имеет место как минимум одно дополнительное заболевание. Кроме того, они были вынуждены в десять раз чаще, чем пациенты контрольной группы, принимать на регулярной основе 11 препаратов и более [7].
Таким образом, помимо ограничения функции руки и хронического болевого синдрома ППА становится причиной приема обезболивающих препаратов в высоких дозах и выступает дополнительным фактором полипрагмазии с соответствующими рисками.
Патогенез
Причины ППА полностью не изучены, однако в настоящее время выделен ряд негативных, как правило, взаимообусловленных факторов, ассоциированных с ее развитием.
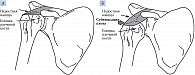
Механическое повреждение. В раннем восстановительном периоде инсульта ослабевшие на фоне пареза мышцы и растягивающийся сухожильно-связочный комплекс перестают выполнять стабилизирующую сустав функцию. Под воздействием силы тяжести руки головка плечевой кости постепенно выскальзывает из суставной сумки с формированием хронического подвывиха (сублюксации) (рисунок) [10, 11].
Кроме того, на фоне грубого нарушения чувствительности в руке, при синдроме игнорирования или когнитивных нарушениях пациент может непреднамеренно причинять себе травмы, в частности, при попытках самостоятельного перемещения, во сне, при бытовой и профессиональной активности, реабилитационных процедурах. Дополнительным фактором риска травм является регулярное перемещение пациента низкоквалифицированным персоналом и не обученными уходу родственниками [9, 12].
Хроническая травматизация на фоне сублюксации и внешних воздействий в раннем восстановительном периоде инсульта часто приводит к разрывам волокон, воспалительным, дистрофическим и рубцовым изменениям в мышцах и сухожилиях, составляющих ротаторную манжету плеча (надостная, подостная, подлопаточная, малая круглая мышцы). В патологический процесс вовлекаются также сухожилия головок бицепса и околосуставные сумки (подакромиальная, поддельтовидная, подклювовидная и др.) с развитием тендинита и бурсита. Помимо прочего повреждению подвержены как плечевое невральное сплетение, так и дистальные по отношению к плечевому суставу нервы с развитием плексо- и мононевропатий [4].
На более поздних этапах острые воспалительные явления в суставной капсуле и периартикулярных тканях преимущественно трансформируются в рубцовый процесс, может развиться адгезивный капсулит с исходом в контрактуру и грубое ограничение объема движений в суставе. Формируется так называемый синдром замороженного плеча [13].
Комплексный регионарный болевой синдром. В течение первого года после инсульта примерно у трети пациентов может развиваться клиническая картина комплексного регионарного болевого синдрома (КРБС), протекающего по типу рефлекторной симпатической дистрофии. Согласно данным метаанализа 2021 г., в 74% случаев КРБС ассоциирован с сублюксацией плеча, однако в части случаев он может быть выявлен и в отсутствие очевидных признаков сублюксации и травматизации [14, 15].
Помимо плечевого сустава в патологический процесс могут быть вовлечены и другие суставы паретичной конечности – лучезапястный сустав, суставы кисти (синдром «плечо – кисть») [16, 17].
Механизм формирования КРБС после инсульта полностью не установлен. Определенную роль в этом могут играть дисфункция поврежденных центральных структур нервной системы (сенсомоторные области коры, островковая доля, таламус), невральных сплетений и периферических нервов, а также локальные изменения в мышцах на фоне гиперактивности симпатической вегетативной нервной системы [9, 15, 18].
Остеоартрит (остеоартроз). Патогенный процесс при ППА не ограничивается мягкими периартикулярными тканями и капсулой плечевого сустава. Синовиальная оболочка, гиалиновый суставной хрящ и субхондральная костная ткань также претерпевают изменения, причем характерные для остеоартрита [3].
Согласно данным многих исследований, остеоартрит является активным патогенным процессом вопреки ранее бытовавшему мнению о пассивном дегенеративном состоянии изношенных суставных тканей [19]. На фоне комплекса механических, воспалительных и метаболических факторов развивается прогрессирующий деструктивный процесс с образованием эрозий и более глубоких повреждений хрящевых поверхностей. Гиалиновый хрящ постепенно утрачивает способность компенсировать физические воздействия и передает их на подлежащую кость [20]. На этом фоне повышается синтетическая активность хондроцитов, синовиоцитов и остеобластов, что в свою очередь потенцирует продукцию провоспалительных медиаторов и запускает каскад воспалительно-дистрофических изменений в синовиальной оболочке, самом хряще и субхондральной кости [21]. Длительное существование таких патологических кругов приводит к гипертрофии и васкуляризации тканей с ремоделированием кости и образованием остеофитов, что в итоге изменяет нормальную кинематику суставов [21].
Спастичность. Развитие постинсультной спастичности ассоциировано с болевой артропатией плечевого сустава [9].
В одном из исследований с участием 786 пациентов была убедительно доказана корреляция выраженного спастического тонуса с развитием болевого синдрома в области плеча. У 37% больных с жалобами на боль в плече отмечено нарушение двигательных функций в руке в связи с повышением мышечного тонуса. При этом в группе лиц с незначительным повышением тонуса (без его влияния на двигательные функции) боль в плече наблюдалась только у 9% [22]. В этом же ретроспективном исследовании авторы указали на существенное снижение как проявлений спастичности, так и болевой ППА при наблюдении пациентов в стационаре на протяжении пятнадцатилетнего периода: вероятно, за счет систематического активного комплексного реабилитационного вмешательства. В задачи данного исследования оценка причинно-следственных связей не входила.
Болевой синдром. Постинсультный болевой синдром в области плеча может формироваться с помощью двух механизмов – ноцицептивного и нейропатического. Ноцицептивная боль возникает вследствие раздражения болевых рецепторов в тканях сустава на фоне механического воздействия при травме и сублюксации, воспалении, спастичности и частично при комплексном регионарном болевом синдроме.
Нейропатическая боль обусловлена патологическим формированием болевых доминант в головном мозге при повреждении центральных анализаторов (стволовых структур, таламуса, сенсорных областей коры головного мозга), а также при вовлечении в патогенез периферических нервов. Пациенты часто демонстрируют сочетание нескольких типов боли в соответствии с индивидуальным паттерном патологических проявлений, например спастичность в сочетании с сублюксацией плеча и комплексным регионарным болевым синдромом [9, 18].
Клиническая картина
Постинсультная плечевая артропатия, как правило, развивается в период от трех недель до двух месяцев после инсульта, реже – в более ранние сроки [3].
Основной жалобой пациентов с ППА является боль в области плечевого сустава, которая может быть как постоянной, в том числе в состоянии покоя, так и периодической, возникающей на фоне пассивного или активного движения в руке. Боль нередко распространяется в надлопаточную, подключичную и локтевую области. В зависимости от давности ППА, совокупности и преобладания тех или иных патогенетических процессов боль может иметь как острый (прокалывающий, жгучий, скручивающий), так и тянущий, ноющий характер.
По-видимому, многофакторностью патогенеза объясняется и отсутствие преобладания какого-либо ритма боли. В разное время могут быть признаки как механического (стартовая боль, возникающая при нагрузке на сустав), так и воспалительного (боль в покое, уменьшающаяся при разминке, скованность) типа боли. Интенсивность боли варьируется от выраженной на фоне центрального постинсультного болевого синдрома до умеренной (при синдроме спастичности, воспалительных явлениях в суставе и периартикулярных тканях) и едва заметной после завершения рубцового процесса, формирования контрактур и фиксации сустава.
Помимо боли пациенты предъявляют жалобы на изменение объема движений в руке. Как правило, при осмотре отмечается выраженное нарушение отведения и наружной ротации плеча, несколько в меньшей степени – сгибания, разгибания и внутренней ротации. Синдром замороженного плеча может достигать тяжелой степени с фиксацией конечности и отсутствием каких-либо движений.
Для сублюксации плечевого сустава паретичной руки характерно изменение его конфигурации. При осмотре и пальпации отмечается образование щели между акромиальным краем суставной впадины и головкой плечевой кости, которая может достигать 4–5 см. Такая выраженная сублюксация приводит к увеличению амплитуды пассивных движений в суставе и потенцирует риск травматизации. Пассивный подъем паретичной руки вдоль оси плечевой кости, как правило, позволяет легко вправить головку в суставную впадину, однако в отсутствие стабилизирующего влияния периартикулярных тканей плечо снова из нее выскальзывает под собственным весом. С течением времени на фоне пролиферативных и рубцовых изменений в суставе такое вправление становится практически невозможным.
В случае развития КРБС клиническая картина включает ряд вегетативных нарушений: преимущественно дистальный отек мягких тканей конечности, вазомоторные расстройства, трофические изменения кожи и ее придатков (ломкость ногтей, выпадение волос), гипо- или гипергидроз. Боль при КРБС чаще носит нейропатический характер. Пациенты трудно или вовсе не локализуют болевой фокус, описывают боль как жгучую, пронзающую и зудящую. Кроме того, для нее типично спонтанное развитие, усиление в ночное время и на фоне эмоциональной нагрузки. При осмотре выявляют аллодинию, гиперпатию, гиперестезию, а также участки постинсультной гемигипестезии и гипалгезии [14]. Важным признаком развития КРБС считается появление симптомов артропатии лучезапястного сустава и суставов кисти [18].
Повышение мышечного тонуса по спастическому типу выражается в непроизвольном увеличении сопротивления мышц быстрому пассивному движению (catch). При ППА этот феномен можно выявить мануальным тестированием мышц, обеспечивающих функцию плечевого сустава. Наиболее часто при постинсультном синдроме спастичности в патологический паттерн вовлечены малая и большая грудные мышцы, подостная, подлопаточная, малая и большая круглые мышцы, а также пучки дельтовидной мышцы [23].
Инструментальная диагностика
Инструментальную диагностику ППА проводят для уточнения характера и выраженности изменений, а также степени вовлеченности периартикулярных, хрящевых и костных тканей в патологический процесс.
Золотым стандартом диагностики ППА считается рентгенография, которая в большинстве случаев позволяет получить необходимые для уточнения диагноза данные. Более информативным, но вместе с тем и более сложным и дорогостоящим методом является компьютерная томография (КТ), которую в основном проводят для дифференциальной диагностики и оценки динамики состояния тканей плеча на фоне лечения.
При сублюксации и подозрении на травму рентгенография или КТ плечевого сустава в различных проекциях позволяет выявить дислокацию головки плечевой кости, а также костные травматические дефекты.
Рентгенологические признаки остеоартрита включают сужение суставной щели, дефекты хрящевых поверхностей, наличие остеофитов, субхондральный остеосклероз. Кроме того, возможна рентгенологическая оценка степени гипертрофии и оссификации синовиальной оболочки и суставной капсулы.
Выявление при проведении рентгенографии и КТ наряду с признаками сублюксации и остеоартрита очагового и диффузного остеопороза плечевой кости и лопатки свидетельствует в пользу КРБС, при синдроме «плечо – кисть» подобные изменения наблюдаются в области костей предплечья и кисти [9, 15].
Ультразвуковое исследование (УЗИ) используют в качестве быстрого и недорогого метода определения признаков воспалительного процесса: наличия жидкости в полости сустава и мягких тканях, утолщения и неоднородности сухожильных и мышечных образований. Кроме того, УЗИ является методом оценки величины суставной щели, степени трансформации мышечной ткани при синдроме спастичности, а также навигации при проведении ботулинотерапии [3, 24].
Магнитно-резонансная томография применяется для точной оценки анатомической целостности мягкотканных структур плеча, при КРБС с ее помощью можно обнаружить истончение кожного покрова, отек мягких тканей, асимметричную гипотрофию мышц паретичной половины тела [3, 9, 25].
Профилактика
В целях профилактики ППА с первых дней после инсульта необходимо уделять внимание защите и поддержке паретичной руки не только во время активных действий (перемещения пациента с кровати на кресло, передвижения на инвалидном кресле, реабилитационных мероприятий), но и в покое, в том числе во сне. Одной из целей такой защиты является воспрепятствование растяжению мягких тканей плеча под действием силы тяжести руки. Для этого используют специальные аксессуары и устройства: лотки для укладывания руки на подлокотник кресла (arm trough), подушки и клины для позиционирования в кровати (positioning pillows), поддерживающие слинги, сплинты и ортезы для применения во время высаживания или ходьбы [26].
При физической активности и пассивных движениях следует избегать амплитуды сгибания и отведения плеча более чем на 90º [9].
Одним из важных аспектов профилактики ППА у пациентов с последствиями инсульта является обучение персонала и родственников приемам безопасного перемещения пациента с обеспечением защиты паретичных конечностей, в том числе с использованием специальных устройств [27, 28].
Помимо предотвращения сублюксации и травматизации плечевого сустава вышеописанные меры способствуют профилактике спастичности и снижают ее выраженность в случае уже наросшего мышечного тонуса, а также снижению риска развития КРБС [29].
Медикаментозная терапия
Нестероидные противовоспалительные препараты и анальгетики. Для терапии ноцицептивной боли, уменьшения воспаления и отека при явлениях остеоартрита, КРБС, сублюксации и травмах плеча рекомендовано использовать селективные и неселективные нестероидные противовоспалительные препараты (НПВП) и анальгетики в индивидуально подобранных эффективных дозах [30, 31].
Глюкокортикостероиды. Показания для использования глюкокортикостероидов (ГКС) сходны с таковыми при назначении НПВП, однако в отношении боли при КРБС доказан более выраженный эффект преднизолона в дозе 40 мг/сут на протяжении одного месяца применения по сравнению с таковым пироксикама [32].
Было также отмечено, что при КРБС пациентам, получавшим метилпреднизолон, реже требовались дополнительные обезболивающие препараты, чем лицам в группе сравнения [18].
Внутрисуставное введение ГКС с целью снижения интенсивности боли рекомендовано только в случае недостаточной эффективности других средств. По крайней мере для остеоартрита не выявлено преимуществ такого приема по сравнению с приемом per os [33, 34].
Если выраженный болевой синдром при остеоартрите обусловлен подтвержденным воспалением, внутрисуставное введение ГКС может быть более эффективным, чем при ином происхождении боли [35].
С учетом высокого риска развития тяжелых побочных эффектов, ассоциированных с приемом НПВП и ГКС (кровотечение, гастропатия, декомпенсация сахарного диабета и т.д.), продолжительность такой терапии по возможности должна быть минимальной [19].
Антиконвульсанты и антидепрессанты. Нейропатический болевой синдром, нередко сопутствующий повреждению центральных невральных структур, а также наблюдающийся при КРБС, практически не поддается терапии анальгетиками и НПВП.
С целью уменьшения боли и выраженности ее эмоциональной окраски, а также с целью улучшения ночного сна и коррекции эмоциональных нарушений применяют препараты из групп антиконвульсантов (габапентин, прегабалин) и селективных ингибиторов обратного захвата серотонина и норадреналина (венлафаксин, дулоксетин), а также трициклические антидепрессанты (амитриптилин, нортриптилин) [15, 18].
Следует отметить, что, несмотря на высокую противоболевую эффективность, использование амитриптилина невозможно или крайне ограничено у пожилых пациентов, при отягощенном кардиологическом анамнезе и метаболических нарушениях. Антиконвульсанты могут существенно влиять на когнитивный статус пациентов и способность к обучению во время нейрореабилитационных мероприятий. Препараты этих групп также способны вызывать ортостатические реакции, особенно при совместном приеме с гипотензивными средствами, что увеличивает риск гипоперфузии головного мозга и может быть причиной падений.
Препараты ботулинического токсина типа А. В нескольких обзорах разного качества показана эффективность использования инъекций ботулинического токсина типа А (БТА) в мышцы верхнего плечевого пояса при ППА, сопровождающейся синдромом спастичности.
Согласно данным пяти рандомизированных клинических исследований с участием 87 пациентов, в период от трех до шести месяцев после введения БТА наблюдались клинически и статистически значимое уменьшение болевого синдрома и увеличение объема движения при наружной ротации плеча в основной группе по сравнению с группой плацебо. При этом боль уменьшалась независимо от степени снижения мышечного тонуса, что, по-видимому, было обусловлено антиноцицептивным действием БТА помимо антиспастического [9, 36].
Симптоматические лекарственные средства медленного действия. Для уменьшения болевого синдрома, снижения интенсивности воспаления и потенцирования репаративных процессов в интерстициальной и хрящевой тканях суставов на фоне остеоартрита используют ряд препаратов, содержащих хондроитина сульфат (ХС).
В исследованиях доказано воздействие ХС на основные патогенетические звенья остеоартрита. После накопления в синовиальной жидкости ХС прерывает каскад воспалительных реакций, развивающихся с участием хондроцитов, синовиоцитов и остеобластов.
Кроме того, введение хондропротекторов потенцирует синтез собственных ХС и гиалуроновой кислоты суставными тканями, что замедляет деструкцию хряща, способствует его восстановлению и улучшению функции суставов [37]. Эффект развивается в течение 8–12 недель и может сохраняться на протяжении нескольких месяцев [38].
К данной группе препаратов относится отечественный хондропротектор для парентерального введения Амбене Био, содержащий оптимальный комплекс хондроитина сульфата, низкомолекулярных пептидов (цитомединов), аминокислот и микроэлементов. Препарат Амбене Био отличается от других симптоматических препаратов медленного действия при остеоартритах (SYSADOA) ультрасовременной технологией производства, позволяющей получать высокое стандартизированное содержание действующих веществ в одном миллилитре раствора (100 мг/мл) с низким молекулярным весом биорегуляторных пептидов.
В серии отечественных контролируемых исследований высокого качества на солидных выборках пациентов убедительно продемонстрировано положительное воздействие препарата на уменьшение боли, скованности и ряд визуализационных показателей при остеоартрите [38–42].
Кроме того, в сравнительном исследовании с участием 52 пациентов с постинсультным гемипарезом и болевой артропатией плеча было установлено существенное уменьшение болевого синдрома и увеличение амплитуды движений в плечевом суставе [2]. Эффект оказался более выраженным в основной группе. Авторы исследования отметили достижение целей реабилитации, связанных с самообслуживанием пациентов.
Среди преимуществ препарата Амбене Био можно выделить благоприятный профиль безопасности.
Кроме того, использование Амбене Био существенно снижает потребность в регулярном приеме НПВП и ГКС, а также позволяет избегать эпизодического приема анальгетиков.
У Амбене Био также отсутствуют зарегистрированные лекарственные взаимодействия.
Препарат не влияет на гемостаз и может быть использован у пациентов со сложными коморбидными состояниями, что исключительно важно в практике неврологов, эндокринологов и геронтологов.
Следует подчеркнуть, что скорость наступления эффекта терапии препаратом Амбене Био и длительность его сохранения в полной мере позволяет реализовать потенциал нейропластичности у постинсультных пациентов в реабилитационном периоде.
Реабилитация
С учетом сложности патогенеза терапия ППА предполагает комплексный подход: использование лекарственных средств, физическую терапию, применение физиотерапевтических методов. В руководствах по реабилитации ППА одной из основных является рекомендация по снижению избыточного веса и регулярному выполнению физических упражнений [19, 33].
Так, в контролируемом исследовании с участием 52 пациентов с диагностированным КРБС была продемонстрирована положительная роль аэробных упражнений для руки [43, 44]. В течение четырехнедельного курса физической терапии 90% пациентов основной группы отметили значительное уменьшение боли и других симптомов КРБС [43, 44].
Целью физической терапии ППА являются уменьшение боли, достижение мобильности сустава и восстановление его функции. Для этого в каждом конкретном случае необходима разработка индивидуального комплекса упражнений, направленных на укрепление мышц, поддержание и улучшение эластичности мягких тканей, уменьшение их отечности. Для этого могут быть использованы зеркальная терапия, силовые тренировки, элементы Бобат-терапии, нейромышечного переобучения (проприоцептивная нейромышечная фасилитация) и других методик.
По эффективности среди методов физиотерапии особо выделяют импульсное радиочастотное воздействие (Pulsed Radiofrequency – PRF) на область лопаточной вырезки. Так, в контролируемом исследовании показан значительный обезболивающий эффект в группе импульсного радиочастотного воздействия по сравнению с группами контроля [45].
Продемонстрирована также эффективность чрескожной электронейромиостимуляции и функциональной электростимуляции в отношении величины смещения головки плечевой кости при сублюксации, однако при этом не выявлено достоверного улучшения двигательной функции и снижения болевого синдрома [9, 46, 47].
С целью кратковременного уменьшения боли могут быть использованы такие методы, как укол триггерных точек «сухой» иглой и блокада надлопаточного нерва [48].
Стоит также отметить, что в метаанализе 2021 г. была оценена эффективность использования при постинсультной болевой артропатии плеча таких методов, как стреппинг, в том числе тейпирование, акупунктура, пчелиный яд, ароматерапия [49]. Однако убедительных данных об эффективности таких подходов в отношении болевого синдрома не получено, в основном вследствие гетерогенности обследованных групп, малых выборок, низкого качества проанализированных исследований [49].
Заключение
Постинсультная артропатия плеча является сложной междисциплинарной проблемой неврологии, нейрореабилитации и других дисциплин. Своевременная профилактика, качественное комплексное лечение и восстановительные мероприятия могут способствовать минимизации последствий заболевания и боли. Использование современных методов комплексной терапии с применением инновационного хондропротектора Амбене Био позволяет повысить эффективность лечения, повседневную активность и качество жизни пациентов. Немаловажным фактором является потенциал Амбене Био в отношении снижения риска полипрагмазии за счет депрескрайбинга НПВП, ГКС и анальгетиков.
R.Kh. Lyukmanov, PhD, A.A. Rimkevichus, E.V. Gnedovskaya, N.A. Suponeva, Corresponding member of the RASci., MD, PhD, Prof.
Research Center of Neurology
Contact person: Roman Kh. Lyukmanov, xarisovich@gmail.com
The purpose of this study was to analyze and evaluate modern ideas about the pathogenesis, diagnosis and effective treatment of post-stroke brachial arthropathy.
The paper presents current data on the formation of pathogenic factors that make up the syndrome of post-stroke brachial arthropathy, describes the clinical course options, diagnostic methods, basic approaches to the treatment and rehabilitation of the disease.
Highlighted the role of modern chondroprotectors Ambene Bio in the comprehensive approach to safe and effective treatment of post-stroke brachial arthropathy. Its use is recommended for the purpose of prolonged reduction of pain syndrome, reduction of the articular tissues destruction intensity and restoration of damaged structures, as well as to reduce the risk of polypragmasia in comorbid patients, including those with endocrine pathology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.