Повышение качества оказания медицинской помощи пациентам с аутовоспалительными заболеваниями: медицинские и организационные аспекты
- Аннотация
- Статья
- Ссылки
- English
В большинстве случаев АВЗ имеют конкретную генетическую основу с мутациями в отдельных генах – моногенные АВЗ. Среди них наиболее частой нозологией является семейная средиземноморская лихорадка (периодическая болезнь). В то же время АВЗ могут иметь полигенное происхождение. Наиболее типичными представителями полигенных АВЗ являются системный ювенильный артрит и близкая к нему по симптоматике болезнь Стилла взрослых.
При АВЗ воспаление возникает из-за нарушений во врожденной иммунной системе с формированием инфламмасом, что приводит к синтезу провоспалительных цитокинов, в частности интерлейкина 1β (ИЛ-1β).
В статье приведены основные клинические данные по наиболее распространенным АВЗ, дифференциально-диагностический алгоритм, методы лечения, особое место среди которых занимает ингибитор ИЛ-1β канакинумаб. Представлены также основные положения резолюции межрегионального круглого стола «Школа ревматолога. Маршрутизация пациентов с аутовоспалительными заболеваниями» 20 июня 2023 г.
В большинстве случаев АВЗ имеют конкретную генетическую основу с мутациями в отдельных генах – моногенные АВЗ. Среди них наиболее частой нозологией является семейная средиземноморская лихорадка (периодическая болезнь). В то же время АВЗ могут иметь полигенное происхождение. Наиболее типичными представителями полигенных АВЗ являются системный ювенильный артрит и близкая к нему по симптоматике болезнь Стилла взрослых.
При АВЗ воспаление возникает из-за нарушений во врожденной иммунной системе с формированием инфламмасом, что приводит к синтезу провоспалительных цитокинов, в частности интерлейкина 1β (ИЛ-1β).
В статье приведены основные клинические данные по наиболее распространенным АВЗ, дифференциально-диагностический алгоритм, методы лечения, особое место среди которых занимает ингибитор ИЛ-1β канакинумаб. Представлены также основные положения резолюции межрегионального круглого стола «Школа ревматолога. Маршрутизация пациентов с аутовоспалительными заболеваниями» 20 июня 2023 г.


Аутовоспалительные заболевания
Аутовоспалительные заболевания (АВЗ) – гетерогенная группа редких генетически детерминированных состояний, характеризующихся непровоцируемыми приступами воспаления, проявляющимися лихорадкой, а также симптомами, напоминающими симптомы при ревматической патологии, в отсутствие аутоиммунных или инфекционных процессов [1, 2]. Их можно рассматривать как аналог аутоиммунных заболеваний, поскольку оба класса болезней вызваны аномальными иммунными реакциями. Основное различие заключается в том, что аутоиммунные заболевания обычно определяются нарушением работы адаптивной иммунной системы, в то время как АВЗ – поражением врожденной иммунной системы (табл. 1) [3].
В большинстве случаев АВЗ имеют генетическую основу с мутациями в отдельных генах (моногенные АВЗ).
MEFV – первый ген, который был идентифицирован в 1997 г. как вызывающий семейную средиземноморскую лихорадку (FMF), или периодическую болезнь, которая представляет собой наиболее распространенное наследственное АВЗ. С 1997 г. было идентифицировано более 40 новых состояний из группы АВЗ, связанных с генетическими мутациями, влияющими на различные компоненты врожденной иммунной системы [3–5]. Большинство из них проявляются в младенческом или детском возрасте и характеризуются повторяющимися эпизодами лихорадки и системного воспаления, которые возникают в отсутствие инфекции, онкологической патологии, продукции аутоантител [7]. Наиболее известные расстройства включают FMF (периодическая болезнь), синдром гипериммуноглобулинемии D/синдром дефицита мевалонаткиназы (HIDS/MVK), периодический синдром, ассоциированный с рецептором фактора некроза опухоли α (ФНО-α) (TRAPS), криопиринассоциированные периодические синдромы (CAPS), включая семейную холодовую крапивницу, синдром Макла – Уэлса (MWS), хронический младенческий нервно-кожно-суставной синдром/младенческое мультисистемное воспалительное заболевание (CINCA/NOMID). Тяжесть заболевания варьируется от легкой до опасной для жизни. Одним из наиболее опасных осложнений является АА-амилоидоз, который быстро приводит к развитию почечной недостаточности, а также поражению других внутренних органов [8–10].
Моногенные АВЗ не являются исключительно детскими болезнями. Известно, что приблизительно у 10% больных FMF клинический дебют приходится на возраст старше 20 лет, при этом чаще это отмечается у мужчин [11]. Синдром VEXAS, получивший название по первым буквам выявленных изменений (Vacuoles – вакуоли, E1-enzyme – фермент E1, X-linked – Х-связанный, Autoinflammatory – аутовоспалительный, Somatic – соматический), является относительно новой патологией. Так, первые сообщения о ней появились в 2020 г. Данная патология также была отнесена к АВЗ, вызванным соматическими мутациями в гене UBA1, и характеризуется началом во взрослом возрасте (средний возраст первых клинических проявлений – около 60 лет) [12, 13].
Аутовоспалительные заболевания могут иметь и полигенное, или многофакторное, происхождение, при этом внешние факторы модулируют фенотип болезни [3]. Наиболее типичными представителями полигенных АВЗ являются системный ювенильный артрит и близкая к нему по симптоматике болезнь Стилла взрослых, средний возраст начала которой – от 30 до 35 лет [7].
Таким образом, не только детские, но и взрослые врачи в клинической практике могут столкнуться с необходимостью первичной диагностики аутовоспалительных синдромов.
Как моногенные, так и полигенные АВЗ в первую очередь связаны с патологией врожденного иммунитета. При многих АВЗ воспаление возникает из-за нарушений врожденной системы иммунного ответа на внеклеточные и внутриклеточные сигналы опасности – молекулярные последовательности, ассоциированные с повреждением. Система распознавания таких сигналов состоит из многих белковых компонентов, формирующих особые внутриклеточные структуры – инфламмасомы, которые представляют собой высокомолекулярные белковые комплексы, локализующиеся в цитозоле и содержащие паттернраспознающие рецепторы, сигнальные молекулы, ферменты и другие компоненты [14–16]. Формирование инфламмасом приводит к синтезу провоспалительных цитокинов, в частности интерлейкина 1β (ИЛ-1β), из их неактивных проформ. Классическим примером инфламмасомопатии может служить периодическая болезнь, при которой имеют место мутации в гене MEFV. Белок пирин (маренострин), кодируемый геном MEFV, участвует в формировании инфламмасом, оказывая регуляторное действие на этот процесс. Подразумевается, что генные мутации приводят к формированию измененных молекул пирина и тем самым способствуют неконтролируемой активации синтеза провоспалительных цитокинов [3, 10, 11]. Существуют и другие механизмы индукции врожденного иммунного ответа и воспалительной реакции. Речь, в частности, идет о нарушении передачи сигналов с помощью ФНО в связи с генетически обусловленными дефектами его рецептора, регуляции активности интерферона I (ИФН-I) из-за дефектов процессинга РНК, передачи сигналов или накопления внутриклеточного белка (нарушение функции протеасом), дефектах сборки и полимеризации внутриклеточного белка актина, стрессе эндоплазматического ретикулума [3, 5].
Несмотря на существующие явные различия между аутовоспалительными и аутоиммунными заболеваниями, они также имеют много общего. Так, основные патологические процессы направлены против тканей собственного организма. Они носят системный характер, затрагивают опорно-двигательный аппарат и включают не только моногенные, но и полигенные заболевания. Врожденная иммунная система играет роль в активации адаптивной иммунной системы антигенпрезентирующими клетками (дендритными клетками, макрофагами и др.). Таким образом, врожденная иммунная система может запускать реакцию В- и Т-клеток, а явная или длительная активация врожденного иммунитета – приводить к развитию аутоиммунных заболеваний [3, 17, 18].
Еще одним важным связующим звеном между адаптивным и врожденным иммунитетами является ИЛ-1β. Это одна из основных эффекторных молекул, управляющая аутовоспалительными процессами, а также воздействующая на эффекторные клетки адаптивной иммунной системы, В- и Т-лимфоциты [3, 19]. ИЛ-1β оказывает многогранное влияние на организм, индуцируя различные реакции, приводящие к воспалению: активирует синтез хемокинов, низкомолекулярных медиаторов воспаления (оксида азота, простагландинов), экспрессию молекул адгезии на лейкоцитах и эндотелиальных клетках, стимулирует гранулопоэз, синтез других провоспалительных цитокинов, таких как ФНО и ИЛ-6. ИЛ-1β участвует в регуляции адаптивного иммунного ответа: стимулирует антигенпрезентирующую функцию макрофагов и дендритных клеток, наряду с ИЛ-23 активирует специфические субпопуляции иммунных клеток, в том числе естественные киллерные клетки и тучные клетки. ИЛ-1β оказывает катаболические эффекты на соединительную ткань. Он активирует синтез хондроцитами внеклеточных матриксных протеиназ (аггреканазы, коллагеназы и др.), что вызывает деструкцию суставного хряща, подавляет синтез протеогликанов и образование коллагена, стимулирует дифференцировку остеокластов из клеток-предшественников, что способствует резорбции костной ткани. В связи с этим ИЛ-1β представляет собой хорошую терапевтическую мишень при АВЗ [20, 21].
Аутовоспалительные заболевания демонстрируют значительное сходство клинических проявлений. Для них характерны симптомы, ассоциированные с системным воспалением (табл. 2) [9, 22].
Данные проявления могут иметь разную степень выраженности, сочетаться в разных вариантах и встречаться с разной частотой при конкретных нозологических формах.
Конечно, для каждого отдельного заболевания существуют клинические особенности. Например, для FMF характерна ассоциация с этнической принадлежностью (в Российской Федерации подавляющее большинство пациентов – армяне), среди кожных проявлений чаще встречается эритематозная сыпь, напоминающая эризипелоид, для болезни Стилла взрослых – нестойкая розеолезная сыпь, может развиваться ревматоидоподобный артрит.
Классификационные критерии
Для основных АВЗ (FMF, HIDS/MVK, CAPS, TRAPS, болезнь Стилла взрослых) разработаны классификационные критерии. Однако общие симптомы могут служить основой для формирования клинического подозрения на АВЗ [9, 15, 23].
Основные симптомы, позволяющие заподозрить АВЗ:
- эпизоды фебрильной лихорадки три раза и более в течение года;
- кожные высыпания;
- рецидивирующий артрит/артралгии/миалгии;
- рецидивирующий серозит, включая рецидивирующие эпизоды боли в животе и груди;
- повышение острофазовых маркеров (скорости оседания эритроцитов (СОЭ) ≥ 30 мм/ч, уровня С-реактивного белка (СРБ) ≥ 10 мг/л);
- семейный анамнез, этническая принадлежность;
- отсутствие аутоантител при скрининговом исследовании на антинуклеарный фактор, ревматоидный фактор, антитела к циклическому цитруллинированному пептиду.
Дифференциальная диагностика
В связи с малой специфичностью клинических проявлений существует проблема дифференциальной диагностики АВЗ с ревматическими заболеваниями, инфекциями, гематологической патологией, паранеопластическими синдромами. Это связано с рядом совпадающих симптомов, таких как лихорадка, артрит/артралгии, миалгии, полисерозит, сыпь. Поскольку вышеперечисленные болезни встречаются чаще, чем АВЗ, последние, как правило, являются диагнозом исключения.
В силу того что дифференциальный диагноз проводится со множеством различных заболеваний, нередко приходится проводить значительное количество лабораторных и инструментальных исследований. К таковым относятся анализ мочи, ультразвуковое исследование суставов, брюшной полости и почек, рентгенография суставов, компьютерная томография и магнитно-резонансная томография легких, брюшной полости, эзофагогастродуоденоскопия, колоноскопия, исследование костного мозга и др.
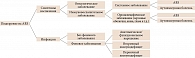
Модель дифференциально-диагностического алгоритма АВЗ представлена на рисунке [5].
Финальной стадией в случае обоснованного подозрения на моногенное АВЗ является генетический анализ, который призван выявить патогенную мутацию причинного гена [9].
Показаниями к индивидуальному генетическому тестированию служат [5]:
- случаи, соответствующие клиническим критериям известного моногенного АВЗ;
- случаи с частичными проявлениями при отягощенном семейном анамнезе в отношении моногенного АВЗ;
- подозрение на АВЗ, вызывающие необратимые повреждения (тяжелые варианты CAPS, дефицит аденозиндеаминазы 2);
- несоответствие клиническим критериям конкретных заболеваний, но есть подозрение на АВЗ, в данном случае может быть проведена расширенная панель генетических тестов с последующим полногеномным/полноэкзомным исследованием, если результаты первоначального теста не подтвердились.
Необходимо отметить, что пренатальное тестирование или тестирование новорожденных не показано, если отсутствует ярко выраженный семейный анамнез или конкретные подозрения, а ранняя диагностика может изменить исход заболевания у ребенка [5].
Бессимптомные родственники тестируются [5]:
- если это родственники первой степени родства больного с известным наследственным синдромом периодической лихорадки – для определения предсказуемости заболеваний высокого риска, таких как поражение нервной системы при CAPS или инсульт при дефиците аденозиндеаминазы;
- если это родители – для подтверждения факта наследования или развития de novo, а также в случае необходимости установления, унаследован ли цис- или трансвариант сцепления генов.
Лечение
В настоящее время для многих моногенных аутовоспалительных синдромов доступен ряд эффективных методов лечения. Для неотложной терапии лихорадочных приступов сохраняют определенное значение нестероидные противовоспалительное препараты и глюкокортикоиды, хотя применение последних ограничивается феноменом привыкания и риском возникновения нежелательных явлений. Для регулярного применения при FMF препаратом первой линии является колхицин, который также может быть полезен при других состояниях. Ингибирование ФНО-α может облегчать симптомы артрита при FMF и некоторых других моногенных АВЗ, хотя при TRAPS следует избегать назначения ингибиторов ФНО, кроме этанерцепта. Получен также положительный опыт применения ингибиторов янус-киназ, в частности барицитиниба.
При полигенных АВЗ (системный ювенильный артрит, болезнь Стилла взрослых) применяются глюкокортикоиды, метотрексат, ингибиторы рецепторов ИЛ-6 [7, 24]. Наиболее универсальным и все более широко применяемым подходом является ингибирование ИЛ-1β с помощью канакинумаба и анакинры [3, 5].
В России накоплен значительный положительный опыт назначения канакинумаба.
Канакинумаб представляет собой человеческие моноклональные антитела иммуноглобулина G1 к ИЛ-1β, которые связываются с цитокином и блокируют его взаимодействие с рецепторами.
Канакинумаб обладает длительным периодом полувыведения – 21–28 дней, что позволяет вводить его подкожно один раз в четыре – восемь недель.
Помимо результатов достаточно большого количества рандомизированных и открытых клинических исследований, в которых убедительно доказана эффективность канакинумаба при системном ювенильном артрите, FMF, CAPS, HIDS, TRAPS, а также помимо данных двойного слепого плацебо-контролируемого рандомизированного исследования CONSIDER о частичном ответе при болезни Стилла взрослых [25, 26] опубликован российский опыт применения препарата в реальной клинической практике. Так, В.В. Рамеев и соавт. описали клинический случай успешного лечения канакинумабом мужчины 38 лет (армянина по национальности) с периодической болезнью и вторичным АА-амилоидозом, резистентным к колхицину [27]. При этом наблюдалось не только отсутствие рецидивов, снижение до нормы СОЭ и уровня СРБ, но и протеинурия менее 0,5 г/л. Согласно данным С.О. Салугиной и соавт., у 38 взрослых и детей с CAPS, TRAPS и колхицин-резистентной FMF на фоне лечения канакинумабом зафиксировано быстрое купирование лихорадки, исчезновение сыпи, уменьшение выраженности лимфаденопатии и гепатоспленомегалии, купирование или значительная положительная динамика глазных симптомов, снижение уровня острофазовых маркеров [28]. У всех пациентов также удалось полностью отменить глюкокортикоиды. Переносимость лечения в целом была удовлетворительной. Отмечены единичные случаи инфекции кожи и вираж диаскин-теста. После соответствующей терапии прием препарата был продолжен.
Рекомендации экспертного совета и шаги по их реализации
Обсуждению потенциала применения канакинумаба в России было посвящено совещание экспертов, состоявшееся 3 июля 2018 г. в Москве [29]. Эксперты признали обоснованным и поддержали применение данного препарата при наследственных АВЗ и болезни Стилла взрослых.
Необходимо отметить, что выявление АВЗ в условиях реальной практики, особенно при начале заболевания во взрослом возрасте, может стать неординарной задачей. Поскольку заболевание встречается довольно редко, его можно не заметить среди других лихорадочных синдромов. Более того, врачи зачастую сталкиваются с трудностями при проведении диагностических мероприятий и назначении терапии. Поэтому вопросы раннего выявления и правильной маршрутизации больных АВЗ являются весьма актуальными [30].
Проблемы ведения больных с наиболее частым моногенным АВЗ, а именно FMF, были обсуждены на совете экспертов, который был проведен в онлайн-формате в период с 11 ноября по 1 декабря 2020 г. [31]. Было отмечено, что в России предполагаемая численность больных FMF приближается к 17 тыс. При этом в 30–85% случаев (в зависимости от региона) наблюдалась задержка с постановкой диагноза.
Эксперты предложили следующие методы решения проблем маршрутизации больных FMF:
- разработка клинических рекомендаций по диагностике и ведению FMF, проведение образовательных мероприятий и междисциплинарных проектов, направленных на повышение осведомленности специалистов первичного звена здравоохранения о проблеме, признаках и критериях диагностики FMF, а также о дифференциальной диагностике лихорадки неясного генеза;
- формирование на уровне регионов междисциплинарных команд (детский и взрослый ревматолог, генетик, гастроэнтеролог, нефролог и другие необходимые специалисты), целью которых будет оптимизация диагностики и ведения пациентов с FMF;
- обеспечение постоянной возможности дистанционного консультирования типа «врач – врач» для специалистов первичного звена с профильными экспертами;
- повышение доступности терапии FMF;
- выстраивание логистики генетического тестирования с доставкой образцов для анализа из регионов в экспертные центры;
- организация референсных центров для оказания консультативной поддержки в отношении диагностики и лечения FMF, в том числе в рамках специальных дней консультирования по вопросам лихорадок неясного генеза.
С учетом насущных потребностей практического здравоохранения, а также приведенных выше рекомендаций экспертного совета 20 июня 2023 г. был проведен межрегиональный научно-практический семинар и круглый стол «Школа ревматолога. Маршрутизация пациентов с аутовоспалительными заболеваниями». Научным организатором мероприятий выступило ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» (ГБУЗ МО МОНИКИ им. М.Ф. Владимирского). Модераторами были главный врач ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, д.м.н., профессор А.С. Мильто и главный внештатный специалист-ревматолог Министерства здравоохранения Московской области, руководитель Московского областного ревматологического центра, руководитель отделения ревматологии, профессор кафедры терапии факультета усовершенствования врачей ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, председатель Московской областной организации «Ассоциация ревматологов России», д.м.н. Д.Е. Каратеев.
В мероприятии приняли участие ведущие эксперты Московской области и Клиники нефрологии, внутренних и профессиональных заболеваний им. Е.М. Тареева Клинического центра Сеченовского Университета.
Профессор Д.Е. Каратеев акцентировал внимание на актуальности проблемы моногенных, в первую очередь FMF, и полигенных, в частности болезни Стилла взрослых, АВЗ для ревматологов, терапевтов, врачей общей практики и врачей многих других специальностей в силу разнообразия и тяжести их течения, а также на недостаточной настороженности врачей первого контакта в отношении АВЗ. Заподозрить развитие АВЗ позволяют общие клинические признаки наследственных клинических лихорадок, возраст пациента на момент манифестации заболевания, продолжительность атаки, кожные проявления, результаты лабораторного и инструментального обследований.
В Московской области организована маршрутизация пациентов с FMF от момента подтверждения результатами генетических анализов и заключениями федеральных и региональных центров до обеспечения лечением по месту жительства.
В отношении болезни Стилла взрослых ситуация складывается аналогичным образом. Профессор Д.Е. Каратеев представил разработанный в Московском областном ревматологическом центре проект ускоренной маршрутизации пациентов с болезнью Стилла взрослых и отметил ряд сложностей при их ведении. Одна из них – возмещение расходов на лечение в зависимости от кодирования по Международной классификации болезней десятого пересмотра. Если болезни Стилла взрослых соответствует код М06.1, то FMF – код E85.0 (наследственный семейный амилоидоз без невропатии), то есть четвертый класс «Болезни эндокринной системы, расстройства питания и нарушения обмена веществ», что может вызывать сложности при оплате госпитализации. Еще одна проблема – гармонизация обеспечения пациентов с АВЗ генно-инженерными биологическими препаратами, в первую очередь таким жизненно необходимым, как канакинумаб, по различным каналам: в рамках обязательного медицинского страхования (ОМС) или льготного лекарственного обеспечения – регионального лекарственного обеспечения (РЛО) и ведомственной целевой федеральной программы «Обеспечение отдельных категорий граждан лекарственными препаратами в амбулаторных условиях» (ОНЛС/ОНЛП).
Ведущий научный сотрудник отдела нефрологии Клиники нефрологии, внутренних и профессиональных заболеваний им. Е.М. Тареева Сеченовского Университета, д.м.н., профессор В.В. Рамеев представил клинический случай успешного ведения беременной с АВЗ. Профессор также отметил разнообразие клинических вариантов болезни, необходимость своевременного назначения патогенетической терапии и принятия решения о назначении канакинумаба, что потенциально может предотвратить прогрессирование патологии с развитием тяжелого осложнения – вторичного системного амилоидоза, способного быстро привести к развитию почечной недостаточности.
Вопросы преемственности ведения больных АВЗ при взаимодействии педиатров и врачей, ведущих взрослых пациентов, были обсуждены в докладе главного внештатного детского ревматолога Минздрава Московской области, заведующей отделением детской ревматологии ГБУЗ МО «НИКИ детства Минздрава Московской области», к.м.н. Ю.В. Котовой. Пациенты детского возраста получают терапию через фонд «Круг добра». По системе клинико-статистических групп (КСГ) в рамках ОМС возникают проблемы с закупкой дорогостоящих препаратов, в частности канакинумаба. После перехода под наблюдение взрослых врачей только больные с системным ювенильным артритом могут продолжать обеспечиваться в рамках программы льготного обеспечения в амбулаторных условиях пациентов, страдающих редкими и высокозатратными нозологиями (программа «14 высокозатратных нозологий»). Многоканальность обеспечения повзрослевших пациентов затрудняет контроль, поэтому было бы оправданно расширить возраст обеспечения фондом «Круг добра».
Практические аспекты маршрутизации пациентов с АВЗ рассмотрел доцент кафедры трансплантологии, нефрологии и искусственных органов факультета усовершенствования врачей ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, главный врач ООО «Медикал Групп», к.м.н. Д.В. Артемов, заострив внимание на ряде проблемных моментов: оптимизации системы формирования заявок на закупку дорогостоящих препаратов по системе льготного лекарственного обеспечения, включая первичное назначение и переключение между препаратами, борьбу с задержкой поставок препаратов.
Заведующая консультативным отделением Медико-генетического центра (МГЦ) ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, к.м.н. Ю.Ю. Коталевская подчеркнула, что молекулярно-генетическое исследование должно проводиться всем пациентам с подозрением на моногенные АВЗ, а также в случае дифференциальной диагностики.
По мнению заведующей Центром орфанных заболеваний МГЦ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского Е.В. Проскуриной, важнейшим моментом в лекарственном обеспечении является ведение регистра пациентов. Целесообразно инициировать работу по созданию клинических рекомендаций по ведению взрослых пациентов с АВЗ, а также ставить вопрос о расширении перечня программы «14 высокозатратных нозологий».
Заместитель директора ГБУ МО «Научно-практический центр клинико-экономического анализа Министерства здравоохранения Московской области», д.м.н., профессор М.В. Давыдовская отметила, что существующие тарифы КСГ для канакинумаба позволяют применять его круглосуточно и в дневном стационаре. Следует более широко использовать назначение патогенетической терапии АВЗ в рамках РЛО (постановление Правительства РФ от 30.07.1994 № 890 «О государственной поддержке развития медицинской промышленности и улучшении обеспечения населения и учреждений здравоохранения лекарственными средствами и изделиями медицинского назначения»). Она также обратила внимание на необходимость разработки клинических рекомендаций.
В результате работы экспертов были приняты следующие решения.
- Определены специальности первичного звена, вовлеченные в процесс первичного выявления и диагностики АВЗ, – терапевты, врачи общей практики, ревматологи, педиатры, инфекционисты, дерматологи, неврологи и гастроэнтерологи, для которых разработана система «красных флажков» по выявлению АВЗ (рецидивирующие симптомы – лихорадка, артрит/артралгии, миалгии, полисерозит, начало в детском или молодом возрасте, семейный анамнез [9, 15, 23]), позволяющая сформировать клиническое подозрение на принадлежность пациента к группе с редкими болезнями. В дальнейшем пациенты маршрутизируются к ревматологу в МГЦ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, где проводится отбор для медико-генетического обследования с целью верификации диагноза. С врачами этих специальностей планируется проведение цикла лекций в школах ревматолога Московской области и на съезде терапевтов Московской области.
- Необходимо активное обучение специалистов первичного звена по выявлению и маршрутизации пациентов с АВЗ. В настоящее время в России с момента появления симптомов до установления диагноза АВЗ в среднем проходит восемь лет. В Татарстане после проведения программы обучения врачей общей практики этот срок сократился до трех лет.
- Необходимо налаживать контакты между детскими и взрослыми врачами, в первую очередь ревматологами, для своевременного обеспечения квалифицированной медицинской помощью пациентов при переходе во взрослую сеть по достижении 18 лет.
D.E. Karateev, MD, PhD, Prof., A.S. Milto, MD, PhD, Prof.
Moscow Regional Research and Clinical Institute
Contact person: Dmitry E. Karateev, dekar@inbox.ru
Autoinflammatory diseases (AIDs) are a heterogeneous group of rare genetically determined conditions characterized by unprovoked attacks of inflammation. Due to the presence of rheumatic manifestations in most patients, patients with AIDs often referred to rheumatologists.
In most cases, AIDs have a specific genetic basis with mutations in individual genes (monogenic AIDs), the most common nosology is Familial Mediterranean Fever (periodic disease). At the same time, AIDs can also be of polygenic origin; the most typical representatives of polygenic AIDs are systemic juvenile arthritis and adult Still's disease, which is similar in symptoms.
In AIDs, inflammation occurs due to disturbances in the innate immune system with the formation of inflammasomes, which leads to the synthesis of proinflammatory cytokines, in particular interleukin 1β (IL-1β).
The article provides basic clinical data on the most common AIDs, a differential diagnostic algorithm for identifying AIDs, and the main methods of treatment, with a special focus on the use of the IL-1β inhibitor canakinumab. Also, the main points of the resolution of the interregional round table ‘School of Rheumatologist. Routing of patients with autoinflammatory diseases’ June 20, 2023 described.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.