Сердечная недостаточность при эндогенном гиперкортицизме: особенности диагностики и обратимость при достижении ремиссии заболевания
- Аннотация
- Статья
- Ссылки
- English
Цель – уточнить основные сердечно-сосудистые осложнения ЭГ, акцентировав внимание на развитии сердечной недостаточности, и изучить возможность обратимости этих изменений.
Материал и методы. В исследование были включены 70 пациентов с ЭГ (54 женщины и 16 мужчин; средний возраст – 46 [35; 55] лет; средняя продолжительность заболевания – 5,7 года), госпитализированных в ГНЦ ФГБУ «НМИЦ эндокринологии» с диагнозом ЭГ в период с октября 2018 г. по декабрь 2022 г. Всем пациентам при включении в исследование и через шесть месяцев после хирургического лечения проведены стандартное клинико-инструментальное обследование, эхокардиография (эхоКГ) с определением глобальной продольной деформации миокарда, определены биомаркеры сердечной недостаточности – NT-proBNP и ST2. Кроме того, у пациентов c сохраненной фракцией выброса в момент включения в исследование и через шесть месяцев после радикального лечения применялись алгоритмы диагностики сердечной недостаточности H2FPEF и HFA-PEFF.
Результаты. Включенные в исследование 70 пациентов с ЭГ имели верифицированный эндогенный гиперкортицизм (свободный кортизол в суточной моче – 1193,5 [690,9; 2034,6], референсный интервал – 100–379 нмоль/сут, кортизол в слюне в 23.00 – 21,57 [13,03; 43,89], референсный интервал – 0,5–9,65 нмоль/л). Причиной ЭГ в 51 случае стала болезнь Иценко – Кушинга, в девяти – АКТГ-эктопированный синдром, в десяти – кортизол-секретирующая аденома надпочечника. Диагноз сердечной недостаточности верифицирован у 46 (65,7%) из 70 пациентов. Ремиссия ЭГ через шесть месяцев после радикального лечения подтвердилась у 52 пациентов, у 39 больных в результате лечения возникла надпочечниковая недостаточность. Среди 36 повторно обследованных пациентов с ремиссией ЭГ исходно диагноз сердечной недостаточности был подтвержден у 26 пациентов, у 16 из них сердечная недостаточность регрессировала, о чем свидетельствовали результаты лабораторных и инструментальных исследований.
Заключение. ЭГ приводит к повреждению сердечной мышцы с развитием клинических, лабораторных и инструментальных признаков сердечной недостаточности. При этом достижение эукортизолизма приводит к полному регрессу сердечной недостаточности в половине зафиксированных случаев.
Цель – уточнить основные сердечно-сосудистые осложнения ЭГ, акцентировав внимание на развитии сердечной недостаточности, и изучить возможность обратимости этих изменений.
Материал и методы. В исследование были включены 70 пациентов с ЭГ (54 женщины и 16 мужчин; средний возраст – 46 [35; 55] лет; средняя продолжительность заболевания – 5,7 года), госпитализированных в ГНЦ ФГБУ «НМИЦ эндокринологии» с диагнозом ЭГ в период с октября 2018 г. по декабрь 2022 г. Всем пациентам при включении в исследование и через шесть месяцев после хирургического лечения проведены стандартное клинико-инструментальное обследование, эхокардиография (эхоКГ) с определением глобальной продольной деформации миокарда, определены биомаркеры сердечной недостаточности – NT-proBNP и ST2. Кроме того, у пациентов c сохраненной фракцией выброса в момент включения в исследование и через шесть месяцев после радикального лечения применялись алгоритмы диагностики сердечной недостаточности H2FPEF и HFA-PEFF.
Результаты. Включенные в исследование 70 пациентов с ЭГ имели верифицированный эндогенный гиперкортицизм (свободный кортизол в суточной моче – 1193,5 [690,9; 2034,6], референсный интервал – 100–379 нмоль/сут, кортизол в слюне в 23.00 – 21,57 [13,03; 43,89], референсный интервал – 0,5–9,65 нмоль/л). Причиной ЭГ в 51 случае стала болезнь Иценко – Кушинга, в девяти – АКТГ-эктопированный синдром, в десяти – кортизол-секретирующая аденома надпочечника. Диагноз сердечной недостаточности верифицирован у 46 (65,7%) из 70 пациентов. Ремиссия ЭГ через шесть месяцев после радикального лечения подтвердилась у 52 пациентов, у 39 больных в результате лечения возникла надпочечниковая недостаточность. Среди 36 повторно обследованных пациентов с ремиссией ЭГ исходно диагноз сердечной недостаточности был подтвержден у 26 пациентов, у 16 из них сердечная недостаточность регрессировала, о чем свидетельствовали результаты лабораторных и инструментальных исследований.
Заключение. ЭГ приводит к повреждению сердечной мышцы с развитием клинических, лабораторных и инструментальных признаков сердечной недостаточности. При этом достижение эукортизолизма приводит к полному регрессу сердечной недостаточности в половине зафиксированных случаев.




Введение
Эндогенный гиперкортицизм (ЭГ) представляет собой тяжелое эндокринное заболевание, возникающее из-за длительного воздействия избытка глюкокортикоидов [1–3].
У пациентов с ЭГ заболеваемость и смертность от сердечно-сосудистых причин выше по сравнению с общей популяцией, что обусловлено развитием инфаркта миокарда, острого нарушения мозгового кровообращения, а также разрывом аневризм и тромбоэмболией легочной артерии [4, 5]. Установлено, что в отсутствие лечения у пациентов с ЭГ отмечается в четыре-пять раз более высокий уровень смертности, чем среди населения в целом. При этом только 50% пациентов выживают в течение пяти лет с момента установления диагноза в отсутствие лечения [6]. После двусторонней адреналэктомии пятилетняя выживаемость увеличивается до 86% [7]. По данным литературы, среди пациентов с ЭГ у большинства больных (70–80%) наблюдается АКТГ-зависимый ЭГ [1]. Известно, что это заболевание чаще встречается у женщин в возрасте 30–55 лет [8]. Эта половозрастная группа исходно имеет достаточно низкий сердечно-сосудистый риск. Кроме того, пациенты с ЭГ подвергаются воздействию избытка глюкокортикоидов в течение примерно трех-четырех лет до установления диагноза и начала эффективного лечения. В результате увеличивается вероятность раннего развития сердечно-сосудистых осложнений. Еще большую тревогу вызывает тот факт, что, несмотря на достижение ремиссии ЭГ и нормализацию уровня кортизола, сохраняется повышенный риск развития сердечно-сосудистых заболеваний [9].
Избыточное количество кортизола воздействует на минералокортикоидные рецепторы в кардиомиоцитах и вызывает ремоделирование сердца, фиброз и нарушение релаксации левого желудочка [10].
Высокий уровень кортизола в крови также может стимулировать экспрессию нескольких провоспалительных и адгезионных молекул, что приводит к повышению жесткости миокарда и сократительной дисфункции [11]. Структурные и функциональные изменения сердца более выражены у пациентов с артериальной гипертензией, что позволяет предположить наличие взаимосвязи между неблагоприятными эффектами гипертонии и избытком кортизола. Хроническая гиперсекреция кортизола может также вызывать центральное ожирение, резистентность к инсулину, дислипидемию, гиперкоагуляцию и метаболический синдром. Распространенность сахарного диабета при ЭГ колеблется от 18 до 30% [8, 12].
Цель нашего исследования – уточнить основные сердечно-сосудистые осложнения ЭГ, в частности развитие сердечной недостаточности, и изучить возможность обратимости подобных изменений.
Материал и методы
В исследование были включены пациенты, госпитализированные в отделение нейроэндокринологии и остеопатии, отделение терапевтической эндокринологии и отделение хирургии ГНЦ ФГБУ «НМИЦ эндокринологии» с подтвержденным диагнозом ЭГ в активной стадии в период с октября 2018 г. по декабрь 2022 г. Критерии исключения: возраст пациентов младше 18 и старше 65 лет, наличие в анамнезе длительного периода применения глюкокортикоидов, психических заболеваний, клинически значимого поражения коронарных артерий.
Пациентам выполнены следующие исследования:
- лабораторное обследование (общий анализ крови, общий анализ мочи, биохимический анализ крови (определение уровней креатинина, мочевины, мочевой кислоты, калия, натрия, хлора, аспартатаминотрансферазы, аланинаминотрансферазы, креатинфосфокиназы, кальция общего, глюкозы, показателей липидного профиля), показатели кортизола в слюне вечером, в крови вечером и в суточной моче, гликированный гемоглобин) на момент подтверждения диагноза ЭГ и через шесть месяцев после радикального лечения. Исследование общего анализа крови проводилось на автоматическом гематологическом анализаторе Sysmex NX (Sysmex Corporation, Япония), биохимического анализа крови – на анализаторе Architect c8000 (Abbott labs, США), свободного кортизола в слюне (референсный интервал – 0,5–9,65 нмоль/л) – на автоматическом анализаторе Cobas е601 (F. Hoffmann-La Roche Ltd) методом электрохемилюминесценции. Уровень кортизола в сыворотке крови вечером (референсный интервал – 46,0–270,0 нмоль/л) определяли методом электрохемилюминесценции на анализаторе Roche (Elecsys 2010; Cobas e601) стандартным набором, свободного кортизола в суточной моче (референсный интервал 100–379 нмоль/сут) – методом иммунохемилюминесценции на аппарате Vitros ECi с предварительной экстракцией диэтиловым эфиром;
- определение в сыворотке крови N-терминального фрагмента мозгового натрийуретического пептида (NT-proBNP) и стимулирующего фактора роста, экспрессируемого геном 2 (ST2) исходно и через шесть месяцев после радикального лечения. Для оценки уровня NT-proBNP (референсный интервал для пациентов с синусовым ритмом – менее 125 пг/мл, для пациентов с постоянной формой фибрилляции предсердий (ФП) – менее 365 пг/мл) использовали автоматизированную систему Cobas 6000 (Roche/Hitachi, Швейцария), для ST2 (референсный интервал – менее 35 нг/мл) – набор Presage ST2 Assay Kit (Critical Diagnostics, США). Натрийуретические пептиды – широко используемые для диагностики сердечной недостаточности биомаркеры. Кроме того, они позволяют оценить тяжесть течения и прогноз заболевания. NT-proBNP высвобождается кардиомиоцитами в ответ на растяжение. В настоящее время ведется поиск новых биомаркеров с целью диагностики сердечной недостаточности на ранней стадии и определения патогенетических механизмов развития заболевания. Растворимый ингибитор туморогенности (ST2) относится к семейству рецепторов интерлейкина 1, способен связываться с интерлейкином 33, а также блокировать его иммуномодулирующие и антифибротические свойства. Повышение уровня ST2 свидетельствует о прогрессировании воспаления и фиброза миокарда. Прогностическая ценность биомаркера продемонстрирована в ряде исследований. Например, в исследовании Y. Song и соавт. участвовало 405 пациентов с сердечной недостаточностью, из них 110 – с сердечной недостаточностью с сохраненной фракцией выброса (ФВ). Период наблюдения составил 12 месяцев. Наиболее высокая частота неблагоприятных исходов и повторных госпитализаций выявлена у пациентов с повышенным уровнем ST2 (> 35 нг/мл). На основании полученных результатов был сделан вывод, что совместный анализ ST2 и натрийуретических пептидов обладает большей прогностической ценностью, чем определение только натрийуретических пептидов [13];
- электрокардиограмма при включении в исследование и через шесть месяцев после лечения. Регистрация электрокардиограмм проводилась на электрокардиографе ECG-1350 (Nihon Kohden Corporation, Япония);
- эхокардиография (эхоКГ), включая оценку диастолической функции и спекл-трекинг, при первичном обследовании и через шесть месяцев. эхоКГ выполнялась с помощью аппаратов VIVID E95 и VIVID E9 (GE Healthcare, США);
- суточное мониторирование электрокардиограммы при наличии клинических признаков нарушения ритма и проводимости сердца;
- тредмил-тест или эргоспирометрия при клинических симптомах стенокардии напряжения, клинически значимых нарушениях ритма и проводимости сердца, значимом снижении сократительной способности миокарда, коронарография – при наличии показаний;
- диагностические алгоритмы H2FPEF и HFA-PEFF у пациентов c cохраненной фракцией выброса в момент включения в исследование и через шесть месяцев после радикального лечения [14, 15].
Определение диастолической дисфункции левого желудочка (ЛЖ) является важным моментом диагностики сердечной недостаточности с сохраненной фракцией выброса ЛЖ, однако сопряжено с рядом трудностей. В 2018 г. был предложен алгоритм диагностики сердечной недостаточности с сохраненной фракцией выброса – шкала H2FPEF (H2 – Heavy (индекс массы тела > 30 кг/м2), Hypertensive – два и более антигипертензивных препарата, F – Fibrillation, P – Pulmonary (систолическое давление в легочной артерии (СДЛА) > 35 мм рт. ст.), E – Elder (возраст > 60 лет), F – Fillingpressure (давление наполнения ЛЖ E/e ' > 9)) содержит шесть основных критериев диагностики сердечной недостаточности: наличие у пациента ожирения, артериальной гипертензии, ФП, легочной гипертензии (СДЛА > 35 мм рт. ст.), возраст > 60 лет и признаки повышенного давления наполнения ЛЖ (E/e ' > 9), соответствующие определенному количеству баллов. Вероятность диагноза сердечной недостаточности с сохраненной фракцией выброса определялась в зависимости от суммарного балла (0–9). Данная шкала позволяет лучше дифференцировать больных с сердечной недостаточностью. Ее прогностическое значение подтверждено в исследовании D. Sueta и соавт.: высокая частота сердечно-сосудистых и цереброваскулярных событий отмечалась у пациентов с количеством баллов от 7 до 9, при достижении 5–6 баллов фиксировалось увеличение неблагоприятных последствий [15]. В 2019 г. было опубликовано согласованное мнение Ассоциации специалистов по сердечной недостаточности, входящей в состав Европейского общества кардиологов. Эксперты предложили новый алгоритм диагностики сердечной недостаточности с сохраненной фракцией выброса – HFA-PEFF (Heart Failure Association, Ассоциация специалистов по сердечной недостаточности): шаг 1 (P) – Pretest assessment (анализ симптомов, анамнеза, факторов риска), шаг 2 (E) – Echocardiographic (эхоКГ и анализ уровня натрийуретических пептидов), шаг 3 (F1) – Functional testing (стресс-эхоКГ, инвазивная оценка гемодинамики), шаг 4 (F2) – Final aetiology (лучевые методы диагностики, генетический анализ, анализ биомаркеров) [16–18]. Для более точной диагностики сердечной недостаточности с сохраненной фракцией выброса авторы алгоритма предложили большие и малые критерии с разной чувствительностью и специфичностью. Большие эхоКГ-критерии включают: e 'септ. < 7 см/с и е 'лат. < 10 см/с у пациентов моложе 75 лет, е ' септ. < 5 см/с и е 'лат. < 7 см/с у пациентов 75 лет и старше; Е/е ' ≥ 15; скорость трикуспидальной регургитации выше 2,8 м/с, СДЛА > 35 мм рт. ст.; индекс объема левого предсердия > 34 мл/м2 при синусовом ритме и > 40 мл/м2 при ФП, индексированная масса миокарда ЛЖ (иММЛЖ) ≥ 149 г/м2 у мужчин и ≥ 122 г/м2 у женщин при индексе относительной толщины (ИОТ) > 0,42 [17, 18]. Малые эхоКГ-критерии включают в себя: Е/е ' 9–14; глобальная продольная деформация ЛЖ < 16%; индекс объема левого предсердия 29–34 мл/м2 при синусовом ритме и 34–40 мл/м2 при ФП; иММЛЖ ≥ 115 г/м2 у мужчин и ≥ 95 г/м2 у женщин или ИОТ > 0,42 или толщина стенок ЛЖ ≥ 12 мм. К большому лабораторному критерию относится повышение уровня BNP > 80 пг/мл или NT-proBNP > 220 пг/мл при синусовом ритме и > 240 пг/мл или > 660 пг/мл при ФП [19]. Для малого лабораторного диагностического критерия характерны уровни BNP 35–80 пг/мл или NT-proBNP 125–220 пг/мл при синусовом ритме и уровни BNP 105–240 пг/мл или NT-proBNP 375–660 пг/мл при ФП [20, 21]. Перечисленные выше критерии подразделяются на функциональные, морфологические и лабораторные. К функциональным относятся характеристики трансмитрального и транстрикуспидального кровотока, показатели тканевой допплерографии, а также глобальная продольная деформация, к морфологическим – размеры ЛП, иММЛЖ, ИОТ, толщина стенок ЛЖ. Каждый большой критерий соответствует 2 баллам, малый – 1 баллу, полученные баллы суммируются. При сумме баллов ≥ 5 диагноз сердечной недостаточности с сохраненной фракцией выброса считается подтвержденным, от 0 до 1 балла – маловероятным, от 2 до 4 баллов – предварительным – требуется дополнительное диагностическое исследование [22].
Статистический анализ
Статистическую обработку материала проводили с использованием программы SPSS Statistics 22 (SPSS Inc., США). Данные представлены в виде медианы [25-й; 75-й процентили]. Для качественных данных рассчитывали абсолютные (n) и относительные (%) значения. Нормальность распределения определяли с помощью критерия Шапиро – Уилка. Связь между различными показателями устанавливали непараметрическим методом для количественных данных Уилкоксона. Для качественных данных использовали критерий Мак-Немара. Связь между различными показателями определяли с помощью коэффициента корреляции Спирмена (r). Статистически значимыми считали различия при p < 0,050.
Результаты
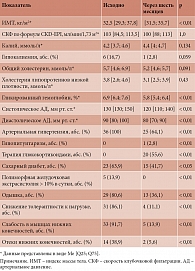
В проспективном когортном исследовании участвовали 70 пациентов с ЭГ. Продолжительность заболевания составила в среднем 5,7 года (табл. 1).
Среди включенных в исследование пациентов с ЭГ у 51 диагностирована болезнь Иценко – Кушинга, у девяти – АКТГ-эктопический синдром, у десяти – кортизол-секретирующая аденома надпочечника (синдром Иценко – Кушинга).
Среди клинических симптомов со стороны сердечно-сосудистой системы наиболее часто отмечались одышка, слабость, снижение толерантности к нагрузке, отеки нижних конечностей, слабость в мышцах нижних конечностей.
По результатам эхоКГ у 16 (22%) пациентов выявлено расширение левого предсердия, у 3 (4,3%) – ЛЖ. Кроме того, у 37 (52,9%) пациентов обнаружена гипертрофия ЛЖ, у 4 – умеренное снижение ФВ ЛЖ (40–50%). Нарушение диастолической функции зарегистрировано у 37 (52,9%) пациентов.
Помимо рутинных измерений при оптимальном качестве изображения 61 (85,9%) пациенту выполнено исследование глобальной продольной деформации миокарда. Ее снижение зафиксировано в 28 (39,4%) случаях. Визуализация спекл-деформации позволяет отслеживать механические свойства ЛЖ в режиме реального времени в трех измерениях на протяжении сердечного цикла, предоставляя более подробную информацию о функциональных изменениях [23].
Для уточнения диагноза сердечной недостаточности у всех пациентов определялись уровни NT-proBNP и ST2.
Повышение уровня NT-proBNP >125 пг/мл зарегистрировано у 35 (49,3%) пациентов, уровня ST2 > 35 нг/мл – у 36 (50,7%).
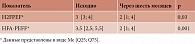
С учетом того что у большинства больных систолическая функция ЛЖ была сохранена, для уточнения диагноза хронической сердечной недостаточности у пациентов с сохраненной ФВ ЛЖ (> 50%) применялись диагностические алгоритмы, рекомендованные Американским обществом кардиологов (H2FPEF) и Европейским обществом кардиологов (HFA-PEFF) (табл. 2).
С учетом клинических данных, результатов эхоКГ, повышенного уровня биомаркеров сердечной недостаточности, результатов применения алгоритмов диагностики сердечной недостаточности с сохраненной ФВ ЛЖ (H2FPEF и HFA-PEFF) сердечная недостаточность диагностирована у 46 (65,7%) пациентов.
Пациентам с подтвержденным диагнозом сердечной недостаточности назначали терапию бета-блокаторами, петлевыми диуретиками, антагонистами минералокортикоидных рецепторов, ингибиторами ангиотензинпревращающего фермента или блокаторами рецепторов ангиотензина, ингибиторами натрий-глюкозного котранспортера 2-го типа.
Выявлена умеренная положительная корреляционная связь между снижением глобальной продольной деформации и уровнем кортизола в слюне вечером (r = 0,266; p < 0,05), между ремоделированием миокарда и уровнем кортизола в слюне вечером (r = 0,397; p < 0,01). Кроме того, значимая корреляционная связь установлена между уровнем кортизола в слюне вечером и уровнями биомаркеров сердечной недостаточности (для NT-proBNP – r = 0,355; p < 0,01; для ST2 – r = 0,513; p < 0,01). Значимая корреляционная связь также зафиксирована между уровнем кортизола в крови вечером, уровнем свободного кортизола в суточной моче и ST2 (r = 0,500; p < 0,01; r = 0,513; p < 0,01 соответственно). Кроме того, значимая положительная корреляционная связь установлена между уровнем кортизола в слюне и количеством баллов алгоритма HFA-PEFF (r = 0,380; p < 0,01).
Умеренная отрицательная корреляционная связь отмечалась между соотношением пиков трансмитрального кровотока E/A и уровнем кортизола в крови вечером (r = -0,341; p < 0,01).
Целями лечения ЭГ являются нормализация уровня кортизола и обратное развитие клинических симптомов [24]. Больным ЭГ выполнялось радикальное хирургическое лечение – удаление первичного очага (при болезни Иценко – Кушинга – эндоскопическая трансназальная аденомэктомия; при АКТГ-эктопическом синдроме – резекция очага (в нашем исследовании пациентам с АКТГ-эктопическим синдромом проводилась резекция легкого); при синдроме Иценко – Кушинга – лапароскопическая адреналэктомия с опухолью). В случае неэффективности проведенного ранее оперативного лечения и наличия жизнеугрожающих осложнений ЭГ выполнялась двусторонняя адреналэктомия (табл. 3).
Клинико-лабораторная ремиссия эндогенного гиперкортицизма через шесть месяцев после радикального лечения подтверждена у 52 из 70 пациентов, у 39 пациентов в результате лечения возникла надпочечниковая недостаточность.
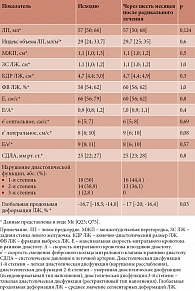
Через шесть месяцев после радикального лечения полное обследование прошли 36 пациентов с ремиссией ЭГ.
Проведена оценка динамики клинико-лабораторных показателей у пациентов с ремиссией ЭГ (табл. 4).
По достижении ремиссии заболевания отмечалось снижение индекса массы тела, уровней артериального давления и гликированного гемоглобина, значимо уменьшились клинические симптомы (в частности одышка, снижение толерантности к нагрузке, слабость в мышцах нижних конечностей, периферические отеки). У пациентов с ремиссией ЭГ не зарегистрировано полиморфных желудочковых экстрасистол. Двум пациентам с ремиссией ЭГ, у которых было выявлено нарушение проводимости сердца, имплантирован постоянный электрокардиостимулятор: в одном случае из-за атриовентрикулярной блокады 3-й степени, в другом – в связи с синоатриальной блокадой 3-й степени.
У части пациентов в ремиссии заболевания сохранялись артериальная гипертензия и сахарный диабет, однако уменьшилась потребность в антигипертензивной и сахароснижающей терапии.
По результатам эхоКГ не выявлено значимых различий в ремоделировании левого предсердия и ЛЖ, диастолической дисфункции. Умеренное значимое различие зарегистрировано в показателях глобальной продольной деформации у пациентов с активной стадией заболевания и после достижения ремиссии (p < 0,05) (табл. 5).
Уровни биомаркеров сердечной недостаточности (NT-proBNP и ST2) через шесть месяцев ремиссии были достоверно ниже (табл. 6).
Исходно уровень NT-proBNP > 125 пг/мл отмечался у 20 (55,6%) пациентов, уровень ST2 > 35 нг/мл – у 17 (47,2%) пациентов. После достижения ремиссии повышенный уровень NT-proBNP сохранился у 9 (25%) пациентов и ST2 – у 5 (13,9%) пациентов.
Кроме того, статистически значимое снижение количества баллов выявлено при использовании алгоритмов H2FPEF и HFA-PEFF (табл. 7).
Среди 36 повторно обследованных пациентов с ремиссией ЭГ исходно диагноз сердечной недостаточности был подтвержден у 26 пациентов, у 16 из них сердечная недостаточность регрессировала, на что указывали данные лабораторных и инструментальных исследований.
Обсуждение
В исследовании впервые было показано, что сердечная недостаточность развивается более чем у половины пациентов с ЭГ, несмотря на молодой возраст, преимущественно у женщин. Прямые корреляционные зависимости между уровнем кортизола в слюне и суточной моче и маркерами сердечной недостаточности, а также обратимый характер развития сердечной недостаточности могут свидетельствовать о преимущественном влиянии кортизола на сердечную мышцу, подобно развитию проксимальной миопатии.
Важно отметить, что большинство исследований сердечно-сосудистых осложнений ЭГ касаются артериальной гипертензии, гиперлипидемии, нарушений углеводного обмена и изменений, выявленных при выполнении электрокардиограммы и эхоКГ.
Данные нашего исследования сопоставимы с результатами других исследований частоты артериальной гипертензии и гиперлипидемии [3, 4, 10].
Дилатационная кардиомиопатия с тяжелой левожелудочковой недостаточностью при ЭГ встречается редко. A. Frustaci и соавт. описали восемь случаев синдрома Кушинга у 473 пациентов с дилатационной кардиомиопатией (1,7%). У всех пациентов имели место симптомы сердечной недостаточности и фракция выброса ЛЖ < 30%. Эндомиокардиальная биопсия проводилась до лечения трем из восьми пациентов и через год после адреналэктомии с опухолью. Биопсия продемонстрировала увеличение диаметра кардиомиоцитов, фиброз миокарда и площадь миофибриллолиза по сравнению с пациентами с идиопатической дилатационной кардиомиопатией и пациентами с пороками сердца без сердечной недостаточности. Выявленные изменения уменьшились после адреналэктомии [25].
В ряде исследований эхоКГ показала более выраженные параметры ремоделирования сердца по сравнению с сопоставимой по полу, возрасту и уровню артериального давления контрольной группой.
В исследовании P.M. Toja и соавт. основную группу представлял 71 пациент с синдромом Кушинга, контрольную – 70 пациентов. Пациенты были сопоставимы по половозрастным характеристикам, уровню артериального давления. 44 пациентам на протяжении полутора лет с определенной периодичностью проводилась эхоКГ. Параметры массы ЛЖ и относительной толщины стенки значительно улучшились через год после достижения ремиссии ЭГ, хотя они все еще были выше, чем в контрольной группе. Незначительная систолическая дисфункция ЛЖ регрессировала, диастолическая функция восстановилась [26].
В исследовании A.M. Periera и соавт. у 15 пациентов, обследованных с помощью спекл-трекинга, ЭГ вызывал не только гипертрофию и диастолическую дисфункцию, но и субклиническую систолическую дисфункцию ЛЖ. Нормализация уровня глюкокортикоидов приводила к регрессу этих изменений [27].
Согласно рекомендациям Европейского общества кардиологов 2021 г., для диагностики сердечной недостаточности с сохраненной фракцией выброса необходимо наличие симптомов и клинических проявлений сердечной недостаточности, ФВ ЛЖ ≥ 50%, повышенного уровня мозгового натрийуретического пептида (BNP) или N-концевого фрагмента его предшественника (NT-proBNP), а также объективных признаков структурных и/или функциональных нарушений сердца, которые могут проявляться гипертрофией ЛЖ и/или его диастолической дисфункцией [14]. В нашем исследовании у большинства пациентов отмечалась избыточная масса тела (табл. 1). Как известно, ожирение – один из основных факторов риска развития сердечной недостаточности. Около 30% больных с подтвержденной сердечной недостаточностью с сохраненной фракцией выброса имеют нормальный уровень BNP или NT-proBNP. Предполагается, что нормальный уровень натрийуретических пептидов у пациентов с ожирением может быть связан с нарушением взаимодействия натрийуретических пептидов с рецепторами адипоцитов, механизмы которого до конца не изучены [28]. Многочисленные исследования свидетельствуют о том, что у больных с сохраненной фракцией выброса ЛЖ выявляются более низкие уровни BNP и NT-proBNP по сравнению с пациентами со сниженной фракцией выброса ЛЖ, что может быть обусловлено отсутствием дилатации ЛЖ [29].
Описаны отдельные клинические случаи наличия у пациентов с ЭГ сердечной недостаточности, а также исследования с небольшим числом пациентов [8, 10, 30, 31].
Результаты нашей работы подтверждают опубликованные ранее данные исследований и демонстрируют связь выявленных изменений с тяжестью гиперкортицизма, а также частичную обратимость установленных нарушений.
Отечественных исследований сердечной недостаточности с сохраненной фракцией выброса, которая может усугублять клиническое состояние пациентов с ЭГ и приводить к ухудшению прогноза, не проводилось.
Данная работа является продолжением работы по определению уровня биомаркеров сердечной недостаточности у больных ЭГ [32].
Наше исследование дополнено новыми алгоритмами диагностики сердечной недостаточности с сохраненной фракцией выброса – H2FPEF и HFA-PEFF и включало большее количество пациентов.
Заключение
Примерно у половины пациентов с ЭГ развивается сердечная недостаточность, выраженность которой обусловлена тяжестью гиперкортицизма. Выявлены прямые зависимости между биомаркерами сердечной недостаточности и суточной секрецией, а также нарушением циркадности свободных форм кортизола. При достижении ремиссии ЭГ и нормализации уровня кортизола через шесть месяцев наблюдаются регресс симптомов, снижение уровня биомаркеров сердечной недостаточности с полным восстановлением функции у половины пациентов.
Работа выполнена в рамках государственного задания по теме НИР № 123021000043-0 «Дисфункция миокарда и формирование сердечной недостаточности в исходе морфологических, молекулярно-генетических и биохимических нарушений в сердечной мышце у пациентов с эндокринопатией».
Протокол научно-исследовательской работы одобрен локальным этическим комитетом ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России, протокол № 15 от 12 сентября 2018 г.
Одобрение и процедуру проведения протокола получали по принципам Хельсинкской конвенции.
Авторы заявляют об отсутствии явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Авторы декларируют соответствие своего авторства международным критериям ICMJE.
R.S. Kosharnaya, Zh.Ye. Belaya, Ye.O. Mamedova, Ye.G. Przhiyalkovskaya, Z.T. Zuraeva, M.S. Michurova, V.Yu. Kalashnikov
National Medical Research Center for Endocrinology
Contact person: Raisa S. Kosharnaya, r.kosharnaya@gmail.com
Endogenous hypercortisolism (EH) is manifested by many organs and tissues damage, which occurs as a result of prolonged body exposure to excess glucocorticoids amounts. Among the clinical symptoms of the disease shortness of breath, weakness, decreased exercise tolerance and severe myopathies are quite common, which suggests the possibility of heart muscle damage. At the same time, data on the development of heart failure in patients with EH and its reversibility are presented in individual clinical descriptions, most likely due to the rarity of the disease.
Purpose – to clarify the main cardiovascular complications of EH, with a particular focus on heart failure development, and to study the possibility of these changes regression.
Material and methods. 70 patients with EH were enrolled in the study (54 women and 16 men, average age 46 [35; 55] years; average duration of the disease 5.7 years, hospitalised at National Medical Research Centre of Endocrinology with a confirmed diagnosis of EH from October 2018 to December 2022). All patients underwent a comprehensive clinical investigation including expert echocardiography with speckle tracking and evaluation of NT-proBNP and ST2 cardiac biomarkers at the baseline and 6 months after surgical treatment. In addition, for patients with preserved ejection fraction the H2FPEF and HFA-PEFF heart failure diagnostic algorithms were used at the baseline and 6 months after surgical treatment.
Results. The study included 70 patients with EH with verified endogenous hypercortisolism (cortisol in daily urine = 1193.5 [690.9; 2034.6], normal range – 100–379 nmol/day, cortisol in saliva at 23.00 – 21.57 [13.03; 43.89], normal range – 0.5–9.65 nmol/l). The cause of EG in 51 cases was Cushing disease, in 9 – ACTH-ectopic syndrome, in 10 – cortisol-secreting adrenal adenoma. The diagnosis of heart failure was verified in 46 (65.7%) of 70 patients. Remission of EH 6 months after radical treatment was confirmed in 52 patients; 39 patients developed adrenal insufficiency as a result of treatment. Among 36 re-examined patients with remission of EH, the initial diagnosis of heart failure was confirmed in 26 patients, in 16 of them heart failure regressed, which was verified by laboratory and instrumental methods.
Conclusion. EH leads to the heart muscle damage with the development of clinical, laboratory and instrumental signs of heart failure. At the same time, achieving eucortisolism leads to complete regression of heart failure in half of the recorded cases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.