Возможности коррекции пирексии у пациентов с BRAF+ меланомой, получающих таргетную терапию
- Аннотация
- Статья
- Ссылки
- English


Введение
За последнее десятилетие возможности лекарственной терапии пациентов с меланомой значительно расширились. Одним из вариантов лечения стала таргетная терапия – блокирование митоген-активированного протеинкиназного сигнального пути в клетках меланомы, имеющих мутацию в гене BRAF (ингибиторы BRAF и МЕК). Использование таргетной терапии (комбинация препаратов дабрафениба и траметиниба, вемурафениба и кобиметиниба, энкорафениба и биниметиниба) позволяет быстро добиться противоопухолевого ответа и увеличения продолжительности жизни как при метастатической меланоме, так и в адъювантном режиме при меланоме кожи высокого риска [1–6]. Лечение с использованием таргетной терапии проводится до прогрессирования заболевания или развития неприемлемой токсичности. Сказанное означает, что часть пациентов может получать таргетную терапию длительный период, в то время как развитие нежелательных явлений (НЯ) способно привести к досрочному прекращению лечения. Это потенциально скажется на результатах терапии. Согласно данным регистрационных исследований, при использовании комбинированной таргетной терапии по поводу метастатической меланомы частота прекращения лечения из-за НЯ составляет 12,5–15,7% [1–3].
Почти у всех пациентов, получающих таргетную терапию, развиваются различные НЯ независимо от используемой комбинации таргетных препаратов (дабрафениб и траметиниб vs вемурафениб и кобиметиниб vs энкорафениб и биниметиниб), которые в большинстве случаев класс-специфичны: утомляемость, артралгия, сыпь, тошнота. Как правило, большинство НЯ 1-й или 2-й степени тяжести. В то же время некоторые НЯ, видимо, зависят от используемых препаратов. Например, лихорадка/ пирексия чаще регистрируется на фоне применения дабрафениба (и комбинации дабрафениба и траметиниба), а фотосенсибилизация – при использовании вемурафениба (комбинации вемурафениба и кобиметиниба). Кроме того, большинство НЯ реже возникают при комбинированной терапии, хотя лихорадка, связанная с лечением, составляет исключение. Основной задачей лекарственной терапии является увеличение продолжительности жизни пациентов при сохранении ее качества, поэтому своевременный мониторинг, обнаружение НЯ и его коррекция считаются важными составляющими лечебного процесса. Рассмотрим подробно пирексию, возникающую на фоне таргетной терапии дабрафенибом и траметинибом.
Частота развития пирексии по данным регистрационных исследований комбинации дабрафениба и траметиниба у пациентов с меланомой
В 2019 г. был представлен анализ пятилетнего наблюдения за 563 пациентами с метастатической BRAF V600+ меланомой кожи, которые получали комбинированную таргетную терапию дабрафенибом и траметинибом в рамках двух клинических исследований III фазы – COMBI-v и COMBI-d [5]. На основании данных этого анализа была подтверждена долгосрочная эффективность таргетной терапии у пациентов с BRAF+ метастатической меланомой. Выживаемость без прогрессирования (ВБП) составила 21% (95%-ный доверительный интервал (ДИ) 17–24) через четыре года и 19% (95% ДИ 15–22) через пять лет. Общая выживаемость (ОВ) у всех пациентов, вошедших в объединенный анализ, составила 37% (95% ДИ 33–42) через четыре года и 34% (95% ДИ 30–38) через пять лет. При этом для 109 пациентов, которые получали комбинированную таргетную терапию дабрафенибом и траметинибом и у которых удалось достичь полного ответа (ПО), пятилетняя ОВ составила 71% с медианой продолжительности ответа 36,7 месяца. У половины пациентов (n = 55) ПО сохраняется по итогам проведения последней оценки. У большинства пациентов с ПО имели место «благоприятные» характеристики: ECOG – 0, нормальный уровень лактатдегидрогеназы, менее трех органов с метастазами на момент начала терапии.
Нежелательные явления (независимо от причины) зарегистрированы у 548 (98%) из 559 пациентов. О непредвиденных НЯ при длительном наблюдении не сообщалось. НЯ, приведшие к прекращению приема комбинации дабрафениба и траметиниба, зарегистрированы у 99 (18%) пациентов из 559. Пирексия стала наиболее частой причиной полной отмены терапии – 4% (n = 23).
Необходимо отметить, что у пациентов, получавших дабрафениб в комбинации с траметинибом, не зафиксировано летальных исходов, связанных с лечением.
В 2020 г. были представлены результаты пятилетнего анализа исследования COMBI-AD в отношении адъювантного использования комбинации дабрафениба и траметиниба у пациентов с BRAF+ меланомой кожи высокого риска (III стадия) после хирургического лечения. В исследование COMBI-AD в общей сложности было включено 870 пациентов (438 составили группу дабрафениба и траметиниба, 432 – группу плацебо). Характеристики пациентов были хорошо сбалансированы в двух группах. Пятилетняя выживаемость без рецидива (первичная конечная точка исследования) составила 52% (95% ДИ 48–58) в группе комбинации дабрафениба и траметиниба и 36% (95% ДИ, 32–41) в группе плацебо. Риск рецидива и летального исхода по сравнению с плацебо снизился на 49% (отношение рисков для рецидива или смерти 0,51; 95% ДИ 0,42–0,61).
Как минимум одно НЯ зарегистрировано у 422 (97%) пациентов группы комбинированной терапии и 380 (88%) пациентов группы плацебо. Из НЯ, развившихся более чем у 10% пациентов в группе комбинированной терапии, наиболее частым была лихорадка (любой степени – 63%; 3-й или 4-й степени – 5%) [5].
Поскольку пирексия стала наиболее частым побочным эффектом в исследовании COMBI-AD, исследователи дополнительно охарактеризовали сроки наступления событий, чтобы предоставить дополнительный контекст к результатам. У большинства пациентов пирексия развивалась в течение 23 дней от начала лечения (11–63 дня) в среднем с трехдневной (2–7 дней) длительностью эпизода [7]. Адъювантный 12-месячный курс комбинированной таргетной терапии дабрафенибом и траметинибом прекратили 26% пациентов из-за НЯ, в частности 9% всех пациентов именно из-за пирексии [7, 8].
Таким образом, частота полной отмены комбинированной таргетной терапии дабрафенибом и траметинибом вследствие пирексии, по данным регистрационных исследований, составляет 4–9%, что способно негативно отразиться на результатах лечения. Поэтому своевременное выявление и лечение пирексии может помочь смягчить исходы тяжелой степени пирексии и позволит большему количеству пациентов продолжить комбинированную терапию дабрафенибом и траметинибом в течение необходимого времени.
Частота развития пирексии по данным объединенного анализа нескольких клинических исследований
В 2021 г. были представлены результаты анализа 1071 пациента, получавшего комбинацию дабрафениба и траметиниба в следующих клинических исследованиях: регистрационное исследование фазы II при распространенном немелкоклеточном раке легкого (НМРЛ) (n = 82), исследование COMBI-AD фазы III при операбельной меланоме стадии III (n = 435) и исследования COMBI-d и COMBI-v фазы III при нерезектабельной или метастатической меланоме (n = 209 и n = 350 соответственно) [9].
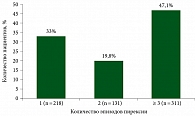
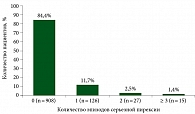
Из 1076 пациентов, включенных в клинические исcледования, у 61,3% (n = 660) развилась пирексия любой степени, у 5,7% – пирексия 3–4-й степени, у 15,6% – пирексия как серьезное НЯ, определенное критериями конкретного исследования. Среди 660 пациентов с пирексией у 33,0% зарегистрирован один эпизод пирексии, у 19,8% – два эпизода и у 47,1% – три эпизода и более (рис. 1). Важно, что из 15,6% случаев серьезной пирексии в 11,7% отмечался лишь один эпизод (рис. 2). Частота лихорадки, которая была самой высокой в начале лечения, со временем снижалась. Временное прекращение приема дабрафениба или траметиниба было наиболее распространенной и эффективной стратегией лечения.
Исторически считалось, что развитие пирексии связано с дабрафенибом. Не случайно, например, в исследовании COMBI-AD для купирования пирексии рекомендовалось снизить и/или отменить дозу дабрафениба (150 мг два раза в день), но не траметиниба (2 мг один раз в день). Однако с учетом более высокой частоты лихорадки на фоне применения комбинации дабрафениба и траметиниба по сравнению с монотерапией дабрафенибом в исследовании COMBI-d (51 против 28%) в настоящее время считается, что траметиниб также способствует возникновению лихорадки [10, 11].
V. Atkinson и соавт. [12] опубликовали обновленный адаптированный алгоритм лечения пирексии (рис. 3), в котором рекомендуют прекратить прием как дабрафениба, так и траметиниба при появлении пирексии, которая определяется как повышение температуры ≥ 38 °С без признаков инфекционного поражения. Еще одно изменение в текущем алгоритме пирексии связано с возможностью отмены терапии при симптомах пирексии (озноб, мышечная ригидность, ночная потливость или другие гриппоподобные симптомы без подтвержденной температуры ≥ 38 °С) в случае подозрения на рецидив пирексии. Рекомендуется также возобновить прием обоих препаратов в полной дозе в случае отсутствия у пациента симптомов в течение 24 часов и более.
Исследование COMBI-APlus
Понимая важность управления НЯ, возникающими в ходе лечения, компания «Новартис» провела исследование COMBI-APlus (NCT03551626) – открытое исследование IIIb фазы комбинации дабрафениба и траметиниба у пациентов с BRAF+ меланомой кожи высокого риска (стадия III). Целью исследования было изучение влияния приведенного выше модифицированного алгоритма управления пирексией на частоту развития пирексии 3–4-й степени, госпитализации из-за пирексии или прекращения таргетной терапии при проведении 12-месячного курса адъювантной терапии дабрафенибом и траметинибом [12].
Согласно новому алгоритму, пирексией считается повышение температуры тела пациента ≥ 38 °C (ранее – 38,5 °C) или синдром пирексии – развитие озноба, ночной потливости или гриппоподобных симптомов без повышения температуры ≥ 38,0 °C в случае предполагаемой рецидивирующей пирексии по мнению исследователя.
Повторным эпизодом пирексии может считаться и непосредственно повторное повышение температуры тела пациента до 38 °C, появление так называемого синдрома пирексии: озноба, ночной потливости или гриппоподобных симптомов без температуры ≥ 38°С. В таких случаях алгоритм действия тот же: нужно приостановить прием обоих препаратов. При отсутствии симптомов в течение 24 часов и более необходимо восстановить прием дабрафениба и траметиниба либо в начальной дозе, либо в сниженной (принимая во внимание тяжесть симптомов пирексии и характеристики болезни).
Алгоритмы ведения пациентов, использовавшиеся в клинических исследованиях, приведены на рис. 4.
С 29 августа 2018 г. по 26 сентября 2019 г. 552 пациента из 23 стран, в том числе России, были включены в исследование. На момент анализа (5 октября 2020 г.) все 552 пациента либо завершили запланированный 12-месячный курс лечения, либо прекратили терапию по разным причинам. Медиана времени наблюдения на момент анализа составила 18,1 месяца.
Пирексия любой степени наблюдалась у 374 (67,8%) пациентов, в частности у 194 (51,9%) – 1-й степени, 159 (42,5%) – 2-й степени, 15 (4,0%) – 3-й степени, 6 (1,6%) – 4-й степени. Отмена дозы дабрафениба и траметиниба зарегистрирована у 61,6 и 60,9% пациентов соответственно, а снижение дозы дабрафениба и траметиниба лишь у 5,8 и 4,3% пациентов соответственно. Среднее время до первого проявления лихорадки составило 22 дня (11–69 дней), а средняя продолжительность первого случая лихорадки – 2 дня (2–4 дня). Медиана продолжительности лечения как для дабрафениба, так и для траметиниба достигла 11 месяцев, а медиана относительной интенсивности дозы – 94,5%.
Исследование COMBI-APlus достигло своей первичной конечной точки улучшения частоты пирексии и исходов по сравнению с историческим контролем из исследования COMBI-AD. Пирексия 3–4-й степени, госпитализация из-за пирексии или полная отмена лечения наблюдались у 44 пациентов – всего 8,0% (95% ДИ 5,9–10,6) по сравнению с контрольной частотой 20,0% по данным исследования COMBI-AD.
Отдельно частота развития пирексии 3–4-й степени составила 3,8% в COMBI-APlus по сравнению с 5,3% в COMBI-AD, частота госпитализаций из-за пирексии – 4,3 и 10,6%, а частота прекращения лечения из-за пирексии – 2,4 и 9% соответственно (таблица). Поскольку исходные характеристики пациентов в исследованиях COMBI-AD и COMBI-APlus были схожими, предполагается, что именно использование модифицированного алгоритма управления пирексией способствовало улучшению результатов.
Предварительные результаты оценки выживаемости без рецидива свидетельствуют о том, что адаптированный алгоритм ведения пациентов с пирексией не снижает эффективности терапии. Через 12 месяцев 91,8% пациентов были живы и без рецидивов по сравнению с 88% в исследовании COMBI-AD.
Общий профиль НЯ в исследовании COMBI-APlus был аналогичен профилю в исследовании COMBI-AD, за исключением 27,9% пациентов с повышенным уровнем креатинфосфокиназы в крови (параметр, который не требовалось рутинно оценивать в исследовании COMBI-AD). В совокупности эти данные демонстрируют, что эффект модифицированного алгоритма прежде всего касается именно развития пирексии 3–4-й степени, а также госпитализации из-за пирексии или полной отмены лечения. Данный алгоритм не предполагал снижения общей частоты лихорадки (63% в COMBI-AD и 67,8% в COMBI-APlus) и был рассчитан именно как алгоритм, позволивший уменьшить частоту тяжелых эпизодов лихорадки, чтобы больше пациентов смогли завершить запланированный курс лечения.
В опубликованном в 2021 г. канадском консенсусе [13] по ведению пациентов с пирексией рекомендуется:
1) при первом эпизоде пирексии (или синдрома пирексии) приостановить прием дабрафениба и траметиниба. Следует рассмотреть возможность использования ацетаминофена или нестероидных противовоспалительных препаратов (НПВП), например ибупрофена, чтобы облегчить симптомы. Чередование ацетаминофена и ибупрофена может помочь быстрее разрешить синдром пирексии, а также поддерживать разрешение симптомов. Кроме того, для клинической оценки тяжелой/осложненной пирексии необходимо выполнить анализы крови (общий анализ с лейкоцитарной формулой, креатинин, электролиты, печеночные ферменты) и исследование на инфекции.
При неосложненной пирексии целесообразно выполнить клиническую оценку и те же анализы, если через 48 часов улучшения не наблюдается, несмотря на прекращение приема и использование антипиретиков. Антибиотики используются только в случае подтвержденной инфекции или нейтропении 3–4-й степени. Лечение дабрафенибом и траметинибом не следует возобновлять до тех пор, пока у пациента не исчезнут симптомы в течение как минимум 24 часов. Канадская рабочая группа также рекомендует, чтобы пациент не принимал жаропонижающих препаратов в течение как минимум 24 часов, поскольку это может маскировать продолжающиеся симптомы, связанные с синдромом пирексии.
При тяжелом/осложненном синдроме пирексии (требующем госпитализации или осложненном обезвоживанием 2-й степени и более по CTCAE, гипотензией, нарушением функции почек, спутанностью сознания или рвотой без другой конкретной причины (например, инфекции)) возобновляют прием дабрафениба и траметиниба в уменьшенной на одну ступень дозе не менее чем через 24 часа (по мнению ряда членов рабочей группы, должно пройти не менее 48 часов после разрешения симптомов синдрома пирексии, прежде чем возобновлять лечение) после исчезновения симптомов и прекращения приема жаропонижающих препаратов (ацетаминофен/ибупрофен). Увеличение дозы одного или обоих препаратов (дабрафениба или траметиниба) может быть рассмотрено позднее, если это клинически целесообразно.
При синдроме пирексии в отсутствие подтвержденной инфекции, который не улучшается через 48 часов, можно рассмотреть вопрос о назначении глюкокортикостероидов (ГКС);
2) при неосложненном повторном эпизоде пирексии, который развился более чем через три недели после разрешения первого эпизода, алгоритм лечения соответствует алгоритму, описанному для первого случая, – отмена обоих препаратов и использование при необходимости жаропонижающих средств. Возобновлять терапию дабрафенибом и траметинибом рекомендовано без редукции дозы с предыдущей дозы, если нет осложнений.
При неосложненном повторном эпизоде пирексии, который развился менее чем через три недели после разрешения первого эпизода, необходимо отменить прием дабрафениба и траметиниба, использовать НПВП. Кроме того, целесообразно рассмотреть профилактику стероидами, или стратегию прерывистого дозирования, или снижение дозы при возобновлении лечения за счет уменьшения дозы прежде всего дабрафениба. Если улучшения нет, целесообразно снизить дозу траметиниба (согласно инструкции);
3) при синдроме кластерной пирексии (три и более эпизода за 30 дней) рекомендуется отменить прием дабрафениба и траметиниба, использовать ацетаминофен/ибупрофен, а также рассмотреть вопрос о назначении ГКС.
Решение об использовании ГКС или прерывистого дозирования должно быть адаптировано к характеру возникновения синдрома пирексии, потребностям пациента (сопутствующим заболеваниям) и условиям (лечению по поводу метастатической меланомы или в адъювантном режиме).
Возможные дозы препаратов:
- ацетаминофен: по 1 г каждые 4–6 ч, но не более 4 г в день;
- ибупрофен: по 400 мг каждые 4–6 ч, но не более 1,2 г в день при самостоятельном приеме или 3,2 г в день под тщательным наблюдением.
Как правило, прием ацетаминофена чередуется с приемом ибупрофена. Следует рассмотреть более низкие дозы при чередовании ацетаминофена и ибупрофена в зависимости от тяжести и продолжительности синдрома пирексии.
Доза ГКС в профилактических целях: преднизолон перорально 7,5–25 мг или дексаметазон 0,5–4 мг перорально ежедневно. Снижение дозы ГКС необходимо начинать, когда у пациента не наблюдается пирексия в течение как минимум месяца (с учетом клинических данных и других характеристик, связанных с пациентом и заболеванием).
Продолжать использование ГКС в течение как минимум месяца рекомендуется также австралийской группой [14].
Дозы ГКС для лечения резистентной пирексии (симптомы не улучшаются при отмене дабрафениба и траметиниба и использовании жаропонижающих средств): преднизолон 7,5–25 мг перорально в течение ≥ 5 дней.
Стратегия прерывистого приема дабрафениба и траметиниба включает короткий перерыв продолжительностью от двух до пяти дней, начинающийся за один-два дня до предполагаемого начала синдрома пирексии, с последующим лечением в предыдущей дозе по завершении перерыва в лечении. Австралийские эксперты советуют использовать стратегию прерывистого приема полной дозы, которая включает непрерывное лечение в течение 12 дней с последующим двухдневным перерывом для пациентов с синдромом пирексии, который повторяется каждые две-три недели. Рекомендация прерывистого дозирования теоретически подтверждается фармакокинетическими свойствами препаратов.
Заключение
Адаптированный алгоритм управления пирексией может быть проще в использовании, чем предыдущий подход к лечению пирексии, и позволяет пациентам контролировать гипертермию самостоятельно в домашних условиях в большинстве случаев без необходимости посещения клиники. Первые данные о безрецидивной выживаемости в исследовании COMBI-APlus демонстрируют эффективность лечения и возможность получения большинством пациентов долгосрочной пользы. Влияние адаптированного алгоритма лечения лихорадки на долгосрочную безрецидивную и общую выживаемость является предметом продолжающихся исследований.
Таким образом, раннее выявление пирексии, приостановка таргетной терапии и назначение НПВП позволяют лучше контролировать пирексию и способствуют снижению частоты пирексии 3–4-й степени, госпитализации из-за пирексии и, что крайне важно, снижают необходимость редукции дозы таргетных препаратов.
K.V. Orlova, PhD, L.V. Demidov, PhD, Prof.
N.N. Blokhin National Medical Research Centre of Oncology
Contact person: Kristina V. Orlova, krisman03@gmail.com
The success of modern drug therapy (targeted and immunotherapy) has significantly changed the prognosis of life of patients with melanoma. Modern approaches to therapy can significantly increase the overall survival of patients with metastatic melanoma, as well as reduce the risk of disease progression after surgical treatment in patients with high-risk skin melanoma and increase overall survival, including when used as adjuvant therapy. Targeted therapy (a combination of drugs dabrafenib and trametinib, vemurafenib and cobimetinib, encorafenib and binimetinib) in most cases is characterized by the development of reversible and mild/moderate adverse events (AE). Many AE are considered class-specific, for example, dermatological, gastrointestinal, from the organ of vision, cardiovascular and musculoskeletal. Nevertheless, a number of AE seem to be related to the drug used. Fever/pyrexia (more characteristic of dabrafenib) and photosensitization (characteristic of vemurafenib) are the most common and clinically important examples of AE that require separate consideration. In this article we will focus in detail on pyrexia.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.