Практические аспекты диагностики и лечения дегенеративных заболеваний. XV междисциплинарная конференция «Вейновские чтения». Сателлитный симпозиум компании «Эгис»
- Аннотация
- Статья
- Ссылки



Механизмы развития и терапия дегенеративных заболеваний: есть ли свет в конце тоннеля
В структуре ассоциированных с возрастом заболеваний человека, распространенность которых неуклонно растет в связи с повышением в популяции доли пожилых людей, значимое место принадлежит болезни Паркинсона. Вопросы ее диагностики и лечения остаются в центре внимания неврологов, поскольку тяжелый характер развивающихся двигательных и недвигательных симптомов предопределяет инвалидизацию и социальную дезадаптацию больных. Заместитель директора по научной работе, руководитель отдела исследований мозга Научного центра неврологии, президент Национального общества по изучению болезни Паркинсона и расстройств движения, член-корр. РАН, д.м.н., профессор Сергей Николаевич ИЛЛАРИОШКИН отметил, что на современном этапе вопросы симптоматической терапии болезни Паркинсона до конца не решены. Кроме того, недостаточно внимания уделяется постуральным нарушениям и немоторным проявлениям болезни Паркинсона, физической и социально-психологической реабилитации больных.
Препаратами первого ряда при болезни Паркинсона по-прежнему остаются леводопа и представители агонистов дофаминовых рецепторов (АДР). Сегодня на смену АДР первого поколения пришли неарголиновые АДР пролонгированного действия с более благоприятным профилем переносимости и безопасности, представителем которых является ропинирол (Синдранол®). Пролонгированные формы АДР позволили в определенной степени решить такую актуальную проблему, как приверженность пациентов к лечению, вызванную длительностью периода титрования дозы и отсутствием быстрого ощутимого эффекта. С этой точки зрения препарат Синдранол® (ропинирол пролонгированного действия), принимаемый один раз в день, положительно влияет на комплаентность больных и на ранней, и на поздней стадиях заболевания и тем самым повышает эффективность терапии болезни Паркинсона.
В настоящее время предлагаются также новые решения для пролонгирования эффекта действия препаратов леводопы и амантадинов. Проводятся исследования новых классов симптоматических противопаркинсонических (в частности, серотонинергических, аденозинергических, каннабиноидных) средств.
Оптимистичные данные по лечению болезни Паркинсона были озвучены на 22-м Международном конгрессе по болезни Паркинсона и расстройствам движения (Гонконг, 5–9 октября 2018 г.). Ученые из Израиля представили результаты открытого рандомизированного перекрестного исследования (IN‐08‐004) по применению «пилюли-гармошки» (Accordion Pill) с леводопой и карбидопой у пациентов с болезнью Паркинсона. «Пилюля-гармошка» представляет собой капсулу, содержащую многослойную биодеградируемую складчатую пленку. После проглатывания капсула растворяется, пленка-гармошка высвобождается и расправляется в желудке, задерживаясь в нем на более чем восемь часов и постоянно высвобождая стабильную дозу леводопы, которая переходит в двенадцатиперстную кишку и там всасывается. Кроме того, обсуждались возможности использования в качестве средства первой помощи мини-помпы с леводопой, благодаря которой осуществляется подкожное введение препарата до 360 или 720 мг/сут с двух точек. Участники конгресса также ознакомились с современной технологичной системой Parkinson’s KinetiGraph. Это часы со встроенным акселерометром, измеряющим активность и движения человека. Гаджет напоминает о необходимости приема очередной дозы противопаркинсонических препаратов и регистрирует факт приема этих лекарств. Группа ученых из Великобритании проанализировала опыт ношения этих часов 70 пациентами с болезнью Паркинсона в возрасте от 44 лет до 91 года в течение шести – десяти дней. В 24 (34%) случаях данные, полученные с помощью этой системы, повлияли на тактику лечения. Так, одних пациентов перевели на продвинутую терапию (апоморфин/леводопа-карбидопа интестинальный гель/глубокая стимуляция мозга). А другим пациентам, кандидатам для продвинутой терапии, наоборот, оптимизировали текущее лечение. У 12 (17%) больных оценка состояния по данным Parkinson’s KinetiGraph отличалась от результатов оценки врача после осмотра.
Проводя экспертный анализ настоящих и будущих стратегий лечения болезни Паркинсона, профессор С.Н. Иллариошкин более подробно остановился на перспективах персонализированной терапии, возможности которой сейчас изучаются в исследованиях фазы II–III.
Установлено, что основным молекулярным событием, ведущим к развитию болезни Паркинсона, становится формирование нейротоксических агрегатов небольшого пресинаптического белка альфа-синуклеина, который играет ключевую роль в выделении нейротрансмиттеров и синаптической пластичности. Клинические исследования, направленные на деградацию внеклеточного альфа-синуклеина при болезни Паркинсона, оценивают два иммунологических подхода – активную и пассивную иммунизацию. Активная иммунизация осуществляется с помощью вакцин, содержащих короткие пептиды, – гомологи альфа-синуклеина в конъюгации с носителями (AFFITOPE, AFFiRiS). Предполагается, что эти вещества, попадая в мозг, будут индуцировать формирование антител к С-концевому участку белка альфа-синуклеина. Пассивная иммунизация подразумевает введение в организм уже готовых моноклональных антител к белку альфа-синуклеину.
В настоящее время закончено исследование фазы I–II вакцины PD01A, показавшее два принципиально важных момента: индукцию антител к альфа-синуклеину при отсутствии существенных побочных эффектов и иммунологическую эффективность «бустерных» вакцинаций при общем периоде наблюдения до трех лет после начальной иммунизации1. Уже начато плацебоконтролируемое исследование фазы II (вакцина AFF03), результаты которого вызывают большой интерес. Что касается разработки моноклональных антител для пассивной иммунизации, то на текущий момент три кандидатных антитела к альфа-синуклеину достигли стадии ранних клинических исследований, включая законченное исследование фазы I для одного из препаратов (PRX002) и идущую стадию II для препарата празинезумаб (PRX002/RG7935).
Другие «антисинуклеиновые» стратегии, дошедшие до стадии клинических исследований при болезни Паркинсона, основаны на снижении продукции альфа-синуклеина и блокаде агрегации альфа-синуклеина. Снижение экспрессии альфа-синуклеина может осуществляться агонистами бета-2-адренорецепторов (кленбутеролом, салбутамолом) за счет влияния на транскрипцию ДНК. Блокаде агрегации альфа-синуклеина посвящены две индустриальные программы: малая молекула NPT200-11 и рекомбинантный белок NPT88, направленный на различные аномально агрегированные пептидные молекулы.
Совсем недавно научное сообщество узнало о новом поколении биологически активных молекул с уникальными свойствами – нанотелах. Они хорошо проникают через гематоэнцефалический барьер и клеточные мембраны, устойчивы к высоким температурам и изменениям pH, легко воспроизводимы. Кроме того, нанотела обладают особой способностью связывать активные центры ферментов, изменять межбелковые связи и конформационную структуру белков. Для лечения болезни Паркинсона разработаны два препарата на основе нанотел, способные конформационно изменять олигомеры альфа-синуклеина и предотвращать формирование фибрилл. Пока они проходят клинические испытания.
Проводятся клинические исследования при некоторых генетических формах болезни Паркинсона, в частности при носительстве мутаций GBA (частота в популяции – 7–10%). Гомозиготные мутации в гене GBA приводят к развитию известной наследственной болезни накопления – болезни Гоше. Наличие мутации гена GBA в гетерозиготном состоянии повышает риск болезни Паркинсона в 20–30 раз2. Установлено, что в мозге и ликворе у пациентов c мутацией GBA снижена активность бета-глюкоцереброзидазы3. На сегодняшний день разработан препарат GZ/SAR402671, ингибитор продукции гликосфинголипидов, который способствует экономии ресурсов бета-глюкоцереброзидазы. Препарат проходит фазу II клинических исследований.
Каждый 25-й пациент с болезнью Паркинсона является носителем мутаций гена LRRK2 (4–5% семейных и 1–2% спорадических случаев). Мутации LRRK2 повышают киназную активность белка и нарушают клеточную динамику альфа-синуклеина и тау-протеина, способствуя повышению их концентрации и агрегации. Сейчас создан консорциум по идентификации семейных и спорадических случаев носителей мутации генов LRRK2, а в 2020 г. американская компания Centogene начнет рекрутирование пациентов с носительством LRRK2 для участия в клиническом исследовании препарата.
Еще одна генетическая форма болезни Паркинсона связана с мутацией гена COQ2 в семьях с мультисистемной атрофией. Была выявлена ассоциация мультисистемной атрофии с полиморфизмами в гене COQ2 у японских пациентов, а также снижение у них эффективности митохондриального аэробного пути, активности этого фермента в лимфоцитах и уровня коэнзима Q10 в веществе мозга. В настоящее время начато клиническое исследование эффективности различных доз коэнзима Q10 именно в подгруппе пациентов с мультисистемной атрофией.
Несмотря на то что медикаментозная терапия улучшает состояние больного, заболевание неуклонно прогрессирует, и если пациент не отвечает на консервативное лечение, ему пытаются помочь с помощью хирургических методов. С 1987 г. в мире прооперировано около 400 пациентов с болезнью Паркинсона, которым проведена одно- или двусторонняя операция по имплантации фетальных мезенцефалических нейронов в стриатум. Опубликованы результаты нескольких двойных слепых исследований, включавших «ложную» хирургию, в частности европейского исследования NECTAR с участием российских центров (11 оперированных пациентов). Обобщенный опыт трансплантации фетальных мезенцефалических нейронов в клинике и эксперименте показал, что вводимые клетки:
- выживают в стриатуме реципиента (в среднем с частотой 10%);
- могут реиннервировать стриатум и формировать синаптические контакты;
- сохраняют медиаторную активность (дофамин);
- обеспечивают симптоматическое улучшение (случаи многолетнего выраженного эффекта единичны).
Проблемы, связанные с имплантацией фетальных мезенцефалических клеток, объясняются вариабельностью и непредсказуемостью клинического эффекта, его нестабильностью у большинства оперированных больных, развитием стойких дискинезий (обычно в off-периоде) с частотой 15–60% случаев, отсутствием эффекта в отношении резистентных к традиционной терапии симптомов, иммунологической несовместимостью, трудноразрешимыми морально-этическими и правовыми вопросами.
В течение последних 20 лет интенсивно изучались результаты эксперимента по введению индуцированных плюрипотентных стволовых клеток, которые выделяют из соматических клеток организма, подвергаемых репрограммированию и дедифференцировке. Сегодня основные надежды связаны с получением нейронов не из клеток эмбрионов, а из клеток кожи самого пациента.
После подтверждения функциональности трансплантированных производных индуцированных плюрипотентных стволовых клеток в рамках исследования на экспериментальных моделях настоящей сенсацией стала публикация от 9 ноября 2018 г., в которой японские ученые объявили об удачном проведении первой в мире операции по трансплантации индуцированных стволовых клеток пациенту с болезнью Паркинсона. «Это еще одно успешное звено в длинной цепочке молекулярных событий и интересных открытий в терапии болезни Паркинсона. Значит, ситуация с лечением болезни Паркинсона небезнадежна, образно говоря, есть свет в конце тоннеля», – констатировал профессор С.Н. Иллариошкин, завершая выступление.
Лечение болезни Паркинсона как технология и искусство
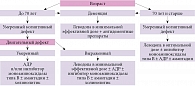
Основной задачей противопаркинсонической терапии является восстановление нарушенных двигательных функций и поддержание оптимальной мобильности пациента в течение максимально длительного времени при сведении к минимуму риска побочных явлений и долгосрочных осложнений терапии. Профессор, д.м.н. Олег Семенович ЛЕВИН (Российская медицинская академия непрерывного профессионального образования) напомнил, что с этой целью может использоваться целый ряд препаратов. Определяющими факторами при выборе стартового противопаркинсонического лечения являются возраст пациента, состояние когнитивных и двигательных функций (рис. 1). Больным в возрасте до 70 лет с умеренно выраженным двигательным дефектом и без выраженных когнитивных нарушений назначают АДР и/или ингибитор моноаминоксидазы типа B. При выраженном двигательном и/или когнитивном нарушении (в отсутствие деменции) лечение начинают с препаратов леводопы в минимальной эффективной дозе, при наличии деменции – с леводопы в комбинации с антидементными препаратами. Следование алгоритму по подбору терапии, по мнению профессора О.С. Левина, – это технология. А искусство заключается в том, чтобы, например, отличить умеренный когнитивный и двигательный дефект от выраженного, а следовательно, определить, нуждается ли пациент в приеме АДР или ингибиторов моноаминоксидазы типа В, или лечение необходимо начинать сразу с приема леводопы.
На ранней стадии болезни Паркинсона АДР способны оказывать эффект, сопоставимый с леводопой. Их применение в этот период позволяет отсрочить назначение леводопы на месяцы и годы или замедлить эскалацию ее дозы. При этом благодаря длительному действию и обеспечению тонической (квазифизиологической) стимуляции дофаминовых рецепторов АДР характеризуются низким риском развития дискинезий и флуктуаций4.
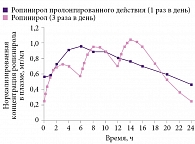
Следует отметить, что АДР пролонгированного действия, такие как Синдранол® (ропинирол), обладают дополнительными преимуществами по сравнению с традиционными формами. При приеме стандартного ропинирола (3 раза в день) концентрация препарата в крови подвержена колебаниям, а при приеме ропинирола пролонгированного действия (1 раз в день) – нет, причем скорость абсорбции активного вещества при приеме Синдранола не зависит от приема пищи5. Таким образом, высвобождение активного вещества ропинирола происходит в течение 24 часов, что обеспечивает постоянную стимуляцию дофаминовых рецепторов (рис. 2). Медленное высвобождение препарата позволяет достичь более стабильной концентрации действующего вещества в крови, что определяет лучшую переносимость лечения и эффективный контроль симптомов заболевания в течение всего дня (и в дневное, и в ночное время).
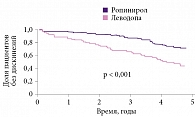
Со временем эффективность АДР снижается, что требует дополнительного назначения препаратов леводопы. Тем не менее даже в долгосрочной перспективе начало лечения с ропинирола с последующим присоединением по мере необходимости леводопы сопряжено с более низкой частотой дискинезий и флуктуаций, чем начало лечения сразу с леводопы (рис. 3)6.
На развернутой и поздней стадиях болезни Паркинсона назначение АДР позволяет ослабить моторные флуктуации (феномены «истощения» конца дозы и «включения – выключения»), уменьшить длительность периода «выключения» и выраженность связанных с ним дискинезий или корригировать их, если они уже возникли. Было показано, что ропинирол (Синдранол®) значительно превосходил плацебо в снижении времени «выключения» во время бодрствования, которое сопровождалось увеличением времени «включения» на 24-й неделе терапии (р < 0,0001)7.
Еще одно важное преимущество ропинирола пролонгированного действия (Синдранола) – повышение комплаентности. По мере развития заболевания схема лечения неизбежно усложняется за счет увеличения количества принимаемых препаратов и кратности их приема, в результате чего пациенты чаще нарушают предписания врача. В связи с этим разработка новых лекарственных форм противопаркинсонических препаратов, обеспечивающих их пролонгированное действие и однократный прием, улучшает приверженность пациентов лечению, повышая долгосрочную эффективность терапии.
Известно, что препараты АДР требуют длительного титрования дозы. Синдранол® выпускается в дозировках 2, 4 и 8 мг. По словам профессора О.С. Левина, при назначении АДР важно определить первичную и конечную целевую дозу препарата. Самая частая ошибка применения Синдранола и других препаратов ропинирола заключается в слишком низкой среднесуточной дозе, например 4 мг/сут, которая не эффективна ни на ранней, ни на поздней стадии заболевания. По мнению докладчика, титровать дозу надо до 8 мг/сут. Если эта доза не дает ожидаемого эффекта, ее увеличивают до 10–12 мг/сут, затем – до 16 мг/сут. Максимальная доза, которая составляет 24 мг/сут, неплохо переносится и позволяет компенсировать состояние больного даже с тяжелым дефектом.
В настоящее время переключение с одного АДР на другой осуществляется день в день в соответствии с эквивалентной дозой. Например, пациенту, принимавшему прамипексол в дозе 3 мг/сут, назначается ропинирол в дозе 12 мг/сут. Подобный переход обеспечивает достаточно быстрое наступление эффекта от нового препарата.
Завершая выступление, профессор О.С. Левин подчеркнул значение физической активности при болезни Паркинсона, при которой формируется мышечный дисбаланс, в частности между поясничной или подвздошно-поясничной мышцей и ягодичными мышцами. Устранение этого дисбаланса повышает выносливость и двигательную активность больных в целом.
Болезнь Альцгеймера, или Сказка о потерянном времени
Болезнь Альцгеймера, характеризующаяся постепенной утратой интеллекта, дебютирует в пожилом возрасте, постепенно прогрессирует и с течением времени приводит к полной беспомощности пациента. Как отметила к.м.н. Елена Евгеньевна ВАСЕНИНА (Российская медицинская академия непрерывного профессионального образования), в качестве наиболее вероятных причин развития болезни Альцгеймера рассматривается отложение в головном мозге бета-амилоида и тау-белка. К особенностям патогенетического процесса при болезни Альцгеймера относят:
- отложение бета-амилоида за 20 лет до появления первых клинических симптомов;
- отсутствие четкой корреляции клинической картины с отложением бета-амилоида;
- нарушение синаптической передачи первично растворимыми олигомерами;
- отложение гиперфосфорилированного тау-белка как маркера дегенеративного процесса.
Во всем мире, согласно международным рекомендациям, диагностика болезни Альцгеймера основывается на типичной клинической картине и исключении других причин деменции. Клиническая картина четко отражает поэтапное развитие патологического дегенеративного процесса, в который вовлекаются все новые и новые зоны головного мозга. Сначала поражаются структуры, отвечающие за память, – гиппокамп и височные доли, поэтому первым симптомом становится ослабление памяти, которое и в дальнейшем остается ведущим проявлением заболевания. В первую очередь страдает память на повседневные события, в силу чего больные не в состоянии вспомнить то, что произошло недавно. По мере прогрессирования дегенеративного процесса наблюдается усугубление когнитивного дефекта: появляются нарушения речи по типу акустико-мнестической афазии, зрительно-пространственные расстройства, апраксия (агнозия, акалькулия).
За счет сохранности лобной коры пациенты с болезнью Альцгеймера долго, вплоть до поздней стадии, демонстрируют поведенческие адаптационные механизмы. Они посещают магазины, поликлинику, куда их приводят желание пообщаться и сохранные поведенческие стереотипы. Выраженные аффективные и поведенческие нарушения появляются только на поздней стадии, по мере вовлечения в патологический процесс лобной доли. Тогда могут наблюдаться дисбазия, парезы, эпилептические припадки. На поздних стадиях утрачиваются ранее сохранные социальные навыки и на первое место часто выходят поведенческие и психотические нарушения, нередко развиваются бредовые расстройства (чаще всего бред ущерба и бред преследования).
В ходе диагностики важную роль играет нейропсихологическое обследование с использованием специальных шкал. По мнению Е.Е. Васениной, наиболее оптимальной и нетрудоемкой является шкала 3-КТ, которая позволяет четко определять, какие зоны мозга вовлечены в патологические процессы. Определенные структурные изменения можно увидеть и при помощи магнитно-резонансной томографии, которая позволяет выявить атрофию гиппокампа (медиабазальных височных долей), височной доли и теменной доли.
Основная цель, которую преследует фармакотерапия болезни Альцгеймера, – максимально замедлить прогрессирование заболевания. При выборе препарата для базисной лекарственной терапии руководствуются такими принципами, как доказанность и длительность эффекта, влияние на когнитивный и функциональный статус, возможность патогенетического действия. Указанным критериям соответствуют три ингибитора холинэстеразы (донепезил, ривастигмин, галантамин) и модулятор NMDA-рецепторов (мемантин).
Согласно рекомендациям, ингибиторы холинэстеразы признаны препаратами выбора для лечения болезни Альцгеймера на стадии легкой и умеренной деменции. Среди современных представителей ингибиторов холинэстеразы Е.Е. Васенина выделила донепезил (Алзепил®). Алзепил® способен не просто стабилизировать, а улучшать когнитивные функции даже в краткосрочной перспективе8. Влияние донепезила на проявление когнитивной функции оценивалось в рандомизированном плацебоконтролируемом исследовании с периодом наблюдения в шесть недель9. Был получен достоверный положительный результат по всем контрольным точкам (внимание, рабочая память). Доказано, что донепезил (Алзепил®) обладает наилучшим профилем безопасности по сравнению с остальными ингибиторами холинэстеразы (галантамином, ривастигмином)10. Поэтому препарат Алзепил® характеризуется не только достаточным клиническим эффектом, но и хорошей переносимостью.
Следует отметить, что положительное влияние ингибиторов холинэстеразы на поведенческие функции позволяет избежать применения нейролептиков у пациентов с болезнью Альцгеймера, прием которых в пожилом возрасте чреват смертельным исходом.
При болезни Альцгеймера могут развиваться аффективные нарушения (тревога, депрессия, апатия), которые резко снижают качество жизни как самих больных, так и их родственников. К сожалению, прием стимулирующих антидепрессантов может усиливать чувство тревоги у пациентов с болезнью Альцгеймера. В этой ситуации можно рекомендовать использовать препарат Спитомин® (буспирон) в минимальной дозе 5 мг с постепенной медленной титрацией. Спитомин® оказывает анксиолитическое и антидепрессивное действие, нормализуя (модулируя) работу серотонинергической и дофаминергической систем. Однако в отличие от классических анксиолитиков Спитомин® не обладает противоэпилептическим, седативным, снотворным и миорелаксирующим эффектом.
По мнению Е.Е. Васениной, в настоящее время у врачей есть все возможности для того, чтобы в случае с болезнью Альцгеймера не терять драгоценное время даром, как герои сказки о потерянном времени. Своевременно поставленный диагноз и назначенная терапия помогут обеспечить пациентам максимально полноценную жизнь.
Заключение
Ранняя диагностика и эффективное лечение таких нейродегенеративных заболеваний, как болезнь Паркинсона и болезнь Альцгеймера, могут отсрочить развитие тяжелых нарушений и существенно улучшить качество жизни пациентов и их родственников.
Препарат Синдранол® (ропинирол) – современный представитель АДР пролонгированного действия, обеспечивает непрерывную доставку активного вещества ропинирола в течение 24 часов и, следовательно, более постоянную стимуляцию дофаминовых рецепторов у пациентов с болезнью Паркинсона. Удобный режим применения препарата раз в сутки позволяет добиться более высокой приверженности к лечению. Препарат Синдранол® используется и в качестве монотерапии на ранних стадиях болезни Паркинсона, и в качестве комбинированной терапии у пациентов, получающих препараты леводопы, с целью повышения эффективности лечения, включая контроль флуктуаций и эффекта «конца дозы», а также снижения суточной дозы леводопы.
Базисная терапия с помощью ингибитора холинэстеразы донепезила (препарат Алзепил®) позволяет стабилизировать и даже улучшить когнитивные функции при болезни Альцгеймера. Обладая наилучшим профилем безопасности по сравнению с остальными ингибиторами холинэстеразы (галантамином, ривастигмином), Алзепил® демонстрирует высокую комплаентность. При развитии у пациентов с болезнью Альцгеймера тревоги, депрессии или апатии лечение препаратом Алзепил® рекомендуется дополнить приемом буспирона (препарат Спитомин®) в минимальной дозе с постепенной медленной титрацией.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.