количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Предварительные результаты открытого многоцентрового исследования эффективности и безопасности терапии левофлоксацином и тамсулозином по сравнению с терапией левофлоксацином и тамсулозином при совместном назначении Индигалплюс у мужчин с хроническим прост
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №3
- Аннотация
- Статья
- Ссылки
К сожалению, не всегда возможно определить этиологию ХП, его конкретную форму и назначить соответствующее лечение. ХП распространен у пациентов, которые, как правило, моложе 50 лет.
Заболевание может сопровождаться нарушением эректильной функции, что вызывает психологические проблемы у мужчин [9, 10]. Именно поэтому ХП, безусловно, относится к категории социально значимых заболеваний.
Авторы приводят промежуточные результаты исследования эффективности и безопасности использования Индигалплюсв комплексной терапии хронического простатита категорий II и IIIA.
Хронический простатит (ХП) остается третьим по распространенности заболеванием предстательной железы после рака и доброкачественной гиперплазии предстательной железы (ДГПЖ) [7].
К сожалению, не всегда возможно определить этиологию ХП, его конкретную форму и назначить соответствующее лечение. ХП распространен у пациентов, которые, как правило, моложе 50 лет.
Заболевание может сопровождаться нарушением эректильной функции, что вызывает психологические проблемы у мужчин [9, 10]. Именно поэтому ХП, безусловно, относится к категории социально значимых заболеваний.
Авторы приводят промежуточные результаты исследования эффективности и безопасности использования Индигалплюсв комплексной терапии хронического простатита категорий II и IIIA.
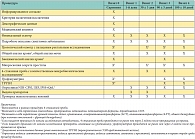
Таблица 1. Расписание процедур исследования

Таблица 2. Данные урофлоуметрии (распространенность признаков)

Таблица 3. Значимость отличий между группами на Визитах 3 и 4 (односторонний критерий Стьюдента)
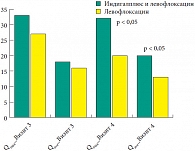
Рис. 1. Значения уродинамических показателей Qmax и Qave (мл/c)
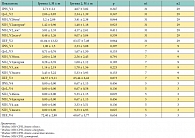
Таблица 4. Значимость отличий между группами на Визитах 2, 3 и 4 (критерий Манна – Уитни)

Таблица 5. Значимость отличий между группами на Визитах 1–4 (критерий Стьюдента)
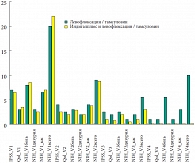
Рис. 2. Индексы IPSS, QoL и NIH-CPSI на Визитах 1–4
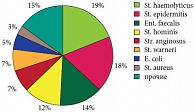
Рис. 3. Результаты микробиологического исследования секрета простаты пациентов с ХП II категории до начала лечения

Таблица 6. Частота эрадикации первоначального возбудителя и реинфекции и значимость их отличий в группах 1 и 2 (критерий χ2)
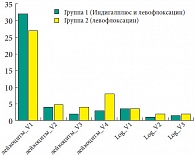
Рис. 4. Число лейкоцитов (шт. в поле зрения) и уровень бактериальной обсемененности (log10(КОЕ/мл)) в секрете простаты
В состав препарата Индигалплюс («МираксБиоФарма») входят три действующих компонента: индол-3-карбинол (I3C), эпигаллокатехин-3-галлат (EGCG) и экстракт плодов пальмы Serenoa repens. Противовоспалительная активность является одним из основных механизмов действия препарата Индигалплюс. В ее основе лежит способность ЕGCG блокировать цитокин-зависимые пути стимуляции воспалительного процесса.
При проведении внутриклеточных TNF-α-индуцированных сигналов ключевую роль играет ядерный фактор NF-kB, активирующий транскрипцию множества генов, ответственных за клеточную выживаемость, канцерогенез и воспалительные функции. В многочисленную группу генов, экспрессия которых повышается в результате активации данного каскада, входит ген, кодирующий циклооксигеназу-2 (COX-2) – фермент, участвующий в биосинтезе простагландинов (PG) PGE2 и PGF2α – основных медиаторов воспаления. На эпителиальных опухолевых клетках различного происхождения удалось показать, что EGCG в физиологических концентрациях эффективно ингибирует экспрессию COX-2. [2, 4].
Помимо этого имеются данные, свидетельствующие о том, что EGCG напрямую ингибирует TNF-α-индуцируемую активацию ядерного фактора транскрипции NF-kB, который, как мы отмечали выше, является конечным эффектором сигнальных путей, индуцируемых провоспалительными цитокинами [3, 12], в частности медиатором доиммунного воспаления IL-1 [13]. С момента открытия и по настоящее время полифенолы зеленого чая и EGCG, как самый активный из них, позиционировались в первую очередь как сильнейшие антиоксидантные соединения. Как антиоксидант, EGCG в 100 раз более эффективен, чем витамин С, и в 25 раз более эффективен, чем витамин Е (?-токоферол). Антиоксидантная природа катехинов обусловлена наличием в их составе гидроксильных групп, превращающих данные соединения в молекулярные «ловушки» свободных радикалов. Именно благодаря этому свойству EGCG стал рассматриваться как биологически активное вещество.
Основной продукт метаболизма второй составляющей препарата Индигалплюс (I3C) – 3,3’-дииндолилметан (DIM) – обладает способностью активировать интерферон-зависимую сигнальную систему. Установлено, что DIM повышает экспрессию не только рецепторов IFN-α, но и самого IFN-α [14], а также ряда IFN-α-респонсивных генов. В том же исследовании показано, что DIM и IFN-α аддитивно ингибируют клеточную пролиферацию и синергично повышают уровень экспрессии белков главного комплекса гистосовместимости I класса (MHC-I), что увеличивает уровень экспрессии мРНК MHCI-ассоциированных регуляторных белков. DIM также способен подавлять MDR-1 – трансмембранный белок-транспортер, обеспечивающий множественную лекарственную устойчивость, в том числе и в отношении азитромицина и доксициклина [8].
Третий компонент препарата Индигалплюс – экстракт плодов пальмы Serenoa repens – уже много лет применяется в урологической практике. Экстракт плодов пальмы Serenoa repens обладает противовоспалительным и противоотечным действием и традиционно используется в составе комплексной терапии хронического простатита. Главный механизм действия заключается в ингибировании синтеза простагландинов, что приводит к снижению проницаемости сосудов предстательной железы [5]. Его комбинация с индол-3-карбинолом и EGCG может обеспечивать синергическое действие при хроническом простатите, в первую очередь противовоспалительное.
Материалы и методы
Многоцентровое рандомизированное открытое сравнительное исследование со стратификацией по протоколу Ипл-Уро-162 начато в 2010 году в 5 клинических центрах. Набор пациентов страты ХП II типа завершен в апреле 2011 года. Задачами исследования были:
Пациенты были разделены согласно компьютерному листу рандомизации в следующие группы наблюдения:
Критерии включения:
- сравнить показатели уродинамики (Qmax, Qave, Vres) у пациентов с хроническим простатитом категорий II и IIIA, получающих тамсулозин и левофлоксацин в комбинации с Индигалплюс, в сравнении с применением тамсулозина и левофлоксацина;
- сравнить изменение объема предстательной железы у пациентов с хроническим простатитом категорий II и IIIA, получающих тамсулозин и левофлоксацин в комбинации с Индигалплюс, в сравнении с применением тамсулозина и левофлоксацина;
- сравнить сроки наступления и полноту бактериологической санации секрета простаты у пациентов с хроническим простатитом категории II, получающих левофлоксацин в комбинации с Индигалплюс, в сравнении с применением левофлоксацина;
- сравнить качество жизни, состояние сексуальной функции и интенсивность обструктивной и ирритативной симптоматики (по данным опросников IPSS, NIH-CPSI и IIEF) у пациентов с хроническим простатитом категорий II и IIIA, получающих тамсулозин и левофлоксацин в комбинации с Индигалплюс, в сравнении с применением тамсулозина и левофлоксацина.
- страта 1 – хронический простатит категории II – 60 человек;
- страта 2 – хронический простатит категории IIIA – 60 человек.
Пациенты были разделены согласно компьютерному листу рандомизации в следующие группы наблюдения:
- группа 1 – хронический простатит категории II – прием левофлоксацина по 500 мг 1 раз в сутки перорально 1 месяц и прием Индигалплюс по 670 мг (2 капсулы) 2 раза в сутки перорально 3 месяца (30 пациентов);
- группа 2 – хронический простатит категории II – прием левофлоксацина по 500 мг 1 раз в сутки перорально 1 месяц (30 пациентов);
- группа 3 – хронический простатит категории IIIA – прием тамсулозина по 0,4 мг 1 раз в сутки перорально и прием Индигалплюс по 670 мг (2 капсулы) 2 раза в сутки перорально 3 месяца (30 пациентов);
- группа 4 – хронический простатит категории IIIA – прием тамсулозина по 0,4 мг 1 раз в сутки перорально 3 месяца (30 пациентов).
Критерии включения:
- Наличие письменного информированного согласия об участии в данном исследовании.
- Возраст 18–60 лет.
- Установлен диагноз хронического простатита категории II или IIIA, верифицированный 4-стаканной пробой.
- Объем остаточной мочи (Vres) – менее 150 мл.
- Отсутствие служебной или иной зависимости от лиц, имеющих отношение к проведению исследования и заинтересованных в его результатах.
- Установлен диагноз рака предстательной железы либо обнаружены иные злокачественные новообразования.
- По данным урофлоуметрии во время скрининга максимальная объемная скорость тока мочи менее 5 мл/с.
- В последние 2 недели перед исследованием проводилась терапия гиперплазии предстательной железы или хронического простатита.
- Острая задержка мочеиспускания.
- Наличие конкрементов в мочевом пузыре.
- Стриктура уретры, склероз шейки мочевого пузыря.
- Наличие в анамнезе оперативных пособий на органах малого таза.
- Инфекции мочеполовой системы в фазе активного воспаления.
- Тяжелые сопутствующие заболевания сердечно-сосудистой и неврологической систем, психиатрические заболевания, клинически значимая почечная и печеночная недостаточность (увеличение показателей в два и более раз) либо иные тяжелые заболевания, которые, по мнению исследователя, делают невозможным участие пациента в исследовании.
- В течение 3 месяцев перед включением в исследование пациент получал терапию в рамках любого другого клинического исследования.
Результаты
В исследование были включены 75 пациентов. На момент проведения промежуточного анализа завершили его полностью в соответствии с протоколом 8 пациентов, еще 1 пациент выбыл преждевременно. Проанализированы данные 47 пациентов страты ХП II категории, завершивших Визит 2 (1 месяц), в том числе 39 – завершивших Визит 3 (3 месяца), а также 5 пациентов страты ХП IIIA категории, завершивших Визит 2 (эти пациенты были включены только в анализ данных вопросников). Рандомизация пациентов, включенных в страту ХП II категории, была проведена в соответствии с листом рандомизации: 23 пациента в группу 1 (Индигалплюс и левофлоксацин) и 24 пациента – в группу 2 (левофлоксацин). Статистически значимых отличий в исходных данных пациентов обнаружено не было, за исключением возраста, который был в среднем на 5 лет больше в группе 1. Таким образом, рандомизацию можно признать проведенной адекватно. Данные о случаях положительного ответа на лечение (увеличение максимальной/средней скорости потока (Qmax/Qave) по данным урофлоуметрии более чем на 20%) представлены в таблице 2. Очевидная тенденция к большей частоте положительного ответа на лечение в группе 1 на данном количестве пациентов еще не достигает статистической значимости. Значимые отличия выявлены по средним показателям Qmax, Qave и объема мочеиспускания (Vcomp) на Визите 4, которые оказались значительно выше в группе 1. Такая тенденция стала заметной уже на Визите 3, хотя и не достигла статистической значимости (табл. 3). Общие данные Qmax, Qave по группам 1 (Индигалплюс и левофлоксацин, n = 6) и 2 (левофлоксацин, n = 8) на Визитах 3–4 представлены на рисунке 1.
Данные о различиях в субъективных показателях (шкала оценки простатических симптомов – IPSS, индексы качества жизни – QoL и NIH-CPSI) были рассмотрены как при продольном (между Визитом 1 и Визитом 3), так и при поперечном сравнении (между группами). В группе 2 при продольном сравнении отсутствовали различия в индексе IPSS, QoL и домене «дизурия» индекса NIHCPSI. При этом в группе 1 все эти отличия были статистически значимы. В обеих группах отсутствовали значимые отличия в международном индексе эректильной дисфункции – IIEF. Данные о межгрупповых отличиях на Визитах 2, 3 и 4 приведены в таблице 4. Значимые отличия были обнаружены на Визите 4 в величине индекса NIH-CPSI (в целом и по домену «боль»). Общие данные индексов IPSS, QoL и NIH-CPSI на Визитах 1–4 представлены на рисунке 2. Данные об этиологической структуре бактериального простатита представлены на рисунке 3.
Наиболее часто в составе бактериальной флоры, высеваемой из секрета простаты, обнаруживался St. haemolyticus (19%), далее по частоте следовали St. epidermidis (18%) и Ent. faecalis (14%). Таким образом, подавляющее большинство составляли грамположительные микроорганизмы. Моноинфекция наблюдалась у 54% пациентов, в остальных случаях были обнаружены бактериальные ассоциации из 2-4 возбудителей. Данные о межгрупповых отличиях (объем предстательной железы, количество лейкоцитов в секрете простаты и бактериологические показатели) на Визитах 1–4 приведены в таблице 5. Значимые отличия были обнаружены в уровне бактериальной обсемененности секрета простаты на Визите 3.
Отмечена также тенденция к снижению числа лейкоцитов в секрете простаты в группе 1 по сравнению с группой 2 на Визитах 2–4 (рис. 4). Данные по частоте микробиологической санации секрета простаты (от первоначального возбудителя), а также частоты реинфекции (повторного выявления инфекции, но уже иным возбудителем) в группах 1 и 2 и значимости отличий между ними представлены в таблице 6. В большинстве случаев курс терапии позволил достичь эрадикации первоначально высеваемого микроорганизма. Тем не менее к Визиту 3 (то есть через 2 месяца после окончания антибиотикотерапии) у многих пациентов было отмечено выявление в секрете простате новых микроорганизмов (не высевавшихся до лечения).
Среди данных пациентов, как и у больных с персистенцией первоначального возбудителя, также отмечались худшие показатели индексов симптомов NIH-CPSI и IPSS (3,3 и 1,1 против 4,0 и 3,5 соответственно) (рис. 5). В группе 1 отмечена тенденция к снижению частоты персистенции первоначального возбудителя ХП и частоты выявления новых возбудителей, не достигшая на данном числе больных уровня статистической значимости. В ходе исследования нежелательных явлений в обеих группах у пациентов, включенных в промежуточный анализ, зарегистрировано не было.
Выводы
Включение Индигалплюс в состав стандартной терапии хронического простатита приводит к улучшению уродинамических показателей у пациентов и отдаленных результатов лечения: снижаются индекс NIH-CPSI, бактериальная обсемененность и содержание лейкоцитов в секрете простаты. В группе больных, применявших Индигалплюс в комбинации со стандартной терапией, также отмечена тенденция к снижению частоты персистенции первоначального возбудителя ХП и частоты выявления новых возбудителей, не достигшая уровня статистической значимости у данного числа пациентов. Индигалплюс является безопасным средством в лечении ХП, поскольку в ходе применения препарата побочных эффектов зарегистрировано не было.
1. Herbein G., O’brien W.A. Tumor necrosis factor (TNF)-α and TNF receptors in viral pathogenesis // Proc. Soc. Exp. Biol. Med. 2000. Vol. 223. Р. 241–257.
2. Hong J., Smith T.J., Ho C.T. et al. Effects of purified green and black tea polyphenols on cyclooxygenase- and lipoxygenase-dependent metabolism of arachidonic acid in human colon mucosa and colon tumor tissues // Biochem. Pharmacol. 2001. Vol. 62 (9). Р. 1175–1183.
3. Jeong W.S., Kim I.W., Hu R., Kong A.N. Modulatory properties of various natural chemopreventive agents on the activation of NF-kappaB signaling pathway // Pharm. Res. 2004. Vol. 21 (4). Р. 661–670.
4. Kundu J.K., Na H.K., Chun K.S. et al. Inhibition of phorbol ester-induced COX-2 expression by epigallocatechin gallate in mouse skin and cultured human mammary epithelial cells // J. Nutr. 2003. Vol. 133 (11 Supl. 1). Р. 3805S–3810S.
5. Lowe F.C., Fagelman E. Phytotherapy for Chronic Prostatitis // Current Urology Reports. 2000. Vol. I. Р. 164–166.
6. Riby J.E., Xue L., Chatterji U. et al. Activation and potentiation of interferon-gamma signaling by 3,3’-diindolylmethane in MCF-7 breast cancer cells // Mol. Pharmacol. 2006. Vol. 69 (2). Р. 430–439.
7. Roberts R.O., Lieber M.M., Bostwick D.G. et al. A review of clinical and pathological prostatitis syndromes // Urology. 1997. Vol. 49. Р. 809–821.
8. Shima K., Szaszák M., Solbach W. et al. Impact of a low oxygen environment on the efficacy of antimicrobials against intracellular Chlamydia trachomatis // Antimicrob Agents Chemother. 2011. Feb 14. [Epub ahead of print.]
9. Stamey T.A. Pathogenesis and treatment of Urinary Tract Infections. Baltimore: Williams and Wilckins, 1980. Р. 342–429.
10. Stewart C. Prostatitis // Emerg. Med. Clin. North. Am. 1988. Vol. 6. Р. 391–402.
11. Tartaglia L.A., Weber R.F., Figari I.S. et al. The two different receptors for tumor necrosis factor mediate distinct cellular responses // Proc. Natl. Acad. Sci. USA. 1991. Vol. 88. Р. 9292–9296.
12. Vayalil P.K., Katiyar S.K. Treatment of epigallocatechin-3-gallate inhibits matrix metalloproteinases-2 and -9 via inhibition of activation of mitogen-activated protein kinases, c-jun and NF-kappaB in human prostate carcinoma DU-145 cells // Prostate. 2004. Vol. 59 (1). Р. 33–42.
13. Wheeler D.S., Catravas J.D., Odoms K. et al. Epigallocatechin-3-gallate, a green tea-derived polyphenol, inhibits IL-1-beta-dependent proinflammatory signal transduction in cultured respiratory epithelial cells // J. Nutr. 2004. Vol. 134 (5). Р. 1039–1044.
14. Xue L., Firestone G.L., Bjeldanes L.F. DIM stimulates IFN-gamma gene expression in human breast cancer cells via the specific activation of JNK and p38 pathways // Oncogene. 2005. Vol. 24. Р. 2343–2353.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.