Применение гиалуроновой кислоты (препарата УРО-ГИАЛ) после трансуретральных эндоскопических операций по поводу доброкачественной гиперплазии простаты
- Аннотация
- Статья
- Ссылки
Введение
Вследствие старения населения изменяются уровень и структура заболеваемости. По данным зарубежных исследователей, на долю доброкачественной гиперплазии предстательной железы (ДГПЖ) приходится более 40% от числа всех урологических заболеваний у мужчин старше 50 лет [1, 2]. Основным (65–70%) методом лечения ДГПЖ является хирургический. Стандартом оперативного лечения ДГПЖ признается трансуретральная резекция (ТУР). Согласно данным Европейской ассоциации урологов, на долю ТУР простаты в настоящее время приходится примерно 95% всех операций, выполняемых у больных ДГПЖ [3].
ТУР предстательной железы имеет целый ряд осложнений (интраоперационные, ранние и поздние послеоперационные), которые выявляются в 20–67% случаев [4–8]. Наиболее частым (10–20%) осложнением позднего послеоперационного периода является сохранение ирритативной симптоматики [4, 5, 9, 10]. Среди основных причин ирритативных расстройств мочеиспускания выделяют системное нарушение микроциркуляции и обострение воспалительного процесса в предстательной железе после хирургического вмешательства. Это в дальнейшем ведет к развитию патологического рубцового процесса в шейке мочевого пузыря – склероза шейки мочевого пузыря. Для профилактики и лечения этих осложнений, кроме стандартной антибиотикотерапии в послеоперационном периоде, рекомендуется использовать альфа-адреноблокаторы [11], биостимулирующий препарат Витапрост в форме ректальных свечей [12], препараты, улучшающие трофику и микроциркуляцию тканей [13].
По нашему мнению, дизурические явления в послеоперационном периоде обусловлены также наличием раневой эпителизирующейся поверхности в области ложа аденомы. При выполнении ТУР простаты используются два электрохирургических режима работы – резание и коагуляция. Раневая поверхность после электрорезекции остается покрытой термально поврежденным слоем тканей. Другими словами, в шейке мочевого пузыря, ложе аденомы, простатическом отделе уретры образуется ожоговая поверхность. Течение послеоперационного раневого процесса в ложе аденомы аналогично заживлению инфицированной ожоговой раны в условиях механического, химического и биологического воздействия на рану инфицированной мочи. В процессе заживления раны поврежденные ткани в виде струпа отторгаются, на их место со стороны слизистой мочевого пузыря и уретры нарастает уротелий. Сроки очищения раневой поверхности и покрытия ее уротелием, по данным литературы, варьируют от 1–3 [14] до 6–18 месяцев [15]. Выделяют три стадии процесса заживления ран [16]:
1) фаза воспаления, которая состоит из периода сосудистых изменений и периода очищения раны от некротических тканей;
2) фаза регенерации, образования и созревания грануляционной ткани;
3) фаза дифференцировки и эпителизации.
Сущность фазы регенерации заключается в заполнении раневого дефекта вновь образующейся грануляционной тканью. Отличительной особенностью грануляционной ткани является интенсивное образование сложных полисахаридов – гликозаминогликанов. Источником образования гликозаминогликанов в соединительной ткани являются в основном фибробласты. Фибробласты образуются из недифференцированных мезенхимальных клеток, находящихся в тканях раневой поверхности, и из гематогенных элементов (лимфоциты и моноциты) раневого инфильтрата. Фибробласты синтезируют мукополисахариды – гиалуроновую кислоту и хондроитинсульфат, основное функциональное значение которых в процессе заживления раны заключается в организации фиброзной сети, контроле темпа биосинтеза коллагена и стабилизации коллагеновых волокон. Процесс заживления находится в прямой зависимости от способности тканей в области раны синтезировать мукополисахариды. Мукополисахариды расходуются в процессе коллагенообразования, содержание их уменьшается по мере формирования коллагеновых волокон. В этой связи местное применение препаратов гиалуроновой кислоты патогенетически обосновано и позволит ускорить регенерацию, заживление и эпителизацию тканей.
Известно также, что переходный эпителий мочевого пузыря (уротелий) вырабатывает и выделяет на поверхность клеток мукополисахаридную субстанцию (гликозаминогликаны), которая образует тонкий защитный слой, препятствующий проникновению в стенку мочевого пузыря воды, различных повреждающих факторов мочи и бактерий [17]. Он не позволяет патогенным бактериям прикрепляться к уротелиальным клеткам, обволакивает попавшие в мочевой пузырь микроорганизмы и способствует их элиминации при мочеиспускании.
Оперативное вмешательство, воспалительные изменения в мочевом пузыре и ложе аденомы, а также гормональный дисбаланс у мужчин пожилого возраста нарушают защитный слой уротелия. Применение препаратов гиалуроновой кислоты и в этом случае будет патогенетически обосновано, поскольку даст возможность восстановиться защитному слою стенки мочевого пузыря и уретры. Возникающий вязкоэластический протектор, или буфер, между уротелием и просветом мочевого пузыря будет способствовать уменьшению раздражающего действия мочи и ее компонентов на послеоперационную раневую поверхность и устранению дизурических явлений.
Таким образом, применение гиалуроновой кислоты в послеоперационном периоде после ТУР простаты по поводу ДГПЖ, во-первых, ускоряет процессы созревания соединительной ткани и эпителизации ложа аденомы, а во-вторых, восстанавливает разрушенный гликозаминогликановый слой шейки мочевого пузыря и простатического отдела уретры. В результате этого уменьшается выраженность дизурических явлений и, вероятно, снижается риск развития поздних послеоперационных осложнений, таких как склероз шейки мочевого пузыря, стриктура уретры, недержание мочи.
Материалы и методы
В настоящее время на российском фармацевтическом рынке зарегистрирован препарат гиалуроновой кислоты УРО-ГИАЛ, разработанный компанией МКС Laboratories. УРО-ГИАЛ – стерильный, апирогенный, прозрачный, упруговязкий буферизованный физиологический раствор гиалуроната натрия неживотного происхождения. УРО-ГИАЛ применяется в урологии для лечения хронического рецидивирующего и интерстициального цистита, лучевого цистита, синдрома болезненного мочевого пузыря [18–20]. Влияние гиалуроновой кислоты в послеоперационном периоде на процессы эпителизации и заживления ложа аденомы, уменьшения дизурических явлений, снижения послеоперационных осложнений не изучалось, что и послужило поводом к проведению нашего исследования.
Мы располагаем опытом лечения 35 больных, которым в послеоперационном периоде после выполнения трансуретральных эндоскопических операций по поводу ДГПЖ производилось внутрипузырное введение УРО-ГИАЛА. Вид оперативного вмешательства зависел от объема предстательной железы. При объеме простаты до 80 см³ выполнялась биполярная ТУР простаты, а при объеме простаты более 80 см³ – трансуретральная энуклеация простаты биполярной петлей (ТУЭБ). В нашем исследовании ТУР простаты была выполнена у 17 больных с объемом простаты от 54 до 70 см³, в среднем 62,2 см³ (1-я группа), ТУЭБ простаты произведена 18 больным с объемом простаты от 80 до 160 см³, в среднем 114,7 см³ (2-я группа). В 1-й группе больных 5 пациентам помимо ТУР простаты выполнялась цистолитотрипсия по поводу камней в мочевом пузыре, у 4 пациентов предварительно была установлена цистостома по поводу острой задержки мочеиспускания, 13 пациентов имели объем остаточной мочи от 10 до 274 мл (в среднем 106,4 мл). Во 2-й группе больных (ТУЭБ простаты) 2 пациентам была наложена цистостома, 3 пациентам с камнями в мочевом пузыре одновременно проводилась цистолитотрипсия, 6 пациентов имели объем остаточной мочи от 15 до 358 мл
(в среднем 149,5 мл).
Каждому больному в послеоперационном периоде было выполнено 6 инстилляций гиалуроновой кислоты (препарат УРО-ГИАЛ). Первые две инстилляции выполнялись в дозе 20 мг (25 мл) на 2–3-и и 4–5-е сутки после операции, когда больной еще находился в стационаре. В дальнейшем инстилляции УРО-ГИАЛА проводились амбулаторно 1 раз в неделю в течение 4 недель в дозе 40 мг (50 мл). Время экспозиции препарата в мочевом пузыре составляло 1,5–2 часа. Эффективность лечения оценивалась путем проведения комплексного урологического обследования, включающего в себя физикальные, лабораторные, ультразвуковые, эндоскопические, уродинамические, морфологические методы обследования, а также анкетирование (по Международной шкале суммарной оценки симптомов при заболеваниях предстательной железы (International Prostate Symptom Score, IPSS) и шкале оценки качества жизни (Quality of Life, QoL)) через 1, 3, 6, 12 месяцев после операции. В качестве группы сравнения выступили больные, не получавшие в послеоперационном периоде инстилляции гиалуроновой кислоты.
Результаты
Переносимость препарата была хорошей, ни один больной не отказался от проводимого лечения. После удаления уретрального катетера (3–5-е сутки) и восстановления самостоятельного мочеиспускания дизурические явления были минимальными. Из осложнений следует отметить возникновение острого эпидидимита у одного больного при введении препарата на амбулаторном этапе в конце курса лечения, которое было купировано традиционными методами антибактериальной и противовоспалительной терапии. Сроки наблюдения за 35 больными в настоящее время составляют 3–6 месяцев, каких-либо других поздних осложнений пока отмечено не было.
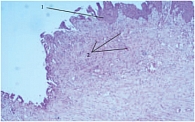
После окончания курса введения УРО-ГИАЛА (через 6 недель после операции) 13 больным (6 пациентам из 1-й группы и 7 пациентам из 2-й группы) была выполнена цистоскопия и ТУР-биопсия участков из ложа аденомы. У всех больных наблюдалась полная эпителизация поверхности, переходный эпителий покрывал поверхность взятого фрагмента ложа аденомы, в строме определялись участки неоангиогенеза с большим количеством тесно расположенных мелких сосудов (рис. 1).
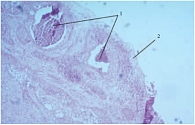
В то же время была изучена эпителизация ложа аденомы у 8 больных, которым не проводилось введение УРО-ГИАЛА в послеоперационном периоде. Им также была выполнена цистоскопия с ТУР-биопсией в разные сроки после операции: через 1,5 (n = 4), через 2 (n = 3) и через 3 месяца (n = 1). Гистологически полная эпителизация не была выявлена ни в одном случае. Поверхность фрагментов (биоптатов) была представлена грануляционной тканью, иногда с массивными некрозами и лимфолейкоцитарной инфильтрацией, реорганизацией эпителиального пласта с формированием гнезд Брунна. Признаков эпителизации не было (рис. 2).
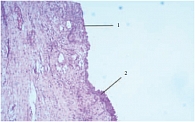
Одному пациенту из группы сравнения была выполнена биполярная ТУР простаты. Гистологически была выявлена аденокарцинома. Через 4 месяца после ТУР пациент перенес радикальную простатэктомию. Гистологически полностью изучена вся пузырная часть ложа аденомы. Эпителизация представлена многослойным плоским эпителием и, частично, атрофичным уротелием на 90% пузырной поверхности исследуемого образца (рис. 3).
Выводы
Применение гиалуроновой кислоты (препарат УРО-ГИАЛ) значительно ускоряет процессы эпителизации ложа аденомы в послеоперационном периоде. По нашим данным, полная эпителизация ложа аденомы происходит не ранее чем через 4 месяца после эндоскопических операций по поводу ДГПЖ. Внутрипузырное введение УРО-ГИАЛА в послеоперационном периоде позволяет сократить сроки эпителизации ложа аденомы до 1,5 месяцев. Быстрая эпителизация ложа аденомы, восстановление гликозаминогликанового слоя шейки мочевого пузыря и простатического отдела уретры приводят к снижению частоты и выраженности дизурических явлений, ирритативной симптоматики и в конечном итоге способствуют уменьшению риска поздних послеоперационных осложнений. Хорошие результаты достигнуты и при осложненном течении ДГПЖ (камни в мочевом пузыре, острая задержка мочеиспускания, цистостома). В указанных случаях уже в предоперационном периоде нижние мочевыводящие пути инфицированы, высока вероятность развития послеоперационных осложнений (геморрагических, инфекционно-воспалительных, склеротических). Следовательно, таким пациентам особенно показано введение УРО-ГИАЛА в послеоперационном периоде с целью снижения риска развития осложнений.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.