Проблема наличия полимикробной флоры и полипрагмазии в терапии воспалительных заболеваний половых органов
- Аннотация
- Статья
- Ссылки
Как правило, наличие тяжелых форм ВЗОМТ ассоциируется с наличием ИППП и полимикробной флоры. Отмечено, что на протяжении последних лет (2002-2006 гг.) в РФ, по данным официальной статистики, показатели заболеваемости гонококковой инфекцией снизились на 32,6%, трихомониазом – на 29,7%, урогенитальным хламидиозом – на 9,5% (II Всероссийский конгресс дерматовенерологов, 2007). При этом в последние годы произошло и относительное сокращение тяжелых форм ВЗОМТ, тогда как количество случаев амбулаторного лечения больных, страдающих легкими и умеренными формами гинекологических инфекций, возросло. Однако необходимо учитывать, что данные о заболеваемости ИППП далеки от реальной картины, так как основываются главным образом на муниципальных источниках без учета коммерческих медицинских организаций, обследующих значительное число пациентов. Кроме того, провести количественную оценку заболеваемости ВЗОМТ затруднительно в связи с тем, что во многих странах статистическая информация базируется в основном на данных, полученных из стационаров, в то время как многие пациентки лечатся амбулаторно.
Тем не менее известно, в частности, что за 10 лет число женщин в возрасте 20-24 лет с диагнозом ВЗОМТ увеличилось в 1,5 раза и с тех пор существенного снижения заболеваемости отмечено не было, возрастает число случаев, резистентных к антибиотикам, наибольший риск заболеваемости отмечается в возрастной группе 16-19 лет, при этом хронические ВЗОМТ встречаются чаще, чем острые, у более старших пациенток.
В Швеции профилактика инфекций, передаваемых половым путем, привела к тому, что эндемичная гонококковая инфекция в этой стране практически не встречается, а заболеваемость, связанная с С. trachomatis, снизилась более чем в 4 раза, что привело к существенному снижению распространенности ВЗОМТ.
Однако некоторые исследователи считают, что снижение заболеваемости ВЗОМТ в индустриально развитых странах является следствием большего распространения малосимптомных форм заболевания.
В последнее время, по мнению различных авторов, из патогенных микроорганизмов, вызывающих гинекологические инфекции, все чаще стали выделять грамотрицательные и анаэробные микроорганизмы, при этом количество случаев полимикробной флоры увеличивается.
По нашим данным, за период с 2006 по 2009 г., при обследовании больных с воспалительными заболеваниями половых органов в условиях гинекологического отделения (стационар и амбулаторный прием), выявлен абсолютный лидер по частоте встречаемости как в виде моноинфекции, так и в ассоциации с другими микроорганизмами, в том числе ИППП. Так, E. coli обнаружены в 65,7% случаев ВЗПО.
Нами также выявлено присутствие C. trachomatis в 19,7%; Trichomonas vaginalis – 11,02%; N. gonorrhoeae – 9,43%; U. раrvum в 27%; U. urealyticum – 45,8%; M. genitalium – в 20%; M. hominis – в 18, 21%; Gardnerella vaginalis – 25,06%; Streptococcus spp. – в 23%; Enterococcus faecalis – 33,1%; Staphylococcus spp. – 11,8%; различные анаэробы в 28,3%.
Другие авторы обратили также внимание на то, что за последние два года в культуре влагалищного отделяемого больных ВЗПО увеличилась частота встречаемости Klebsiella pneumoniae. При тщательном обследовании таких больных выявлены иммунодефицитные состояния различной этилогии. Но даже при тщательном обследовании больных в 20% случаев ВЗОМТ выявить возбудителя не представляется возможным.
По данным некоторых авторов, смешанные инфекции или инфекции, развившиеся на фоне выраженного дисбаланса микробиоценоза влагалища, этиологически cвязанные с условно патогенной микрофлорой, наблюдаются в 20-60% случаев клинически выраженных генитальных инфекций. Известно, что 50% нарушений состава микробиоценоза влагалища протекает без клинических проявлений, а влияние бессимптомных форм заболевания на репродуктивное здоровье женщин становится едва ли не более значимым, чем при наличии жалоб, так как они остаются невыявленными и, следовательно, без лечения. Таким образом, оценка роли условно патогенной микрофлоры в развитии, особенностях течения ВЗПО приобретает особенно важную роль, и одним из актуальных направлений в этой связи является изучение урогенитальных микоплазм.
В настоящее время M. genitalium считают абсолютным патогеном, который обусловливает патологические состояния, приводящие к нарушению репродуктивной функции как у женщин, так и у мужчин, что подтверждено множеством научных работ и явилось предметом обсуждения на рабочем совещании специалистов различных отраслей медицины в Черногории в июне 2006 г. В 2008 г. на международном съезде акушеров-гинекологов уреаплазменная инфекция при беременности была названа одной из возможных весомых причин, приводящих к прерыванию беременности.
По мнению Ken B. Waites, Brenda Katz and Robert L. Schelonka, три микроорганизма из рода микоплазм являются несомненными патогенами: M. pneumoniae, M. genitalium и M. hominis. В настоящее время известно более 180 видов микоплазм. Человек является хозяином по крайней мере 14 видов микоплазм: M. buccale, M. faucium, M. fermentans, M. genitalium, M. lipophilum, M. orale, M. hominis, M. salivanura, M. penetrans, M. pirum, M. pneumoniae, M. spermatofilium, U. urealyticum, Acholeplasma laidlavii. Большинство из них – факультативные анаэробы.
По данным литературы, за последние пять лет частота выявления урогенитальных микоплазм при патологии урогенитального тракта женщин составляет: при патологии шейки матки – 25-37%, вагинитах – 35-48%, хронических воспалительных заболеваниях органов малого таза – 45-64%, бесплодии – 47-65%, циститах – 40-75%, эндометриозе – 45-86%. Частота выявления урогенитальных микоплазм в цервикальном канале у практически здоровых женщин составляет 13-18%.
Несколькими исследованиями (2006-2008) установлено, что частота неоплазий шейки матки у женщин, инфицированных уреаплазмами и ВПЧ, достоверно выше, чем у женщин, инфицированных только ВПЧ, таким образом, возможно предположить, что уреаплазмы являются возможным триггером развития LSIL (Low-Grade Squamous Intraepitelial Lesions) с последующим увеличением риска развития цервикального рака.
Урогенитальные микоплазмы при неосложненном течении беременности выявляются у 13-15% беременных, при осложненном течении гестационного процесса эта частота составляет: неразвивающаяся беременность – 35-56%, привычное невынашивание – 35-68%, угрожающий выкидыш – 46-60%, плацентарная недостаточность – 66-78%, угрожающие преждевременные роды – 33-39%, гестоз – 24-49%, преждевременное излитие вод – 24-48%, гестационный пиелонефрит – 19-28%, послеродовый эндометрит – 22-27%, внутриутробное инфицирование – 17-32%, мертворождение – 45-58%, врожденные пороки развития плода – 42-67%, врожденная пневмония – 30-35%. Частота врожденных пороков в группе мертворожденных и умерших новорожденных, инфицированных микоплазмами, составляет около 50%, что в 3 раза чаще, чем в группе неинфицированных детей.
По данным американских и японских авторов (2007, 2008), U. urealyticum и M. hominis обнаруживались в 23% случаев в пуповинной крови при преждевременных родах, и их выявление было четко связано с наличием признаков острого воспаления в плаценте.
Все большее количество данных подтверждает этиологическую роль в развитии воспалительных процессов как в нижнем отделе генитального тракта, так и причин ВЗОМТ (многие авторы в 1998-99 гг. не выделяли микоплазменную и уреаплазменную инфекции в структуре ВЗОМТ, однако в современных публикациях 2003-2008 гг. есть данные о влиянии этих инфекций на эндометрий, миометрий с развитием эндометрита, эндометриоза).
Сущестуют данные, доказывающие влияние урогенитальных микоплазм на бесплодие. Так, в исследовании фолликулярной жидкости женщин с бесплодием Mycoplasma hominis выявлена в 69,2%, Ureaplasma urealyticum – в 23,1%. Кроме того, опубликованы исследования роли Ureaplasma urealyticum в мужском бесплодии (D.F. Jiang H., Hong K., Zhao L.M., 2008). Тунисские исследователи Gdoura R., Kchaou W., Znazen A., Chakroun N., Fourati M., Ammar-Keskes L., Hammami A. выявили Ureaplasma urealyticum у 15,5% и Mycoplasma hominis у 10,3% в сперме бесплодных мужчин с лейкоцитоспермией.
При исследовании практически здоровых японских подростков (юношей) M. genitalium выявлена в 1%, M. hominis в 4%, U. urealyticum в 12%, а U. parvum в 23% случаев (Takahashi S., Takeyama K., Miyamoto S., Ichihara K., 2006). При обследовании Varela J.A., Otero L., Junquera M.L. (2006) 181 асимптомных мужчин, сексуальных партнеров женщин с неоплазией шейки матки, выявили Ureaplasma urealyticum в 19,3% случаев.
Раскрытие полной последовательности генома Ureaplasma parvum и M. genitalium значительно улучшило понимание основных биологических и патогенных свойств этих микроорганизмов. Микоплазмы имеют наименьший среди прокариот геном, способны жить самостоятельно, не имеют плотной клеточной стенки. Как следствие – выраженный полиморфизм. Могут находиться внутриклеточно. Большим количеством исследований установлено, что урогенитальные микоплазмы могут длительно персистировать в макрофагах (незавершенный фагоцитоз), оказывая негативное влияние на морфологию и фагоцитарную активность макрофагов. Есть мнение о том, что одним из основных депо микоплазм в организме является костный мозг.
Колонизация U. urealyticum на современном этапе значительно превышает и колонизацию M. genitalium. При исследовании 158 уреаплазмопозитивных женщин в 86% (136) был выявлен биовар 1 (Parvo), в 14% (22) – биовар 2 (T960). При дальнейшем дифференциальном серотипировании было установлено, что серовар 3/14 биовара Parvum наиболее часто встречается в возрасте 21-25 лет, а биовар Т960 у женщин в возрасте 26-30 и старше 40 лет. Серовар 3/14 Parvum и биовар Т960 были ассоциированы с клиническими симптомами и со снижением количества лактобацилл влагалища. Серовар 6 Parvum встречался у бессимптомных женщин и с нормальной лактофлорой влагалища. Все выделенные группой ученых института микробиологии и вирусологии Brescia (Italy, 2009) изолянты уреаплазмы были чувствительны к тетрациклину.
Микоплазмы могут распространяться путем транслокации (из одного органа в другой), горизонтально (половой путь, воздушно-капельный), восходящим и гематогенным путем. Инкубационный период чаще составляет 15-20 дней.
Инфекционные процессы могут быть очаговыми или генерализованными, с клиническими проявлениями и бессимптомными. Для этих инфекций характерны рецидивы – микоплазмозы являются персистирующими инфекциями. По отношению к другим микроорганизмам микоплазмы выступают как синергисты, а в ряде случаев и как триггеры, приводя к манифестации воспалительного процесса.
Начало патологических изменений заключается в стимуляции макрофагов, увеличении полиморфноядерных лейкоцитов в очаге воспаления и повышении провоспалительных цитокинов. Внутриклеточная локализация может повлиять на хронический характер инфекций и способность избежать иммунной реакции носителя. Локализация и крепление к поверхностям клеток носителя важны для способности микоплазм колонизировать и впоследствии производить патологические повреждения, даже если клеточная интернализация не происходит.
Адсорбция на эукариотических клетках и клетках крови обеспечивает устойчивость микоплазм к противоточному действию биологических жидкостей, способствует их диссеминации в организме и сохранению в наиболее благоприятных нишах. В то же время сосредоточение в криптах мембран делает их менее доступными для действия антител и комплемента.
К основным факторам патогенности микоплазм относятся адгезины, токсины, ферменты агрессии и продукты метаболизма. Адгезины входят в состав поверхностных антигенов и способствуют адгезии микоплазм на клетках хозяина, что имеет ведущее значение в инициировании инфекционного процесса. Микоплазмы способны прикрепляться к эпителиальным клеткам, к фибробластам, сперматозоидам, эритроцитам. Эндотоксины обнаружены у многих генитальных микоплазм, а их введение лабораторным животным сопровождается пирогенным эффектом, лейкопенией, геморрагическими высыпаниями, коллапсом.
К ферментам агрессии микоплазм относятся фосфолипаза А и аминопептидазы, гидролизирующие фосфолипиды мембраны клеток.
Потенциальными вирулентными факторами M. hominis и уреаплазм являются метаболизм аргинина и активность уреазы соответственно. Другим потенциальным фактором вирулентности у Ureaplasma spp. предположили активность иммуноглобулина (Ig) A1 протеазы. Высокая протеазная активность U. urelyticum направлена на IgA человека, в результате чего иммуноглобулины теряют способность связывать антигены уреаплазм и предотвращать развитие инфекции. Проведение специфической терапии, приводящее к клиническому улучшению, часто не приводит к элиминации возбудителя, который может активизироваться впоследствии под влиянием различных факторов.
Имеются научные работы, доказывающие высокую вариабельность антигенов M. hominis, выделенной от одного и того же пациента в разное время. Кроме этого, показано, что адаптация к новому хозяину приводит к генетическим изменениям микоплазм. Есть предположение о генетической детерминированности индивидуального уровня восприимчивости и чувствительности к микоплазменным инфекциям.
Генетически опосредуемая фенотипическая изменчивость является важным механизмом ускользания микоплазм от иммунного контроля и персистенции их в тканях.
В связи с этим интересны данные, полученные на базе Уральского НИИ дерматовенерологии и иммунопатологии (4, 11), где изучили генетические различия штаммов M. hominis, выделенных от женщин с воспалительными заболеваниями репродуктивных органов различной степени тяжести. В результате молекулярно-генетического анализа штаммов M. hominis, выделенных в диагностически значимых титрах (104 КОЕ/мл и более) от 59 пациенток в возрасте 16-52 лет (28,3 ± 8,7 года), в 29 случаях (49,2%) была выявлена ранее не описанная мутация – замена тимина на цитозин в позиции 179 гена 16S рРНК.
Было обнаружено, что мутантные штаммы M. hominis в 15,7 раза чаще диагностировали у пациенток с воспалительными заболеваниями верхних отделов генитального тракта (эндометрит, сальпингоофорит, которые сопровождались спаечным процессом). Штаммы M. hominis, у которых данная мутация отсутствовала, достоверно чаще выявлялись у пациенток с воспалительными заболеваниями нижнего отдела урогенитального тракта. Было установлено, что мутантные штаммы M. hominis чаще выявлялись у пациенток старшего репродуктивного возраста с малосимптомным течением воспалительного процесса. По чувствительности/устойчивости к антибиотикам мутантные штаммы M. hominis не отличались от штаммов, не имеющих мутации.
По данным Baum S.G. (2005), микоплазмы имеют рецепторы, структурно родственные антигену А эритроцитов, что в определенной мере может объяснить склонность к развитию микоплазменных инфекций у лиц А(II) группы крови.
Установлено, что усиленное размножение микоплазм может быть связано с гиперэстрогенией. Кроме того, показано, что эстрадиол усиливает чувствительность половой системы самок мышей к U. urealyticum, M. hominis, M. fermentans, а прогестерон повышает уровень колонизации половых путей M. pneumoniae и M. genitalium.
При хронической микоплазменной инфекции имеются нарушения в системе гемостаза, приводящие к гиперкоагуляции: усилению спонтанной и стимулированной агрегации тромбоцитов, эритроцитов, увеличению активности фактора Виллебранда, гиперфибриногенемии, появлению РКМФ, увеличению вязкости крови. Все микоплазмы способны вызывать гемолиз эритроцитов человека и животных, при этом гемолизинами микоплазм являются не только белки, липиды, но и перекиси.
Имеются указания на связь микоплазменных инфекций с развитием аутоиммунных заболеваний, таких как ревматоидный артрит, гемолитическая анемия, тромбоцитопения, мультиформная эритема, бронхиальная астма и т.д. Исследованиями российских авторов показано, что при микоплазменной инфекции у беременных в 35-65% случаев определяются антитела к фосфолипидам как проявление аутоиммунного процесса.
Известно, что наличие антифосфолипидных антител в большом числе случаев ассоциировано с изменениями гемостаза, которые выражаются в повышении уровня фибриногена, повышении агрегационной способности тромбоцитов, угнетении антикоагуляционных механизмов, торможении реакций фибринолиза. Указанные нарушения закономерно приводят к нарушению микроциркуляции с последующим формированием первичной плацентарной недостаточности, отслойке хориона, плаценты, формированию акушерских и перинатальных осложнений.
Роль уреаплазмы в преждевременных родах объясняют присутствием фосфолипаз А и C в Ureaplasma spp., которые способствуют высвобождению арахидоновой кислоты и изменению синтеза простагландинов.
Работами большого числа исследователей показано, что при микоплазменной инфекции происходит повышение содержания провоспалительных цитокинов (ИЛ-1, 6, 8, 16, TNF-a) как в сыворотке крови (общий системный ответ), так и местно (эндометрий, цервикальная слизь, влагалищное содержимое, амниотические воды, пуповинная кровь, аспират из трахеи у новорожденных) на фоне снижения содержания провоспалительных цитокинов (ИЛ-10).
Стимуляция провоспалительного каскада приводит к активации эндотелиальных клеток, которые освобождают избыточное количество протромбиназы, способствующей превращению протромбина в активный тромбин, который в свою очередь стимулирует эндотелиальные клетки к секреции ИЛ-8, в результате чего происходит локальная коагуляция, приводящая к функциональной недостаточности эндометрия при имплантации и развитию плацентарной недостаточности в последующем.
В 2007 г. выработан консенсус специалистов, занимающихся вопросами диагностики и терапии инфекций, ассоциированных с микоплазмами:
- M. genitalium – патогенный микроорганизм, при выявлении – всегда этиотропное лечение. При выявлении U. urealyticum и M. hominis (условно патогенные микроорганизмы) лечение следует назначать, если нет других бактериальных/вирусных агентов:
- при наличии клинических и лабораторных признаков воспалительного процесса органов мочеполовой системы;
- при предстоящих оперативных или других инвазивных лечебно-диагностических манипуляциях в области мочеполовых органов;
- при отягощенном акушерско-гинекологическом анамнезе (невынашивание беременности, бесплодие, перинатальные потери и др.);
- при осложненном течении настоящей беременности, предполагающим возможное инфицирование плода.
Лечение следует назначать при наличии у пациентов клинических проявлений воспалительного процесса и в том случае, если U. urealyticum и M. hominis выявляются в количестве более 104 КОЕ/мл.
Тактика лечения
При выборе препарата для лечения ВЗПО у женщин необходимо учитывать данные об эффективности препарата (не ниже 95%), наличие полимикробной флоры и исключать элемент полипрагмазии.
По данным исследователей (3), свойствами идеального антимикробного препарата являются:
- селективная активность;
- бактерицидность;
- способность не вызывать значительную резистентность;
- соответствие терапевтическому ряду пенициллины/аминогликозиды;
- отсутствие токсичности;
- наличие постоянной антибактериальной активности – «срок хранения»;
- низкая стоимость;
- удобство применения, per os однократно в день.
Определены факторы, влияющие на выбор антимикробного препарата:
- контроль чувствительности микроорганизма к антибиотикам (АБ);
- токсичность АБ – нет препаратов полностью безопасных, дополнительная токсичность;
- возраст, масса тела пациентов, наличие беременности/лактации;
- при осложнении инфекционных заболеваний бактериальным шоком показано внутривенное введение высоких доз АБ широкого спектра действия;
- анатомическая локализация инфекции – проникновение в спинномозговую жидкость;
- сопутствующие заболевания печени и почек (метаболизм или экскреция АБ);
- антибактериальная специфичность препаратов;
- бактерицидная активность препаратов: «скомпрометированный хозяин», сердечные клапаны, остеомиелит, менингит;
- экскреция препаратов;
- взаимодействие препаратов; генетические факторы (дефицит глюкозо-6-фосфатдегидрогеназы, нарушение ацетилирования);
- согласие пациента;
- стоимость препарата.
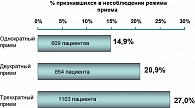
Последние 50 лет не прекращаются попытки установить оптимальную дозу, частоту и длительность приема антибиотиков при лечении различных инфекций. В течение последнего десятилетия продолжали накапливаться данные о том, что пациенты не придерживаются необходимой частоты приема назначенного им препарата. Действительно, готовность пациентов принимать антибиотик по 4 раза в день на протяжении 10-14 дней вызывает большие сомнения. Скорее, они склонны принимать его более длительно, но 1 раз в сутки.
Оценена зависимость комплаентности от кратности приема препарата (см. рисунок).
Таким образом, во время выбора схем лечения амбулаторных инфекций крайне важно учитывать штамм бактерии, необходимые подавляющие концентрации, особенности организма и вероятность развития резистентности при назначении того или иного антибиотика. А также учитывать, что при лечении любого инфекционного заболевания в амбулаторных условиях предпочтителен 1-2-кратный прием лекарственного средства.
Выбор лекарственного средства для лечения ВЗПО
Азицид (азитромицин). Антибиотик группы макролидов, является представителем азалидов. Связываясь с 50S-субъединицей рибосомы, подавляет РНК-зависимый синтез белка чувствительных микроорганизмов. В высоких концентрациях оказывает бактерицидный эффект. Активен в отношении грамположительных кокков: Staphylococcus aureus, Streptococcus spp. (в т.ч. Streptococcus pneumoniae, Streptococcus pyogenes группа A); грамотрицательных бактерий: Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus ducreyi, Moraxella catarrhalis, Escherichia coli, Bordetella pertussis, Bordetella parapertussis, Borrelia burgdorferi, Neisseria gonorrhoeae, Campylobacter spp., Legionella pneumophila; анаэробных бактерий: Bacteroides fragilis, Clostridium perfringens, Peptostreptococcus spp. Азитромицин активен также в отношении Chlamydia trachomatis, Mycoplasma pneumoniae, Mycoplasma hominis, Ureaplasma urealyticum, Treponema pallidum, Borrelia burgdoferi. Активен также в отношении Toxoplasma gondii.
Азитромицин является единственным представителем азалидов, в отличие от других макролидов относящийся к группе антимикробных препаратов с концентрационно-зависимой активностью (наравне с фторхинолонами и аминогликозидами).
Азитромицин быстро всасывается из ЖКТ, что обусловлено его устойчивостью в кислой среде и липофильностью. После приема внутрь 500 мг максимальная концентрация азитромицина в плазме крови достигается через 2,5-2,9 ч и составляет 0,4 мг/л. Быстро распределяется в тканях и биологических жидкостях. Азитромицин характеризуется высоким внутриклеточным и тканевым проникновением и длительным сохранением высоких концентраций в воспаленных тканях, что очень важно с клинической точки зрения, так как это позволяет оптимизировать значение ПФК (площадь под фармакокинетической кривой) / МПК (концентрация–время к минимальной подавляющей концентрации) не только в отношении чувствительных (МПК ³ 2 мг/л), но и устойчивых микроорганизмов. Высокая концентрация в тканях (в 10-50 раз выше, чем в плазме крови) и длительный период полувыведения обусловлены низким связыванием азитромицина с белками плазмы крови, а также его способностью проникать в эукариотические клетки и концентрироваться в среде с низким рН, окружающей лизосомы. Способность азитромицина накапливаться преимущественно в лизосомах особенно важна для элиминации внутриклеточных возбудителей. Доказано, что фагоциты доставляют азитромицин в места локализации инфекции, где он высвобождается в процессе фагоцитоза. Концентрация азитромицина в очагах инфекции достоверно выше, чем в здоровых тканях (в среднем на 24-34%), и коррелирует со степенью воспалительного отека. Азитромицин сохраняется в бактерицидных концентрациях в течение 5-7 дней после приема последней дозы, что позволило разработать короткие (3-дневные и 5-дневные) курсы лечения.
В исследованиях in vitro показано, что азитромицин накапливается в различных клетках – полиморфноядерных лейкоцитах, макрофагах и фибробластах, причем концентрация препарата в фагоцитирующих клетках превышает его концентрацию в интерстициальной жидкости более чем в 200 раз, а в фибробластах в 4000 раз. Накопление в лизосомах фагоцитирующих клеток позволяют формировать высокие терапевтические концентрации в фаголизосомах и цитоплазме клеток – основной среде обитания Chlamydia trachomatis.
35% азитромицина метаболизируется в печени путем деметилирования, образующиеся метаболиты неактивны. Выведение азитромицина из плазмы крови проходит в 2 этапа: период полувыведения составляет 14-20 ч в интервале от 8 до 24 ч после приема препарата и 41 ч – в интервале от 24 до 72 ч, что позволяет применять препарат 1 р./сут. Более 59% выводится с желчью в неизмененном виде, около 4,5% – с мочой в неизмененном виде.
Для лечения урогенитального хламидиоза азитромицин можно применять в однократной дозе (1 г), эффективность которой была доказана не менее чем в трех сравнительных клинических исследованиях с 7-дневным курсом доксициклина (по 100 мг 2 р./сут.), в которых участвовали от 86 до 510 пациентов. Эффективность азитромицина по результатам клинических исследований составила 91-97%.
Сравнение однократной дозы азитромицина и недельного курса лечения доксициклином у больных с хламидийными инфекциями проводилось в 7 рандомизированных исследованиях, в которых также была продемонстрирована сопоставимая эффективность этих режимов. В метаанализе клинических исследований показано, что однократная доза азитромицина не уступает недельному курсу доксициклина и по показателю эрадикации возбудителя: 94,9% против 95,9% (8).
На базе Уральского НИИ дерматовенерологии и иммунопатологии провели исследование, где изучали эффективность парентеральной антибактериальной терапии пациентов с осложненным течением УГХ. Сравнивали эффективность азитромицина при пероральном приеме в дозе 1,0 г в 1-7-14-й день терапии (курс лечения 3,0 г) и в виде ступенчатой терапии, где использовали азитромицин в дозе 500 мг внутривенно капельно в 200 мл 0,9-процентного изотонического раствора натрия хлорида в 1-й и 2-й дни лечения с последующим пероральным приемом препарата в дозе 250 мг в течение 5 дней. В результате исследования доказана высокая эффективность (96,3%), хорошая переносимость азитромицина и выраженный ранний положительный клинический эффект (исчезновение болевого синдрома в первые сутки у 89,3% и патологических выделений у 93,5% пациентов) при парентеральной терапии пациентов с осложненным течением УГХ (4).
Имеются данные о существенной эффективности ступенчатой терапии азитромицином острых ВЗОМТ. Азитромицин вводили внутривенно в дозе 500-1000 мг с последующим пероральным приемом 250 мг 1 раз в день в течение 7 дней. Сравнение проводили с двумя стандартными режимами: метронидазол + доксициклин + цефокситин + пробенецид или амоксициллин клавуланат + доксициклин. Схемы назначали в рекомендуемых дозах в течение 21 дня. Клинический эффект: 97% при лечении азитромицином и 95% в группах сравнения. Эрадикация выявленных патогенов (Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma hominis и анаэробы) также была сравнима в исследованных группах. По данным Bevan C.D., Ridgway G.L., Rothermel C.D., при назначении одного азитромицина по схеме ступенчатой терапии ВЗОМТ выздоровление наблюдалось у 97,1% больных женщин (10). Если же к указанному лечению добавлялся метронидазол по 400 мг 3 р./сут. в течение 12-14 дней, то показатель успешного лечения изменялся незначительно – 98,1%. При этом побочные эффекты отмечались в 1,5 раза реже при приеме азитромицина, нежели при назначении стандартных схем (24% и 36% соответственно).
Рекомендуемые схемы лечения
Эмпирическая терапия ВЗОМТ:
Азицид 500 мг 1 р./сут. 3 дня + Орнидазол 500 мг 2 р./сут. 5 дней
или
Азицид 500 мг (2 ´ 250 мг) 1 р./сут., далее Азицид 250 мг 1 р./сут. (общий курс – 5 дней) + Орнидазол 500 мг 2 р./сут. 5 дней.
Ступенчатая терапия ВЗОМТ в стационаре:
Азитромицин 500-1000 мг в/в однократно в сутки + Метронидазол 200 мг 3 р./сут. в/в непрерывно (струйно) или капельно через каждые 8 ч.
Через 1-2 дня перейти к пероральному приему:
Азицид 250 мг 1 р./сут. – 7 дней + Орнидазол 500 мг 2 р./сут. 5-7 дней.
Диагностированная моноинфекция:
хламидиоз – Азицид 1 г однократно. Осложненное течение УГХ: Азицид 500 мг 1 р./сут. 3 дня, Азицид 1 г в неделю (всего 3 г);
трихомониаз – Орнидазол 500 мг 2 р./сут. 5 дней или Метронидазол 250 мг 4 р./сут. 7 дней;
уреамикоплазменная инфекция – Азицид 500 мг в первый день лечения, 250 мг 1 раз в день в последние 4 дня.
Таким образом, ступенчатая монотерапия ВЗОМТ азитромицином обладает рядом преимуществ перед рекомендуемыми схемами: она значительно короче, лучше переносится пациентами, не уступая в клинической и микробиологической эффективности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.