Противовоспалительное действие препарата на основе пектина: экспериментальные данные
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В экспериментальном исследовании наблюдали за 103 аутбредными нелинейными белыми беспородными мышами SHK в возрасте 8–10 недель. На первом этапе с участием 50 мышей был подобран раствор йота-каррагинана в качестве вещества, оптимально моделирующего местный воспалительный процесс. На втором этапе 29 особей основной группы перед введением йота-каррагинана, растворенного в дистиллированной воде, получали в течение 20 дней Зостерин-Ультра 60% (ООО «Аквамир», Россия, Санкт-Петербург) перорально, 24 особи контрольной группы перед введением йота-каррагинана никаких дополнительных препаратов не получали. Выраженность воспалительного процесса оценивали по разнице веса лапок.
Результаты. По завершении второго этапа было установлено, что Зостерин-Ультра 60% уменьшает выраженность воспалительного процесса в 1,5 (среди самцов) и в 1,9 (среди самок) раза, снижая различия среднего веса правой и левой лапок с 86,3 до 52,8 мг у самцов и с 124,8 до 42,7 мг у самок.
Выводы. Во-первых, Зостерин-Ультра 60% при пероральном введении в течение трех недель существенно (в 1,5–2,0 раза) снижает выраженность воспалительной реакции, смоделированной путем введения раствора йота-каррагинана в лапку мыши. Во-вторых, в ходе эксперимента доказана способность Зостерина-Ультра 60% работать вне желудочно-кишечного тракта, что с учетом многолетнего подтверждения безопасности препарата может быть использовано в клинической практике.
Материал и методы. В экспериментальном исследовании наблюдали за 103 аутбредными нелинейными белыми беспородными мышами SHK в возрасте 8–10 недель. На первом этапе с участием 50 мышей был подобран раствор йота-каррагинана в качестве вещества, оптимально моделирующего местный воспалительный процесс. На втором этапе 29 особей основной группы перед введением йота-каррагинана, растворенного в дистиллированной воде, получали в течение 20 дней Зостерин-Ультра 60% (ООО «Аквамир», Россия, Санкт-Петербург) перорально, 24 особи контрольной группы перед введением йота-каррагинана никаких дополнительных препаратов не получали. Выраженность воспалительного процесса оценивали по разнице веса лапок.
Результаты. По завершении второго этапа было установлено, что Зостерин-Ультра 60% уменьшает выраженность воспалительного процесса в 1,5 (среди самцов) и в 1,9 (среди самок) раза, снижая различия среднего веса правой и левой лапок с 86,3 до 52,8 мг у самцов и с 124,8 до 42,7 мг у самок.
Выводы. Во-первых, Зостерин-Ультра 60% при пероральном введении в течение трех недель существенно (в 1,5–2,0 раза) снижает выраженность воспалительной реакции, смоделированной путем введения раствора йота-каррагинана в лапку мыши. Во-вторых, в ходе эксперимента доказана способность Зостерина-Ультра 60% работать вне желудочно-кишечного тракта, что с учетом многолетнего подтверждения безопасности препарата может быть использовано в клинической практике.


Введение
Пектины и их действие на организм человека и животных изучаются давно. Первые работы были опубликованы еще в 1941 г. С тех пор накоплен большой научный материал о влиянии пектинов на микрофлору кишечника, состояние желудочно-кишечного тракта (ЖКТ), иммунную систему и весь организм в целом. В последние годы в ряде научных исследований изучали механизм действия на молекулярном уровне.
Пектины относятся к пищевым волокнам и представляют собой метилированный эфир полигалактуроновой кислоты, содержащий 1,4-связанные остатки альфа-d-галактуроновой кислоты и различные нейтральные сахара: арабинозу, галактозу, рамнозу и другие (в меньшем количестве). Составы разделяют на типы в зависимости от степени этерификации или количества метоксигрупп, замещающих остаток карбоновой группы на остатках галактуроновой кислоты. Степень этерификации влияет на механизм гелеобразования, условия обработки и свойства пектина [1].
Как известно, пектины подавляют рост патогенов, предотвращая их адгезию к эпителиальным клеткам и последующее повреждение эпителия. В исследованиях показано, что пектины и пектиновые олигосахариды активны против Escherichia coli, Salmonella typhimurium, Listeria monocytogenes и Campylobacter jejuni [2]. Наряду с этим пектины стимулируют адгезию комменсальных бактерий, которые могут конкурировать с патогенными микроорганизмами, прикрепляясь к стенке ЖКТ, и секретировать ряд полезных для организма человека веществ. Исследования продемонстрировали, что пектины или пектиновые олигосахариды усиливают адгезию комменсальных или пробиотических штаммов Lactobacillus spp. к эпителиальным клеткам [2].
Пищевые углеводы, особенно резистентные крахмалы (устойчивы к действию пищеварительных ферментов) и пищевые волокна, служат субстратом для ферментации, в результате которой в качестве конечных продуктов образуются короткоцепочечные жирные кислоты (КЖК), в первую очередь ацетат, пропионат и бутират. Скорость и количество продукции КЖК зависят от вида и количества микрофлоры, присутствующей в толстой кишке, источника субстрата и времени прохождения через кишечник. Установлено, что эти кислоты снижают риск развития желудочно-кишечных расстройств, онкологических и сердечно-сосудистых заболеваний [3, 4]. Основным в толстой кишке является ацетат, который поступает в периферическое кровообращение и метаболизируется в периферических тканях. Он способствует повышению синтеза холестерина. Пропионат, наоборот, ингибирует синтез холестерина, в основном поглощаясь печенью. Бутират – основной источник энергии для колоноцитов, он оказывает противовоспалительный и противоонкологический эффекты [3, 4].
Многие пищевые волокна, в том числе пектины, могут напрямую взаимодействовать с врожденными иммунными клетками, такими как макрофаги или дендритные клетки, и влиять на их реакции. Пектины транспортируются в пейеровы бляшки через М-клетки и активируют клеточный иммунитет. Врожденные иммунные клетки способны распознавать пищевые волокна посредством взаимодействия с внеклеточными рецепторами распознавания образов, которые экспрессируются клетками врожденного иммунитета – макрофагами, нейтрофилами, дендритными и эпителиальными клетками [2, 5].
Пектины ингибируют провоспалительное взаимодействие между толл-подобными рецепторами 2-го и 1-го типов (TLR2 и TLR1), в то время как связь между TLR2 и TLR6 остается незатронутой. Этот эффект наиболее выражен у пектинов с низкой степенью метилэтерификации, которые взаимодействуют с TLR2 посредством электростатических сил между неэстерифицированными галактуроновыми кислотами на пектине и положительными зарядами на эктодомене TLR2, что подтверждено в эксперименте [6].
Противовоспалительное действие пектинов с низкой степенью метилэтерификации впервые было изучено на человеческих дендритных клетках и мышиных макрофагах in vitro, а затем in vivo при илеите, зависящем от TLR2, при моделировании воспалительной реакции у мышей. У этих животных воспаление кишечника было предотвращено за счет введения пектина [6].
Растворимый пищевой пектин защищает терминальный отдел подвздошной кишки от фиброза, вызванного радиацией. Кишечный фиброз при поздней лучевой энтеропатии сопровождается увеличением толщины подслизистого слоя и отложением субэпителиального коллагена. В эксперименте яблочный пектин (4% по весу в питьевой воде) вводили диким и трансгенным мышам с фиброзом кишечника, вызванным однократной дозой абдоминального облучения 10 Гр. На фоне приема пектина значительно уменьшились толщина подслизистого слоя и отложение коллагена через 12 недель (24,3 мкм в группе, получавшей пектин наряду с облучением, против 27,6 мкм в группе, где применяли только облучение). Пектин также модулировал состав кишечной микробиоты и увеличивал концентрацию КЖК в просвете [7].
В научной литературе накопилось достаточно информации о влиянии пектинов на раковые клетки. Например, гетерополисахарид, выделенный из тропического покрытосеменного растения феронии лимонной (Feronia limonia или Feronia elephantum, семейство Rutaceae), вызывал у мышей в условиях эксперимента значительное ингибирование роста клеток асцитной карциномы Эрлиха in vivo [8].
В другом исследовании водорастворимые полисахариды, выделенные из аконита (Aconiti lateralis и Aconiti Kusnezoffii), не только демонстрировали иммуностимулирующую активность, воздействуя на неспецифический, клеточный и гуморальный иммунитет, но и восстанавливали подавленную противоопухолевыми препаратами иммунную функцию [9].
В исследованиях также установлено, что введение пектинов подавляет воспаление и атипию клеток кишечника у мышей с дефицитом рецепторов КЖК – GPR43/GPR41 [10]. В отсутствие коррекции у таких животных отмечались нарушения иммунного ответа с развитием неконтролируемой хронической воспалительной реакции на повреждение эпителия вместо нормальной реакции в виде острого воспаления с его завершением. Кроме того, у мышей с дефицитом GPR43 выявлено повышение числа атипичных клеток с развитием канцерогенеза кишечника [10].
Необходимо учитывать, что пектины имеют разное строение и массу, что обусловливает наличие разных свойств.
Среди применяемых на сегодняшний день пектинов Зостерин-Ультра 30% и Зостерин-Ультра 60% являются уникальными по своему составу и свойствам. Это богатый апиозой пектиновый полисахарид, выделенный из многолетнего водного растения – морской травы Zostera marina, произрастающей в мелководьях бухт и прибрежных зонах морей [11, 12]. Не все зоны, где растет эта трава, считаются чистыми. Именно поэтому в медицине используются только растения, произрастающие в экологически чистых акваториях Приморского края в период с июня по сентябрь, когда идет интенсивный рост растения, а нежелательные компоненты не успевают накапливаться [13].
Структурные исследования вещества, проведенные с помощью газовой хроматографии и спектроскопии ядерного магнитного резонанса, показали типичную структуру апиогалактуронана, включающую альфа-1,4-d-галактопиранозилуронановый остов, замещенный 1,2-связанными апиофуранозными олигосахаридами и одиночными остатками апиозы. Разветвленная молекула состоит из блоков полигалактуроновой кислоты, соединенных связями рамнозы, в сочетании с апиогалактуронаном (примерно 25%), содержащим углевод апиозу. Средняя молекулярная масса – около 4100 Да с низкой полидисперсностью. Для выделения веществ применяется особая технология без каких-либо химических веществ.
При изучении препаратов Зостерин-Ультра 60% и Зостерин-Ультра 30% показаны их энтеросорбирующее действие, элиминация токсинов возбудителей, существенное ослабление синдрома интоксикации, снижение патологической сенсибилизации организма, а также общеукрепляющее и иммуномодулирующее действие [14]. Кроме того, коррекция диеты с применением этих препаратов позволяет достигать ремиссии рецидивирующей экземы [15].
Как показали результаты ряда исследований и наблюдений, Зостерин-Ультра способен сорбировать яды и ксенобиотики, предотвращая или снижая выраженность токсико-аллергических реакций, токсичные метаболиты, выделяемые в химус секретом слизистой оболочки ЖКТ, печени, поджелудочной железы, эндогенные продукты секреции и гидролиза, нейропептиды, простагландины, серотонин, гистамин и другие биологически активные вещества, бактерии и бактериальные токсины, газы, тяжелые металлы [11, 16]. Препарат предотвращает адсорбцию патогенных микроорганизмов к эпителиоцитам кишечника, в то же время способствует восстановлению целостности и оптимальной проницаемости слизистой оболочки, устраняет метеоризм, улучшает пищеварительную функцию ЖКТ, стимулирует моторику кишечника. Эти свойства позволяют использовать Зостерин-Ультра 30% и Зостерин-Ультра 60% при экзогенных и эндогенных интоксикациях, нарушениях метаболизма, иммунного статуса, инфекционных, аллергических, психоневрологических, кардиологических и нефрологических заболеваниях. Показано, что это вещество ингибирует пролиферацию, миграцию и инвазию клеток эпидермоидной карциномы человека за счет подавления экспрессии металлопротеиназ [17].
Предположительно препарат Зостерин-Ультра 60% оказывает противовоспалительное действие, но прямых подтверждений этого не получено. Непонятно, где и каким образом реализуется этот эффект: в просвете ЖКТ или за его пределами. Важно уточнять механизм действия любого препарата в целях рационального выбора схем терапии. Воспалительный процесс – один их частых синдромов в клинической практике. Не всегда применение нестероидных противовоспалительных средств оправданно и безопасно, что обусловливает необходимость поиска альтернативных подходов.
Цель – оценить влияние препарата на основе пектина Зостерин-Ультра 60% на воспалительный процесс у лабораторных животных.
Материал и методы
В экспериментальном исследовании участвовали 103 аутбредные нелинейные белые беспородные мыши SHK (52 самца и 51 самка) в возрасте 8–10 недель, на момент начала эксперимента полученных из питомника филиала «Андреевка» ФГБУН «НЦБМТ» ФМБА России. Средний вес животных – 32,6 г. На первом этапе оценивали провоспалительную активность йота-каррагинана и каппа-каррагинана (Нидерланды, дистрибьютер – компания Molecularmeal, Россия), физиологического раствора и дистиллированной воды путем введения их в правую лапку мышей с целью выбора оптимального состава для моделирования воспаления. Выбор веществ для моделирования воспалительного процесса был обусловлен хорошей изученностью, распространенностью в пищевой промышленности и относительной безопасностью. Известно, что каррагинаны вызывают местную воспалительную реакцию. На этом основании выбранный нами метод рекомендован в руководствах по проведению экспериментальных исследований, используется во всем мире, в частности в России, на протяжении многих лет при доклиническом изучении противовоспалительных препаратов и называется «метод отека лапок» [18–20]. Влияние физиологического раствора и дистиллированной воды оценивали для уточнения их возможного участия в развитии отека лапок у мышей.
В ходе эксперимента мышам основной группы в подошвенную область правой лапки вводили 50 мкл 1%-ных растворов каррагинанов (10 мышам – йота-каррагинана и еще 10 мышам – каппа-каррагинана), а также 10 мышам – 50 мкл физиологического раствора или (другим 10 животным) 50 мкл дистиллированной воды. Каррагинаны растворяли в 0,9%-ном (физиологическом) растворе хлорида натрия в течение 24 часов на магнитной мешалке. Левые лапки оставляли интактными для сравнения действия. Результаты оценивали через 24 часа после введения исследуемых составов в лапки. Еще 10 мышей составили контрольную группу.
На втором этапе основная группа (29 мышей) перед введением йота-каррагинана, растворенного в дистиллированной воде, получала в течение 20 дней пектиновый препарат Зостерин-Ультра 60% (ООО «Аквамир», Россия, Санкт-Петербург) перорально. Его получают из морской травы Zostera marina с помощью особой запатентованной технологии. Зостерин-Ультра 60% разводили в дистиллированной воде из расчета 500 мг на 200 мл воды. Раствор меняли каждые два-три дня. Бутылочки для питья тщательно промывали в проточной воде. Каждая мышь в течение суток потребляла вместе с питьем в среднем от 10,3 до 16,0 мг препарата Зостерин-Ультра 60%.
Для введения йота-каррагинана использовали шприцы 0,5 мл с четкой разметкой объема, длиной иглы 12 мм и толщиной 0,3 мм (U-100 0,5 ml 29Gx 1/2, GmbH).
В контрольной группе (24 мыши) перед введением йота-каррагинана животные никаких дополнительных препаратов не получали.
Выраженность воспалительного процесса оценивали по разнице среднего веса правой и левой лапок в группах, а также по различиям среднего веса правых лапок между экспериментальной и контрольными группами через 48–72 часа от момента введения йота-каррагинана.
Масса животных на момент завершения второго этапа эксперимента составляла 26,7–40,3 г. Самцы весили больше самок.
Протокол исследования соответствовал этическим принципам и нормам проведения биомедицинских исследований с участием животных.
Статистическую обработку полученных данных осуществляли с помощью компьютерной программы STATISTICA v. 12. Рассчитывали средние значения М, стандартное отклонение SD (при возможности), частоту встречаемости качественного показателя в выборке. Проверка на нормальность распределения проводилась на основании критерия Шапиро – Уилка. Достоверность различий между показателями в сравниваемых группах оценивали с помощью критерия Стьюдента и точного критерия Фишера для малых групп. Статистически значимыми считали различия при p < 0,05.
Результаты и обсуждение
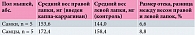
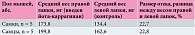
Исходя из оценки действия каррагинанов, было установлено, что наиболее выраженный воспалительный процесс развивается при введении йота-каррагинана (табл. 1 и 2).
При введении только физиологического раствора или дистиллированной воды (табл. 3) через 24 часа никаких изменений по сравнению с левой лапкой обнаружено не было. Средний вес лапок был сопоставим с весом лапок в контрольной группе, где также не было различий между левой и правой сторонами.
После изучения особенностей воспалительного ответа на введение четырех разных веществ йота-каррагинан 1% был выбран как наиболее оптимальный вариант для моделирования воспаления с целью изучения действия препарата Зостерин-Ультра 60%. Для растворения йота-каррагинана использовали либо физиологический раствор, либо дистиллированную воду, поскольку, как показал первый этап исследования, оба этих вещества не оказывают провоспалительного эффекта.
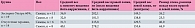
Препарат Зостерин-Ультра 60% существенно снижал выраженность отека лапок, вызванного введением йота-каррагинана, растворенного в дистиллированной воде (табл. 4).
Как видно из табл. 4, средний вес мышей, получавших Зостерин-Ультра 60%, к концу третьей недели приема был несколько больше, а вес лапок, в которые вводился йота-каррагинан, меньше, чем в группе мышей, не получавших терапии. Разница между весом правой и левой лапок на фоне приема препарата была в 1,5 раза меньше, чем в контрольной группе, что подтверждает действие препарата.
С целью уточнения влияния веса и пола животных на противовоспалительное действие препарата мы разделили мышей на гендерные подгруппы (табл. 5). Вес самцов к концу третьей недели был больше в группе, получавшей Зостерин-Ультра 60%, а вес самок – меньше. Однако различия веса лапок оказались еще более выраженными. Среди самок, которым давали препарат, объем отека был в 1,9 раза меньше, чем в отсутствие лечения. Среди самцов разница была несколько менее выражена – в 1,5 раза.
Зостерин-Ультра 60% снизил различия среднего веса правой и левой лапок с 86,3 до 52,8 мг у самцов и с 124,8 до 42,7 мг у самок, что наглядно демонстрирует его противоотечный эффект, который с учетом действия выбранного вещества для моделирования процесса следует считать противовоспалительным (табл. 5).
Таким образом, эксперимент показал влияние препарата Зостерин-Ультра 60% на локализованную воспалительную реакцию, спровоцированную инъекцией каррагинана, что подтверждает способность препарата Зостерин-Ультра 60% работать за пределами ЖКТ.
Острая воспалительная реакция на введение каррагинана характеризуется повышением проницаемости сосудов и клеточной инфильтрацией, что приводит к образованию отека в результате экстравазации жидкости и белков, а также накопления лейкоцитов в месте воспаления [21]. Впервые это действие было описано в 1969 г. L. Levy. В 1987 г. M.G. Henriques и коллеги показали, что инъекция каррагинана в лапку мыши вызывает двухфазный отек. Первая фаза характеризуется отеком небольшой интенсивности и не связана с дозой использованного каррагинана, а вторая фаза развивается через 24 часа с гораздо большей выраженностью и проявлением максимума между 48 и 72 часами.
Зостерин-Ультра 60% при взаимодействии с водой образует жидкий гель, который оказывает протекторное действие на всю слизистую оболочку ЖКТ, улучшает репарацию эпителия, функциональное состояние клеток кишечника, что приводит к увеличению активности расщепления поступающих веществ, обеспечивает оптимальную проницаемость кишечной стенки, способствует развитию и функционированию микробиома [13]. Это может косвенно влиять на воспалительный ответ. В то же время некоторое количество препарата расщепляется с помощью пектиназ, присутствующих в кишечнике, до небольших фрагментов, способных поступать в лимфу или кровоток, транспортироваться в ткани и непосредственно действовать в них [13]. Данный эксперимент не позволяет установить механизм противовоспалительного действия, что требует дальнейших исследований.
Выводы
На основании полученных результатов были сделаны следующие выводы:
- Зостерин-Ультра 60% при пероральном введении в течение трех недель существенно (в 1,5–2,0 раза) снижает выраженность воспалительной реакции, смоделированной путем введения раствора йота-каррагинана в лапку мыши;
- Зостерин-Ультра 60% способен работать за пределами ЖКТ, что с учетом многолетнего подтверждения безопасности препарата может быть использовано в клинической практике.
Авторы заявляют об отсутствии конфликта интересов и финансировании.
A.V. Volkov, PhD, T.A. Ruzhentsova, PhD, Prof., I.G. Meshkov
G.N. Gabrichevsky Research Institute for Epidemiology and Microbiology
Moscow Medical University ‘REAVIZ’
Russian State Agrarian University – K.A. Timiryazev Moscow Agricultural Academy
Contact person: Tatyana A. Ruzhentsova, ruzhencova@gmail.com
Purpose of the study was to evaluate the effect of the pectin-based drug Zosterin-Ultra 60% on the inflammatory process in laboratory animals.
Material and methods. For the experimental study, 103 pieces of outbred nonlinear white mongrel SHK mice aged 8–10 weeks were used. At the first stage, with the participation of 50 mice, a solution of iota-carrageenan was selected as a substance that optimally simulates the local inflammatory process. At the second stage, the main group (29 mice) received Zosterin-Ultra 60% (produced by Akvamir LLC, Russia, St. Petersburg) orally for 20 days before the introduction of iota-carrageenan dissolved in distilled water. The animals did not receive any additional drugs before administration of iota-carrageenan in the control group (24 mice). The severity of the inflammatory process was assessed by the difference in the weight of the paws.
Results. It was determined that Zosterin-Ultra 60% reduces the severity of the inflammatory process by 1.5 (among males) – 1.9 (among females) times, reducing the differences in the average weight of the right and left paws from 86.3 to 52.8 mg in males and from 124.8 to 42.7 mg in females after completion of the second stage.
Conclusions. 1. Zosterin-Ultra 60% when administered orally for 3 weeks significantly, 1.5–2.0 times reduces the severity of the inflammatory reaction modeled by injecting a solution of iota-carrageenan into a mouse paw. 2. The possibility of the action of Zosterin-Ultra 60% outside the gastrointestinal tract was proved during the experiment, which, given the long-term confirmation of the safety of the drug, can be used in clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.