количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Проблемы лечения рецидивирующей инфекции нижних мочевых путей
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №3
- Аннотация
- Статья
- Ссылки
Кроме того, в Научно-исследовательском институте эпидемиологии и микробиологии им. Н.Ф. Гамалеи был исследован возбудитель инфекции нижних мочевых путей (кишечная палочка), у которого выявлена способность к биопленкообразованию, что косвенно подтверждает теорию о формировании внутриклеточных бактериальных сообществ в слизистой мочевых путей.
Инфекции нижних отделов мочевых путей у женщин относятся к числу наиболее широко распространенных заболеваний. В статье приведены результаты проведенного в НИИ урологии Минздравсоцразвития России исследования эффективности и безопасности низкодозового применения фуразидина калиевой соли (Фурамаг) для профилактики рецидива инфекции нижних мочевых путей.
Кроме того, в Научно-исследовательском институте эпидемиологии и микробиологии им. Н.Ф. Гамалеи был исследован возбудитель инфекции нижних мочевых путей (кишечная палочка), у которого выявлена способность к биопленкообразованию, что косвенно подтверждает теорию о формировании внутриклеточных бактериальных сообществ в слизистой мочевых путей.
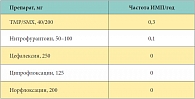
Таблица 1. Эффективность посткоитального приема антимикробных препаратов
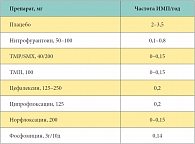
Таблица 2. Эффективность длительного профилактического приема антимикробных препаратов
Рецидивирующей инфекции нижних мочевых путей (уретрит, цистит) подвержены и молодые женщины, и женщины в менопаузе. Частые позывы к мочеиспусканию, рези и боли, связанные и не связанные с мочеиспусканием, болезненные ощущения внизу живота, неприятный запах мочи резко снижают качество жизни. У пожилых женщин в пре- и постменопаузе к климактерическим симптомам прибавляются симптомы нарушения мочеиспускания вследствие возрастного снижения тонуса тканей, гормональной перестройки организма, атрофии уротелия. На этом фоне развивается бактериальная инфекция мочевых путей.
Трудности лечения рецидивирующей инфекции нижних мочевых путей (РИНМП) обусловлены прежде всего свойствами микроорганизмов – возбудителей мочевой инфекции и особенностями местной неспецифической реакции слизистой оболочки мочевых путей. У большинства женщин реинфекции вызываются повторной колонизацией периуретральной области микроорганизмами из кишечной флоры и дальнейшим восхождением в уретру и мочевой пузырь [2].
Среди факторов риска у молодых женщин можно выделить использование спермицидов, смену сексуального партнера, а также наличие инфекции мочевых путей (ИМП) у матери и эпизоды ИМП в детстве [1]. Как отмечено в Руководстве Европейской ассоциации урологов [3], несколько поведенческих манер также могут играть роль в повышении риска РИНМП, однако четкой связи между ними не прослеживается. К ним относятся недостаточный питьевой режим, привычка задерживать мочеиспускание, особенно после полового акта, подтирание после дефекации «сзади – вперед», ношение тесной обтягивающей одежды. У пожилых женщин факторами риска считаются частые половые контакты, недержание и неудержание мочи, цистоцеле, эпизоды инфекции нижних мочевых путей перед менопаузой в анамнезе и наличие остаточной мочи [4]. Отмечена также роль генетических мутаций, поражающих врожденный иммунный ответ, как у взрослых, так и у детей.
Существуют специфические и неспецифические подходы к профилактике рецидива инфекции мочевых путей. Зная о факторах риска, можно удлинить безрецидивный период, уменьшив количество половых контактов и частоту использования спермицидов. Альтернативные методы профилактики РИНМП включают изменения поведения, использование местных эстрогенов (у женщин в постменопаузе), препаратов клюквы, пробиотиков и иммунопрофилактику. Эстрогены уменьшают атрофию вагинального и уретрального эпителия у пожилых женщин. Если при пероральном приеме эстрогенов не отмечалось уменьшения числа рецидивов инфекции нижних мочевых путей, то прекрасные результаты получены при местном применении эстрадиола [5, 6]. В одном рандомизированном плацебо-контролируемом 8-месячном исследовании показано уменьшение риска рецидива инфекции нижних мочевых путей и восстановления вагинальной микрофлоры в результате вагинального использования эстриола [7]. В этом исследовании уровень частоты рецидивов инфекции нижних мочевых путей в группе, получавшей плацебо, составил 5,9 в год, по сравнению с группой, получавшей интравагинально эстриол, – 0,5 эпизодов ИНМП в год.
Широко используют для профилактики ИНМП препараты и сок клюквы. В базе данных Кохрейна опубликован систематический обзор 10 исследований (общее число пациентов равно 1049) эффективности применения препаратов клюквы [8]. Метаанализ, включавший 4 исследования (Kontiokari, 2001; Stothers, 2002; Waites, 2004; McMurdo, 2005), показал, что продукты клюквы значительно снижали число рецидивов инфекции мочевых путей в течение 12 месяцев (RR 0,66; Cl 0,47–0,92) по сравнению с плацебо. У пациентов с мочевой инфекцией, интермиттирующей катетеризацией или постоянными катетерами на фоне нейрогенного мочевого пузыря, эффективность препаратов не наблюдалась. Известно, что клюква содержит 90% воды и органические субстанции (хинная кислота, янтарная и лимонная кислота, глюкоза и фруктоза). Хинная кислота вызывает экскрецию с мочой большого количества гиппуровой кислоты, которая действует как антибактериальный агент. Точный механизм действия препаратов клюквы неизвестен, но полагают, что клюква предотвращает адгезию бактерий (в основном E.coli) к уроэпителиальным клеткам слизистой мочевого пузыря. Эта адгезия in vitro опосредуется 2 компонентами клюквы: фруктозой, которая ингибирует адгезию фимбрий 1-го типа (маннозоспецифические) E.coli, и субстанциями, называемыми проантоцианидинами, которые ингибируют адгезию Р-фимбрий E.coli.
Антимикробная профилактика высокоэффективна в уменьшении риска развития рецидива ИНМП. Предлагаются разные режимы дозирования антимикробных препаратов – длительная профилактика, посткоитальная профилактика и интермиттирующий прием антимикробных препаратов самостоятельно. В таблице 1 показана эффективность посткоитального приема антимикробных препаратов, а в таблице 2 – эффективность длительного приема антимикробных препаратов в субингибирующих дозах при профилактике рецидивов ИНМП, по данным руководства экспертов по ведению урогенитальной инфекции [1]. Подбор дозировки обусловлен частотой, характером РИНМП и готовностью пациентки соблюдать специфический режим. Выбор антибиотика зависит от возбудителя инфекции и его чувствительности к антимикробным препаратам, а также учитывает наличие аллергии на препараты. При длительном антимикробном лечении основной опасностью является селекция резистентных возбудителей. Например, резистентность уропатогенной кишечной палочки ко многим антибиотикам и, в частности, ко всем цефалоспоринам, которая обусловлена энзимами, вызывающими их гидролиз – беталактамазами расширенного спектра действия (БЛРС) [9]. Появление такого возбудителя в амбулаторной практике, особенно относящегося к инфекции нижних мочевых путей, значительно уменьшает выбор антимикробных препаратов для ее лечения и профилактики рецидивов. CTX-М ?-лактамаза-продуцирующие энтеробактерии, которые найдены у амбулаторных пациентов и выделены от пациенток с хроническим циститом, также устойчивы к хинолонам, аминогликозидам и сульфониламидам.
Последнее международное исследование резистентности возбудителей неосложненной мочевой инфекции – ARESC – было проведено в 2006 г. в Бразилии и 9 странах Европы (в том числе и в России) [10]. Из нашей страны в ARESC приняли участие 656 пациенток (647 подошли для исследования). У 419 пациенток (64,7%) был определен положительный результат культурального исследования мочи (> 104 КОЕ/мл), у 393 пациенток (93,8%) установлена моноинфекция. В центральной лаборатории Генуи (куда направлялись все выделенные изоляты) всего были протестированы 416 уропатогенов от 399 больных. Наиболее часто выделяли E.coli (72,6%), Enterococcus (7,0%), Klebsiella pneumonia (4,6%), Staphylococcus saprophyticus (3,6%), Proteus mirabilis (2,4%) и Staphylococcus aureus (1,7%). Самый высокий уровень чувствительности E.сoli был зарегистрирован к фосфомицину (99,3%), мециллинаму (97,3%), нитрофурантоину (94,7%) и ципрофлоксацину (87,4%). Самый низкий уровень чувствительности – к ампициллину (42,1%) и ко-тримоксазолу (69,4%). В целом по всему спектру антимикробных препаратов наибольшая чувствительность была к фосфомицину (96,5%), нитрофурантоину (85,6%) и ципрофлоксацину (82,8%). Наименьшие уровни чувствительности были к ампициллину (44,3%) и ко-тримоксазолу (70,1%).
В недавнем исследовании резистентности возбудителей мочевых патогенов в Канаде [11] в 2007–2009 гг. было обследовано 2943 возбудителя мочевой инфекции, из которых 54% – E.coli, 14% – Enterococcus, 9% – Klebsiella pneumoniae, 4% – Proteus mirabilis. Чувствительность нитрофурантоина была у E.coli – 96%, Enterococcus – 97%, Klebsiella pneumoniae – 33% и S.aureus – 100%, в отличие от показателей ципрофлоксацина – 81%, 40%, 86%, 66% соответственно. За 3 года отмечен рост уровня резистентности возбудителей для амоксициллин-клавуланата (с 1,8% до 6,6%; р < 0,001) и сульфаметоксазола (с 18,6 до 23,4%; р < 0,02).
В исследовании S. Auer [12] была изучена чувствительность к разным антимикробным препаратам возбудителей, выделенных от амбулаторных пациентов, большинство из которых обратились по поводу инфекции нижних мочевых путей. За 3 года (2005–2007) было обследовано 6066 штаммов Escherichia coli, из них 90 штаммов (1,48%) – БЛРС-продуценты. Определили чувствительность к фосфомицину трометамолу – 97%, к мециллинаму – 85%, нитрофурантоину – 94%, триметоприм/сульфаметоксазолу – 27%, гентамицину – 78%, а к ципрофлоксацину – всего 22%.
Таким образом, исходя из чувствительности возбудителей неосложненной инфекции нижних мочевых путей для эмпирического выбора антимикробного препарата наиболее подходящими являются фосфомицина трометамол и нитрофураны (мециллинам в России не зарегистрирован, гентамицин – препарат для иньекций, что представляет сложность применения в амбулаторной практике). Хотя имеются также и защищенные бета-лактамы, и цефалоспорины, и препараты бактериофагов, однако для эмпирического лечения неосложненной инфекции мочевых путей рекомендуется назначать препараты, которые не используются по другим показаниям.
Материал и методы исследования
В НИИ урологии Минздравсоцразвития России в 2010–2011 гг. было проведено когортное проспективное несравнительное исследование по оценке эффективности и безопасности низкодозового применения фуразидина калиевой соли (Фурамаг) для профилактики РИНМП у женщин в реальной клинической практике. В исследование включали женщин (кроме беременных) с РИНМП, обратившихся в поликлинику института. Всем пациенткам были проведены бактериологическое исследование средней порции утренней мочи, ПЦР-диагностика инфекций, передаваемых половым путем (Chlamidia trachomatis, Mycoplasma genitalium, M.hominis, половой герпес 1 и 2 типа), осмотр гинеколога, взяты общий анализ мочи, микроскопия мазков из уретры, влагалища и шейки матки, выполнены УЗИ почек, мочевого пузыря и половых органов. Пациентки заполняли дневник, где указывали частоту мочеиспускания (по часам), прием жидкости в течение дня, наличие боли, рези, жжения при мочеиспускании.
Ни у одной из 76 пациенток на момент исследования не обнаружено заболеваний, передающихся половым пу тем.
В анамнезе 4 пациентки указали наличие в анализах из влагалища уреаплазм, одна – хламидий, одна – генитального герпеса. Все эти заболевания были пролечены несколько лет назад. При осмотре и ультразвуковом исследовании почек у 4 пациенток с рецидивирующим циститом выявлена подвижная правая почка в ортостазе, в пределах 1,5–2 позвонков (больным были проведены рентгенологические исследования – обзорный снимок мочевых путей и экскреторная урография). Женщинам были даны рекомендации (ношение корсета, лечебная физкультура, контроль артериального давления в клиностазе и через 15 минут ходьбы в ортостазе), а также рекомендовано провести динамическую нефросцинтиграфию для определения исходной функции почек. Все пациентки страдали рецидивирующей инфекцией нижних мочевых путей в течение длительного времени, некоторые с детства, в среднем продолжительность заболевания составила 8 лет (от 1 года до 30 лет). Основным условием участия в исследовании было наличие возбудителей в моче, что подтверждалось бактериологическим исследованием.
Однако необходимо заметить, что РИНМП характеризуется периодами обострения и периодами безрецидивного течения. Как правило, пациентки с рецидивирующей инфекцией не приходят на консультацию к врачу в острый период, они самостоятельно начинают принимать антимикробные препараты исходя из предшествующих врачебных консультаций и собственного многолетнего опыта. Поэтому наличие стерильной мочи при периодическом обследовании не означает излеченности пациентки, так как вероятность РИНМП велика. Врач принимает решение о длительной антимикробной профилактике РИНМП, анализируя большое число анализов мочи в течение длительного времени, которые пациентки обычно тщательно собирают и приносят на консультацию.
В исследование были включены женщины только с положительным культуральным исследованием мочи. В 62,5% случаев у больных возбудителем РИНМП была кишечная палочка, в 25% – Klebsiella pneumonia и в 12,5% – Proteus mirabilis. Все микроорганизмы высевались в диагностически значимом титре – микробное число от 105 до 108 КОЕ/мл мочи.
Всем пациенткам была назначена фуразидина калиевая соль (Фурамаг) по 50 мг на ночь в течение 3 месяцев. Фурамаг содержит смесь фуразидина калиевой соли и магния карбоната основного (в соотношении 1:1), поэтому при приеме внутрь он имеет более высокую биодоступность, чем обычный фуразидин (Фурагин). Концентрация фуразидина в крови и тканях после приема Фурамага (сохраняется от 3 до 7–8 ч) сравнительно небольшая, концентрация в моче значительно выше, чем в крови (обнаруживается через 3–4 ч). Фурамаг незначительно биотрансформируется (меньше 10%), при снижении функции почек интенсивность метаболизма возрастает. Фурамаг выделяется почками путем клубочковой фильтрации и канальцевой секреции (85%), частично подвергается обратной реабсорбции в канальцах. При низких концентрациях в моче преобладают процессы фильтрации и секреции, при высоких уменьшается секреция и увеличивается реабсорбция. При кислой реакции мочи увеличивается реабсорбция, при щелочной – выведение. Фурамаг активен в отношении грамположительных и грамотрицательных микроорганизмов (Streptcoccus, Staphylococcus, E.coli, Enterococcus, Salmonella, Shigella, Proteus, Klebsiella, Enterobacteriaceae), простейших (Lamblia) и др. микроорганизмов. Препарат нарушает окислительно-восстановительные реакции в микробной клетке, разрушает микробную стенку и/или цитоплазматическую мембрану. Фурамаг – бактерицидный препарат, инактивирует и изменяет протеины бактериальной рибосомы и другие макромолекулы [12]. Эффективность и безопасность Фурамага доказаны в многочисленных клинических исследованиях у взрослых и детей [15].
Результаты профилактического лечения рецидивов неосложненной инфекции нижних мочевых путей У большинства пациенток отмечен положительный результат лечения – отсутствие роста возбудителей и рецидивов заболевания в течение 3 месяцев наблюдения. Однако необходимо понимать, что эффективность лечения персистирующей инфекции не просто оценивается по конечному отрицательному культуральному анализу мочи, цель лечения – увеличение безрецидивного периода. Если женщины до лечения отмечали клинические симптомы инфекционного процесса, выражающиеся в дизурии, частом мочеиспускании, болях и резях при мочеиспускании в среднем до 6–15 раз в год, то в период лечения в течение 3 месяцев у 73% пациенток не выявлено ни одного рецидива, а у оставшихся 27% – 1–3 обострения. В 17% случаев отмечали смену возбудителя в моче (Klebsiella pneumonia, Proteus mirabilis). В этом случае трудно определить эффективность антимикробного препарата, так как произошла эрадикация первичного патогена (кишечной палочки).
Появление устойчивости к Фурамагу отмечено в 5% случаев, что потребовало смены антимикробного препарата (по чувствительности). Из нежелательных побочных эффектов Фурамага в 3 случаях была отмечена тошнота и в 1 случае – судороги в ногах, что, однако, не потребовало отмены препарата (5%).
Микроорганизмы существуют в биопленках, которые они формируют на биотических и абиотических поверхностях, в том числе и в слизистых оболочках мочевых путей, кишечника и влагалища, поэтому микроорганизмы чрезвычайно устойчивы к антибактериальной терапии и факторам иммунной защиты хозяина [13]. У 20 пациенток с рецидивирующим колибациллярным циститом был выделен и отсеян возбудитель (кишечная палочка), который в дальнейшем исследовали на способность к биопленкообразованию в Научноисследовательском институте эпидемиологии и микробиологии им. Н.Ф. Гамалеи.
Определение способности возбудителей цистита образовывать биопленку
Для количественного анализа способности тестируемой культуры образовывать биопленки ночную бактериальную культуру разводили до 103–102 клеток в L-бульоне, переносили в стерильную 96-луночную микротитровальную плашку по 150–200 мкл и растили в термостате при 37о С. Таким образом бактерии, способные образовать биопленку, прикреплялись к внутренней поверхности лунки. Через 1–2 суток в каждую лунку вносили по 10 мкл краски кристаллвиолет и давали клеткам прокраситься в течение 30 минут. Далее лунки промывали дистиллированной водой 3 раза, чтобы удалить клетки, не прикрепившиеся к стенкам. После промывания в каждую лунку на 30–60 минут вносили по 200 мкл 96%-ного спирта, чтобы растворить краску, оставшуюся в клетках, прикрепленных к внутренним стенкам лунки, то есть клетках биопленки. Оптическую плотность определяли на фотометре iEMS Reader MF (Labsystems, Швеция), используя длину волны 540 нм: чем больше оптическая плотность, тем больше образованная биопленка. В результате у всех изучаемых возбудителей кишечной палочки была определена способность к биопленкообразованию.
Мы не стали проводить сравнительные исследования низкодозовых режимов Фурамага и других антимикробных препаратов, которые рекомендуются в разных руководствах. Дело в том, что пациентки, страдающие в течение длительного времени рецидивирующим циститом, получали лечение и фторхинолонами, и фосфомицином трометамолом, и защищенными бета-лактамными антибиотиками, и цефалоспоринами. К сожалению, после окончания любого курса антимикробной терапии рецидивирование инфекции отмечается в те или иные сроки. В нашем исследовании обострение наблюдалось через 4–7 месяцев, через 1,5 года после лечения у 13% пациенток (мы их активно не наблюдали, пациентки обратились в поликлинику самостоятельно). Две женщины после курса профилактического лечения успешно забеременели и родили здоровых детей.
Выводы
Таким образом, наше исследование показало высокую эффективность и безопасность длительной антимикробной профилактики рецидивов неосложненной инфекции нижних мочевых путей фуразидина калиевой солью (Фурамагом) в субингибирующей дозе – 50 мг на ночь в течение 3 месяцев. У 73% пациенток не отмечено ни одного рецидива, у 27% число рецидивов ИНМП снизилось почти в 5 раз за период наблюдения. В то же время выявленная способность к биопленкообразованию у всех исследуемых штаммов уропатогенной кишечной палочки, выделенной у больных с рецидивирующим циститом, косвенно подтверждает теорию о формировании внутриклеточных бактериальных сообществ в слизистой мочевых путей [14]. Необходимы дальнейшие научные исследования в этом направлении для решения труднейшей проблемы – лечения и профилактики рецидивирующей инфекции нижних мочевых путей.
1. Hooton T.M. Prevention of recurrent urogenital tract infections in adult women: an introduction // Urogenital Infections / Naber K., Schaeffer A.J., Chris F.H. et. al. eds. Edition European Association of Urology. 2010. P. 236–240.
2. Norrby S.R., Rylander M., Sandberg T. et al. Coordinated multicenter study of norfloxacin versus trimethoprim-sulfamethoxazole treatment of symptomatic urinary tract infections // J. Infect. Dis. 1987. Vol. 155. P. 170–177.
3. Grabe M., Bjerklund-Johansen T.E., Botto H. et. al. Guidelines on urological infections // Guidelines European Association of Urology, 2011. P. 20–21.
4. Moore E.E., Hawes S.E., Scholes D. et. al. Sexual intercourse and risk of symptomatic urinary tract infection in post-menopausal women // Gen. Intern. Med. 2008. Vol. 23(5). P. 595–9.
5. Perrotta C., Aznar M., Mejia R. et. al. Oestrogens for preventing recurrent urinary tract infection in postmenopausal women // Cochrane Database Syst. Rev. 2008. Vol. (2). CD005131.
6. Eriksen B. A randomized, open, parallel-group study on the preventive effect of an estradiol-releasing vaginal ring (Estring) on recurrent urinary tract infections in postmenopausal women // Am. J. Obstet. Gynecol. 1999. Vol. 180 (5). P. 1072–1079.
7. Raz R., Stamm W.E. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections // N. Engl. J. Med. 1993. Vol. 329 (11). P. 753–756.
8. Jepson R.G., Craig J.C. Cranberries for preventing urinary tract infections (review) // Cochrane database of Systematic Reviews. 2008. Issue 1. Art No: CD001321.
9. Turner P.J. Extended-spectrum beta-lactamases // Clin. Infect. Dis. 2005. Vol. 41. P. 273–275.
10. Schito G.C., Naber K.G., Botto,J. Palou, et. al. The ARESC study: international survey on the antimicrobial resistance of pathogens involved in uncomplicated urinary tract infections // Antimicrob. Agents and Chemotherapy. 2009. Vol. 34. Р. 407–413.
11. Karlowsky J. A., Lagace-Wiens Ph. R.S., Simner P. J. et. al. Antimicrobial Resistance in Urinary Tract Pathogens in Canada from 2007 to 2009: CANWARD Surveillance Study // Antimicrob. Agents and Chemotherapy. 2011. Vol. 55 (7). Р. 3169–3175.
12. Auer S., Wojna A., Hell M. Oral Treatment Options for Ambulatory Patients with Urinary Tract Infections Caused by Extended-Spectrum-β-Lactamase-Producing Escherichia coli // Antimicrob. Agents and Chemotherapy. 2010. P. 4006–4008.
13. Anderson G. et al. Intracellular Bacterial Biofilm-Like Pods in Urinary Tract Infections // Science. 2003. Vol. 301. P. 105.
14. Garofalo C.K., Hooton Th.M., Martin S.M. et. al. Hultgren Escherichia coli from Urine of Female Patients with Urinary Tract Infections Is Competent for Intracellular Bacterial Community Formation // Infection and immunity. 2007. Vol. 75 (1).P. 52–60.
15. Перепанова Т.С., Хазан П.Л. Применение нитрофуранов при инфекции мочевых путей. Эффективная фармакотерапия. Урология. 2007. № 4. С. 20–30.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.