Ранние и отдаленные исходы ишемического инсульта у пациентов с инсульт-ассоциированной пневмонией
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Под наблюдением находилось 95 пациентов с ишемическим инсультом. Их разделили на две группы: первая (n = 41) – c развившейся инсульт-ассоциированной пневмонией, вторая (n = 54) – без инфекционных осложнений.
В данной когорте больных выраженность неврологического дефицита (по NIHSS, индексу Бартела), состояние когнитивных функций (по MMSE и MoCA), клеточный состав периферической крови оценивали в 1-е и 9–11-е сутки ишемического инсульта, далее через 6 и 12 месяцев после выписки из стационара.
Результаты. С риском развития инсульт-ассоциированной пневмонии связано увеличение соотношения «нейтрофилы/моноциты».
На момент выписки из стационара в группе инсульт-ассоциированной пневмонии отмечались более высокий уровень госпитальной летальности, более тяжелый неврологический дефицит и когнитивные нарушения.
По прошествии шести месяцев в отношении выраженности неврологических и когнитивных нарушений достоверных различий между группами не выявлено.
Материал и методы. Под наблюдением находилось 95 пациентов с ишемическим инсультом. Их разделили на две группы: первая (n = 41) – c развившейся инсульт-ассоциированной пневмонией, вторая (n = 54) – без инфекционных осложнений.
В данной когорте больных выраженность неврологического дефицита (по NIHSS, индексу Бартела), состояние когнитивных функций (по MMSE и MoCA), клеточный состав периферической крови оценивали в 1-е и 9–11-е сутки ишемического инсульта, далее через 6 и 12 месяцев после выписки из стационара.
Результаты. С риском развития инсульт-ассоциированной пневмонии связано увеличение соотношения «нейтрофилы/моноциты».
На момент выписки из стационара в группе инсульт-ассоциированной пневмонии отмечались более высокий уровень госпитальной летальности, более тяжелый неврологический дефицит и когнитивные нарушения.
По прошествии шести месяцев в отношении выраженности неврологических и когнитивных нарушений достоверных различий между группами не выявлено.
Инсульт – одна из наиболее частых причин летального исхода и стойкой нетрудоспособности. Острые нарушения мозгового кровообращения занимают пятое место по показателю «суммарное бремя болезни» (Disability-Adjusted Life Year – DALY) [1].
Ишемический инсульт (ИИ) встречается в четыре – семь раз чаще, чем геморрагический [2].
Основными причинами летального исхода при ИИ являются отек и дислокация головного мозга при обширном очаге поражения, тромбоэмболия легочной артерии, острый коронарный синдром и инфекционные осложнения [3].
При остром ИИ чаще инфицируются нижние отделы дыхательных и мочевыводящей путей [4, 5].
Тяжелым осложнением ИИ признана инсульт-ассоциированная пневмония (ИАП). Развитие данной патологии связывают не только с аспирацией пищи и содержимого ротовой полости или нарушением легочной вентиляции, но и с нарушением иммунитета. Последнее обусловлено поражением вещества головного мозга, системной и локальной воспалительной реакцией организма, процессами нейровоспаления [6, 7].
Несмотря на длительную историю изучения ИАП, сохраняется актуальность оценки ее влияния на ранние и отдаленные исходы ИИ и поиска ранних методов диагностики.
Целью настоящего исследования стала оценка влияния ИАП на исходы ИИ.
Материал и методы
Под наблюдением находилось 95 пациентов с ИИ, у 41 из которых развилась ИАП (первая группа), у 54 – инфекционные осложнения отсутствовали (вторая группа).
Всем больным проводилось лабораторно-инструментальное обследование и унифицированное лечение в соответствии со стандартами оказания медицинской помощи при остром нарушении мозгового кровообращения (клинические рекомендации, приказы Минздрава России от 15.11.2012 № 928Н «Об утверждении порядка оказания медицинской помощи больным с острыми нарушениями мозгового кровообращения» и от 29.12.2012 № 1740Н «Об утверждении стандарта специализированной медицинской помощи при инфаркте мозга»).
По окончании курса терапии в отделении для лечения пациентов с острым нарушением мозгового кровообращения участники исследования получали препараты для вторичной профилактики ИИ, прошли амбулаторный курс восстановительного лечения, объем и направленность которого определялись характером и выраженностью неврологического дефицита.
Протокол исследования был одобрен этическим комитетом медицинского факультета Кабардино-Балкарского государственного университета им. Х.М. Бербекова.
Критерии включения в исследование:
- острый первичный или повторный ИИ, подтвержденный результатами компьютерной томографии (КТ) головного мозга;
- ИИ в каротидной или вертебрально-базилярной системе;
- нелакунарный ИИ.
Критерии исключения:
- геморрагический инсульт;
- лакунарный ИИ;
- тромбоэкстракция или тромболитическая терапия;
- острые или перенесенные ранее травматические, воспалительные, опухолевые заболевания головного мозга с очаговым неврологическим дефицитом;
- острое инфекционное заболевание, предшествующее ИИ;
- необходимость проведения искусственной вентиляции легких в первые сутки госпитализации.
Диагноз ИИ устанавливали на основании клинической картины, результатов КТ головного мозга, ультразвуковой допплерографии экстра – и интракраниальных артерий.
Для установления когнитивных нарушений использовали Краткую шкалу оценки психического статуса (Mini-Mental State Examination – MMSE) и Монреальскую шкалу оценки когнитивных функций (Montreal Cognitive Assessment – МоСА).
Выраженность неврологического дефицита оценивали по Шкале инсульта Национального института здоровья (National Institutes of Health Stroke Scale – NIHSS), уровень бодрствования – по Шкале комы Глазго (Glasgow Coma Scale – GCS), степень инвалидизации – по индексу Бартела (Barthel Index – BI).
Для диагностики ИАП было необходимо наличие не менее одного из нижеперечисленных критериев [8, 9]:
- лихорадка более 38 °C без иной установленной причины;
- лейкоцитоз более 12 000 в мм3;
- для пациентов старше 70 лет:
- угнетение сознания без других установленных причин;
- не менее двух из нижеперечисленных критериев:
- впервые появившаяся гнойная мокрота или изменение характера мокроты на протяжении 24 часов/увеличение объема секрета из дыхательных путей/потребность в более частой санации бронхиального дерева;
- впервые возникшие или нарастающие по интенсивности кашель/диспноэ/тахипноэ (более 25 в минуту);
- крепитация или хрипы при аускультации;
- нарушение показателей газообмена (PaO2/FiO2 ≤ 240 мм рт. ст.);
- потребность в ингаляции кислородом, а также наличие изменений на рентгенограмме легких (впервые возникший или нарастающий инфильтрат, уплотнение или область консолидации) не менее чем при одном из не менее чем двух исследований.
Лабораторное исследование включало клинический анализ крови (формула крови, скорость оседания эритроцитов (СОЭ), соотношение «нейтрофилы/моноциты»), биохимический анализ крови с определением концентрации общего белка, глюкозы, мочевины, креатинина, С-реактивного белка (СРБ).
Обследование проводилось в 1-е и 9–11-е (на момент выписки из стационара) сутки ИИ, а также через 6 и 12 месяцев после выписки.
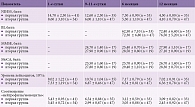
Исходная характеристика больных представлена в табл. 1.
Группы оказались сопоставимы по количеству мужчин и женщин, уровню бодрствования по GCS, локализации очага инфаркта, значениям систолического артериального давления (САД) и диастолического артериального давления (ДАД), уровню глюкозы в капиллярной крови. В первые сутки инсульта наблюдалась тенденция к умеренной гипергликемии, не требовавшей медикаментозной коррекции и расцененной как стрессовая. Вместе с тем в первой группе больные оказались достоверно старше и с более выраженным неврологическим дефицитом. Кроме того, за время пребывания в стационаре они чаще умирали.
Результаты исследования обработаны статистически с помощью пакета программ SPSS 20.
Для оценки связи между независимыми переменными использовали коэффициент корреляции Пирсона (r) и точный критерий Фишера с поправкой Йейтса для малых выборок.
Статистически значимыми признавались различия при р < 0,05.
Результаты
На фоне проводимой терапии у пациентов обеих групп уменьшилась выраженность неврологического дефицита по NIHSS. Относительно исходных данных улучшение было достоверным во второй группе уже на момент выписки из стационара, в первой – только через шесть месяцев (табл. 2).
Через шесть месяцев неврологический дефицит сильнее был выражен у пациентов первой группы, однако различия между группами не носили достоверного характера.
Не установлено существенной разницы между группами в выраженности неврологического дефицита и его динамике у больных с очагом ИИ в каротидной или вертебрально-базилярной системе. Однако у пациентов первой группы чаще наблюдалась дизартрия и дисфагия в рамках бульбарного или псевдобульбарного синдрома, обусловленного ИИ.
Оценка когнитивных функций по MMSE и МоСА показала, что в первой группе на момент выписки из стационара имело место более выраженное нарушение. Через 6 и 12 месяцев в обеих группах значения по MMSE и МоСА достоверно увеличились по сравнению с исходными. Однако на шестом месяце в отсутствие статистически значимых различий между группами показатели были несколько ниже у пациентов первой группы.
Согласно результатам лабораторных исследований, на момент госпитализации между группами отсутствовали статистически значимые различия по количеству лейкоцитов, нейтрофилов, СОЭ и СРБ. Вместе с тем соотношение «нейтрофилы/моноциты» было достоверно выше как в 1-е, так и в 9–11-е сутки ИИ. Через 6 и 12 месяцев указанные показатели приблизились к нормальным и не отличались у больных двух групп.
При анализе потенциальных факторов риска развития ИАП установлена связь между поражением нижних отделов дыхательных путей и возрастом больных (r = 0,572; p < 0,05), исходной тяжестью неврологического дефицита (r = 0,488; p < 0,05), сахарным диабетом (r = 0,522; p < 0,05), дисфагией (r = 0,672; p < 0,05).
С развитием ИАП коррелировали высокие значения соотношения «нейтрофилы/моноциты» в первые сутки ИИ (r = 0,768; p < 0,05). Такого рода связь отсутствовала для абсолютного количества лейкоцитов, относительного содержания нейтрофилов и СОЭ.
Заключение
Развитие ИАП повышает риск летального исхода.
Полученные данные свидетельствуют, что риск развития ИАП выше у пациентов старшего возраста, с исходно более тяжелым неврологическим дефицитом, страдающих сахарным диабетом. Чувствительным маркером в отношении развития ИАП является соотношение «нейтрофилы/моноциты».
У пациентов с ИАП неврологический дефицит восстанавливается медленнее. Так, через полгода его выраженность достоверно выше у пациентов с ИАП, чем у больных без ИАП. На фоне реабилитационного лечения степень неврологического дефицита и независимости в повседневной жизни между группами с и без ИАП практически не различается. Через год с момента развития ИИ разница между группами нивелируется.
Своевременная клинико-лабораторная диагностика ИАП и прогнозирование этого тяжелого и опасного осложнения позволяют улучшить ранние и отдаленные исходы ИИ.
L.V. Santikova, D.T. Chipova, PhD, A.Ch. Zhemukhov, L.B. Tlapshokova, PhD, prof.
Kabardino-Balkarian State University named after H.M. Berbekov
City clinical hospital No. 1, Nalchik
Contact person: Dinara T. Chipova, dinara.chipova@mail.ru
Objective – to study the effect of stroke-associated pneumonia on early and long-term outcomes of ischemic stroke.
Material and methods. 95 patients with ischemic stroke were under observation. They were divided into two groups: the first (n = 41) – with stroke-associated pneumonia, the second (n = 54) – without infectious complications.
In this cohort, the severity of neurological deficits (NIHSS, Bartel index), the state of cognitive functions (MMSE and MoCA), and the cellular composition of peripheral blood were evaluated on the 1st and 9th–11th days of ischemic stroke, then 6 and 12 months after discharge from the hospital.
Results. The increase in the neutrophil/monocyte ratio is associated with the risk of stroke-associated pneumonia.
At the time of discharge from the hospital, the stroke-associated pneumonia group had the higher level of hospital mortality, more severe neurological deficits and cognitive impairments.
After six months, there were no significant differences between the groups in terms of the severity of neurological and cognitive disorders.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.